青稞抗旱基因HVUL1H24632.2 的功能驗證
于明寨,楊春葆,巴桑玉珍
(省部共建青稞和牦牛種質資源與遺傳改良國家重點實驗室/西藏自治區農牧科學院農科研究所 西藏 拉薩 850032)
青稞占西藏農作物播種面積的一半以上,是西藏最主要的糧食作物。在青藏高原上,青稞的種植約有3500年的歷史,具有廣泛的藥用以及營養價值,是西藏四寶之首糌粑的主要原料[1]。因此提高青稞品質產量對西藏農牧民增產增收具有重要意義[2]。
干旱是威脅世界作物栽培和生產的嚴重問題之一,是導致農作物減產的最嚴重制約因素,所造成減產超過其他非生物脅迫的總和。近年來,隨著全球變暖的影響,降雨不規律以及用水不當都會導致全球農作物生產面臨越來越嚴峻的干旱威脅,嚴重制約全球農業生產發展[3]。因此,從西藏農業發展以及西藏糧食安全來說,研究青稞對干旱脅迫的響應及機制都有非常重要的意義。
本研究以前序研究得到的轉錄組數據與全基因組甲基化數據為基礎[4],挖掘其中差異表達的基因,并通過BLASTP 進行比對,對候選目的基因進行注釋,選擇水稻為受體材料,探究干旱脅迫對其生理、生化指標表達水平的影響[5],以期明確HVUL1H24632.2基因序列的生物學功能。
1 材料與方法
1.1 材 料
1.1.1 試驗儀器
試驗儀器主要有:NanoDrop?One/OneC 超微量紫外分光光度計,冷凍離心機,凝膠電泳儀,PCR儀,恒溫水浴鍋,搖床酶標儀(450 nm),高精度微量加樣器及槍頭(0.5~10 uL,2~20 uL,20~200 uL,200~1000 uL),37 ℃恒溫箱等。
1.1.2 試驗試劑
試驗試劑包括:總RNA 提取試劑盒,Taq plus DNA 聚合酶,水飽和酚,cDNA 合成的反轉錄試劑盒,DNA Marker DL 2000,SYBR?Premix Ex TaqTM、植物(Plant)過氧化物酶(POD)-微量測試Kit,植物(Plant)超氧化物歧化酶(SOD)-微量測試Kit,植物(Plant)脯氨酸(proline)-微量測試Kit等。
1.1.3 試驗材料
青稞種子、水稻種子;載體:pBWA(V)BSCCDB。
1.2 方 法
1.2.1 目的基因篩選
通過轉錄組數據與全基因組甲基化數據,挖掘其中差異表達基因,并通過BLASTP 進行比對,對候選目的基因進行注釋。
1.2.2 RNA提取及cDNA合成
以RNAprep Pure 植物總RNA 提取試劑盒方法的方法來提取總RNA(表1)[6]。然后以Roche 公司反轉錄試劑盒的操作說明反轉錄獲得cDNA(表2)[7]。

表1 總RNA提取

表2 反轉錄獲取cDNA
1.2.3 目的基因的擴增
按照表3、表4 中的體系和程序對cDNA 進行PCR 擴增,擴增完的PCR 產物,用瓊脂糖凝膠電泳進行檢測[8]。然后用QIAquick?Gel Extraction Kit試劑盒對目的條帶進行切膠回收純化[9]。

表3 PCR反應體系(20 μL)

表4 PCR的反應程序
1.2.4 表達載體構建
用Eco31I 酶切載體pBWA(V)BS-CCDB,擴增的片段用Eco31I 進行酶切,回收后連接(表5)。將連接好的重組產物轉化到DH5a 感受態細胞中[10],挑取單菌落進行菌落PCR 驗證(表6)[11],最后將驗證結果陽性的菌液送去測序。將測序正確的重組表達載體轉化農桿菌EHA105。

表5 連接反應(10 μl)

表6 菌落陽性驗證(20 μl)
1.2.5 抗性水稻苗的獲取
通過農桿菌EHA105 侵染水稻愈傷組織的方法轉化水稻。之后用抗性基因特異引物,常規PCR法擴增檢測水稻苗是否含有抗性基因。然后對水稻苗進行轉基因篩選鑒定[12]。
1.2.6 轉基因幼苗的抗性鑒定
經過轉基因陽性篩選,對轉基因水稻和對照(非轉基因水稻)采用21%PEG 進行模擬干旱處理。模擬干旱處理72 h 結束后,取葉片進行POD,SOD,Pro的檢測。
2 結果與分析
2.1 候選基因分析
根據青稞基因組信息對HVUL1H24632.2 基因序列進行提取,基因序列如下:ATGTCGTCGGAGA AACAGGAGACGACGGCGGCGGTGCGCGTGCTGG GCAGATGGCGGAGCCCGTTCGTGATCCGGGTGCT GATAGCCCTTGGGCTCAAGGGCGTCGACCACGAG CTCGTGGAGGAGGCGATGGGCAACAAGAGCGAG CTGCTGCTCGCCTCCAACCCGGTGCACAAGATGA TCCCCGTGCTCCTGCACCACGGCAGGCCCGTCTC CGAGTCCCTCATCATCGTCCAGTACGTCGACGAG GCCTGGTCCTCCCATGCCCCGGCGCTCCTCCCGTC CGACCCCTACGCCCGGGCGGCCGAGCGGTTCTGG GCGCAGTACGTCGACGACAAGTTTCCTACGGCGA TCAGGGTGCTGAGGGGAAGGCTGGGCGGAGACA AGGACGAAGCGGCGGTCCAGGTTCGCGCTGCTCT GCAGCGCCTGGAAGTCGCCTTGGTCGAGTGCGGC GGAGGGAAGGATTACTTCGGCGGCGACGGCGTC GGTTACCTGGACATTGCTCTGGGGTCGCACCTCG GCTGGATCAGGGCCGTCGAGAGGATCGCTGAACT CAGGCTTCTCGACGAGGCCAAGGTTCCTAAGCTG GCCGCGTGGGCGGATCGGTTCTGCGCCCACCCGG CGGTGGCGGACGCGATGCCTGGCGTGGAAAGGT TCGTGGAGTTCAGCGTCAAGAATGACGGCGTTCT GAAGGCGGCTAGTGCTAATTCCAAGTGA。對其序列進行BLAST 分析,同源比對至tauschii glutathione S-transferase(谷胱甘肽轉移酶)。谷胱甘肽S-轉移酶普遍參與植物體內干旱、鹽、低溫、重金屬等多種非生物脅迫的調節,是一種植物應對逆境時產生的多功能蛋白酶。當生物體遇到逆境時,谷胱甘肽轉移酶發揮其抗氧化的作用,保護生物體免受逆境的損害,從而提供生物體抗逆能力[13]。因此同源分析顯示該基因對于青稞抗旱具有重要作用。
2.2 重組載體酶切和測序驗證
將PCR產物與載體框架進行酶切鏈接,構建重組載體,轉化大腸桿菌后挑取菌落經PCR鑒定為陽性重組子的單菌落,接種到含卡那霉素的LB 液體培養基內,抽提質粒進行酶切鑒定,用1%瓊脂糖凝膠電泳檢測,結果見圖1。重組質粒經酶切后得到片段大小,均與預期大小相符,通過測序比較,序列正確,證明載體構建成功。
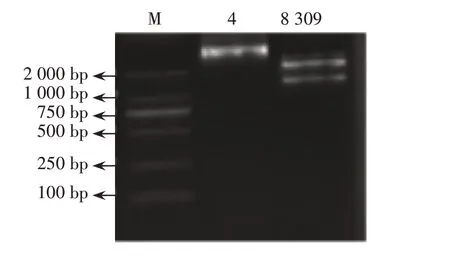
圖1 瓊脂糖凝膠電泳
2.3 菌落PCR檢測
載體構建完成后進行農桿菌轉化,對農桿菌進行菌落PCR 檢測,結果如圖2,結果顯示已正確進行農桿菌轉化。
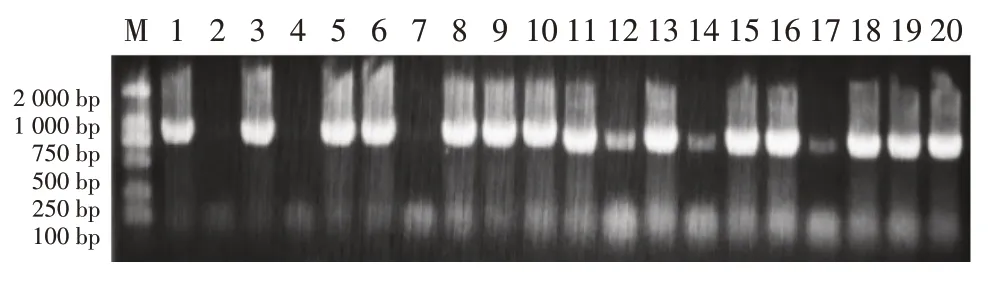
圖2 菌落PCR檢測結果
2.4 轉基因抗性苗篩選基因鑒定
經過誘導轉化的轉基因株系進行抗性基因的篩選,結果顯示轉基因苗中都含有潮霉素抗性基因,證明轉基因成功(圖3)。

圖3 轉基因抗性苗篩選基因鑒定結果
2.5 對轉基因F1檢測
對轉基因To進行自交,收獲F1代,進行陽性檢測,檢測結果如圖4。挑選陽性材料(有條帶材料)進行模擬干旱處理。
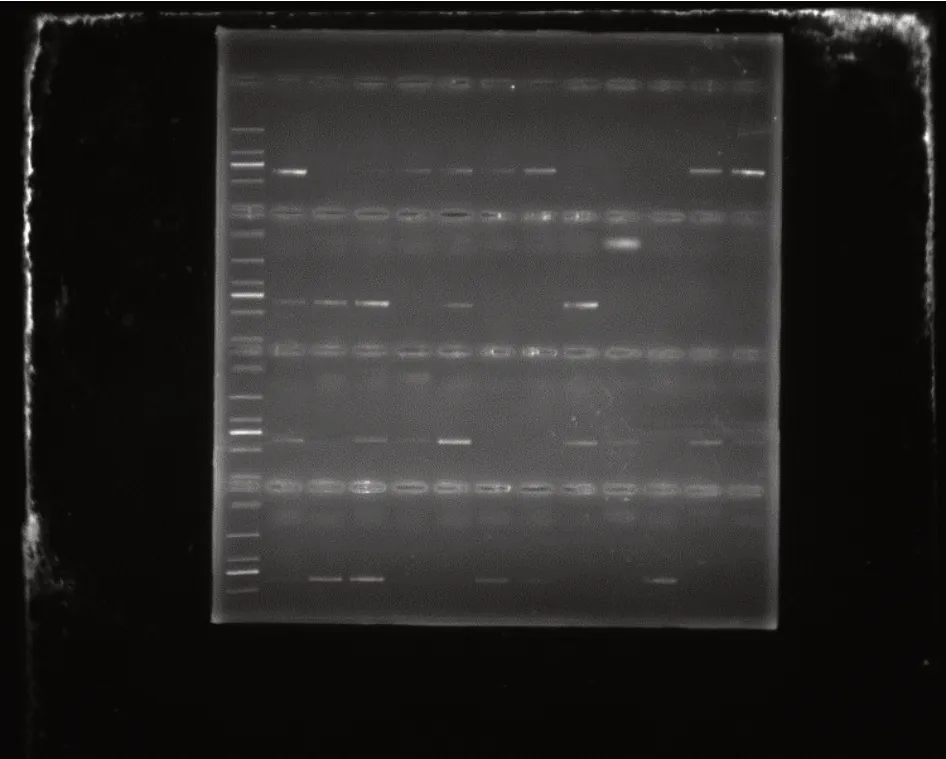
圖4 F1代陽性檢測結果
2.6 抗逆能力評估
試驗對POD,SOD,Pro 進行測定,結果顯示,對照(CK)組樣品逆境處理下POD,SOD,Pro 明顯上升,而轉基因材料有一定程度上升,上升速度較慢,說明轉基因水稻具有一定的抗逆能力(圖5)。

圖5 處理前后POD、SOD、Pro值的變化
3 結論
通過對HVUL1H24632.2基因的序列分析,評估其與谷胱甘肽轉移酶(tauschii glutathione S-transferase)同源,初步評判其具有一定抗旱能力。隨后通過載體構建與遺傳轉化,對獲得的T0 植株進行檢測,證明T0 轉基因成功。隨后通過繁種,對獲得F1 的T1 代材料進行陽性檢測,對其中陽性材料進行模擬干旱處理,結果顯示POD,SOD,Pro 含量上升較慢,而對照POD,SOD,Pro 含量上升較快,表明轉基因植株對干旱脅迫適應能力較強,植株對干旱脅迫具有一定抵抗能力,證明HVUL1H24632.2基因具有一定抗旱能力。

