125I粒子植入的靶區勾畫對一線治療后局部進展的非小細胞肺癌治療效果影響
嚴一杰,張軍,王碩,孟繁杰,王斌,關志宇
(天津醫科大學第二醫院胸外科,天津300211)
目前,125I粒子植入已成為治療晚期惡性腫瘤非常有效的手段,尤其是在治療難治性惡性腫瘤(包括腦轉移瘤、胰腺癌和軟組織腫瘤)以及晚期惡性腫瘤手術復發轉移[1]。隨著醫療技術的進步,對放射性125I粒子治療效果的認識越來越多。125I粒子植入的本質是一種精準放療,植入腫瘤病灶內的粒子能發出持續的低能輻射,直接破壞腫瘤細胞DNA的單鏈和雙鍵,降低其增殖能力[2]。靶區劃定和合理的放射劑量分布是提高療效和減少不良反應的基礎,植入125I粒子的排列與瘤體具有良好的一致性,使處方劑量完全覆蓋腫瘤靶區,從而對正常組織的輻射最小化[3]。
大體腫瘤靶區(GTV)是指腫瘤的臨床病灶,即通過影像學手段和臨床檢查可見的腫瘤。其取決于醫生的判斷和影像學檢查方法。臨床腫瘤靶區(CTV)是指潛在的腫瘤浸潤組織或亞臨床病變。計劃腫瘤靶區(PTV)是指在治療過程中由于定位誤差、治療機誤差和靶區變化而增加的外部邊界[4]。Grills等[5]通過對35例T1N0肺腺癌切除標本的分析發現,腫瘤微侵襲的平均距離為7.2 mm。我國的研究表明,在肺腺癌患者中,影像學上7 mm的GTV擴展可包括95%的病理性GTV,而在肺鱗癌中,該值為5 mm[6]。本研究回顧性分析胸部CT在腫瘤實體邊緣外7 mm進行靶區勾畫,探討其對一線治療后局部進展非小細胞肺癌(NSCLC)的療效及安全性。
1 對象與方法
1.1 研究對象 回顧性分析2017年10月—2019年12月胸外科經病理證實的NSCLC患者70例,均為放化療后腫瘤進展的患者。所有患者均簽署放射性粒子治療知情同意書。患者分為兩組,對照組35例,男性26例,女性9例,平均年齡(57.80±12.7)歲;觀察組35例,男性23例,女性12例,平均年齡(62.28±10.9)歲。
1.2 方法(1)材料與設備:西門子64排螺旋CT,北京航空航天大學治療計劃系統[Treatment-Plan-System,TPS,型號:KL-SIRPS-3D,批號:國藥管械(準)字2005第05-0699號];國產放射性125I粒子(天津賽德生物制藥有限公司,批號:國藥準字H20093298),半衰期60.2 d,粒子活度0.7 mCi,γ射線能量27~35 keV,組織穿透距離1.7 cm;平面引導模板,一次性粒子專用針。(2)靶區勾劃:由具有上崗資質的兩位醫生將術前胸部CT進行系統圖像輸入,應用TPS根據放射源及胸部CT輸入建模。對照組沿腫瘤實體邊緣勾勒靶區(圖1),觀察組沿腫瘤實體邊緣外7 mm勾劃靶區(圖2)。(3)治療計劃:處方劑量=120 Gy。(4)術前計劃、術中植入及術后驗證:將選定的處方劑量、患者基本信息、腫瘤位置、大小等數據輸入TPS,獲得植入粒子數和植入通道的排列。所有手術均在螺旋CT引導下進行,嚴格按照術前TPS計劃進行粒子植入,術后立即驗證。

圖2 按照病灶邊緣外擴7 mm勾劃靶區Fig 2 Delineatethe target area according to the extended 7 mm at theedgeof thelesion
1.3 評價標準及隨訪 術后定期行胸部CT檢查,觀察病灶有無局部復發,并隨訪1年。參照實體瘤療效評價標準1.1版(RECIST1.1)[7],將術后6個月的胸部CT與植入前的CT比較,以確定療效。包括完全緩解(CR)、部分緩解(PR)、進行性疾病(PD,病變直徑的總長度增加>20%或出現新的病變)、疾病穩定(SD:病變減少不足以評價PR或病變增加不足以評價PD)。客觀緩解率=(CR+PR)例數/總例數×100%。
1.4 統計學處理 采用SPSS 22.0統計軟件對數據進行分析。正態性分布定量資料以±s表示,組間比較采用兩獨立樣本t檢驗;定性資料以例數(百分比)表示,無序分類資料兩組間比較采用χ2檢驗或Fisher精確概率法[8]。使用Graph Pad Prism 8.0生成存活曲線,P<0.05為差異有統計學意義。
2 結果
2.1 基本情況 兩組患者的性別、年齡、病理類型、TNM分期、病灶直徑和腫瘤位置比較,差異均無統計學意義(均P>0.05),見表1。
表1 兩組基本情況比較(±s)Tab 1 Comparison of general clinical data between thetwo groups(±s)
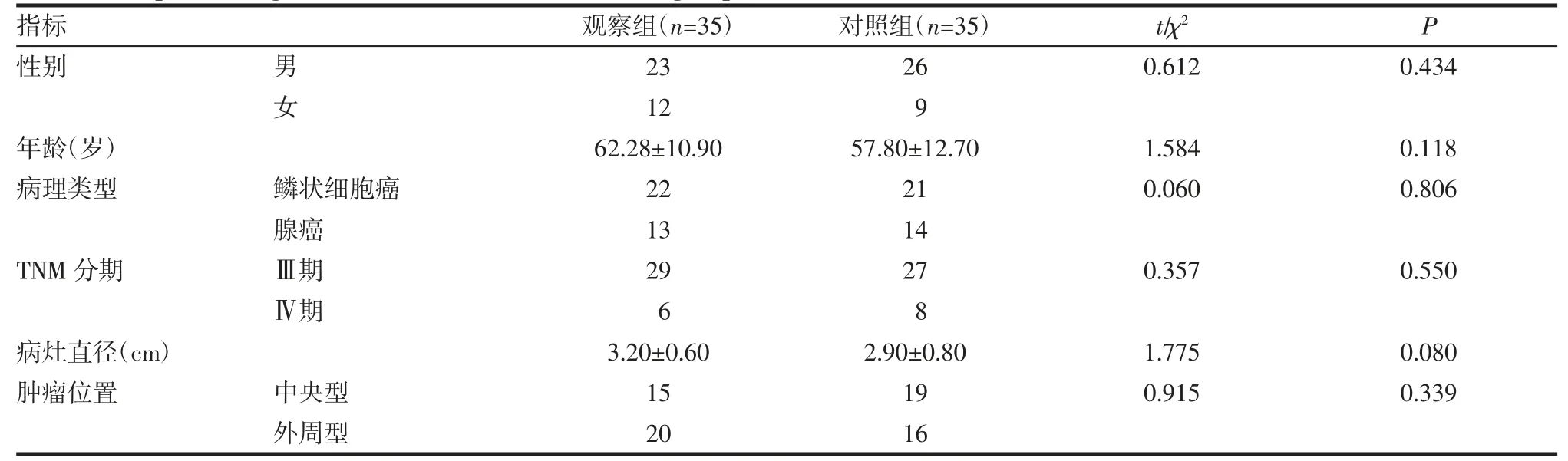
表1 兩組基本情況比較(±s)Tab 1 Comparison of general clinical data between thetwo groups(±s)
?
2.2 術后并發癥 兩組均順利完成粒子植入,術中及術后均未發生嚴重血管和器官損傷。觀察組有5例發生氣胸,其中3例經胸膜腔閉式引流后痊愈,其余2例未經有創治療自行恢復;2例出現咯血,對癥治療后好轉。對照組氣胸4例,2例經胸膜腔閉式引流后痊愈,其余2例自行好轉;2例患者出現咯血,對癥止血治療后好轉,其余未出現其他嚴重并發癥。兩組不良反應發生率比較差異無統計學意義(20.0%vs.17.1%,P=0.759)。
2.3 術后劑量驗證 兩組植入粒子數以及處方劑量、D90、平均放射劑量和V100等劑量參數比較,差異均無統計學意義(均P>0.05),見表2。對照組和觀察組術后CT輸入TPS進行術后質量驗證,劑量-體積直方圖(DVH)顯示兩組患者90%的靶體積達到處方劑量,即為術后驗證滿意(圖3、4)。
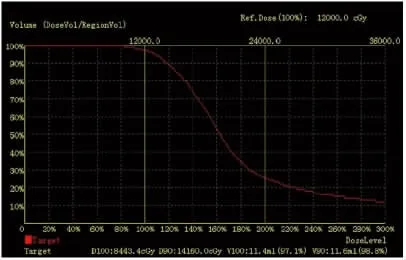
圖3 按照病灶邊緣勾劃靶區粒子術后DVH劑量驗證Fig 3 Dose verification of postoperative DVH map of target area delineated according to theedgeof focus
表2 兩組術后劑量參數(±s)Tab 2 Postoperativedoseparametersof two groups(±s)
?
2.4 術后隨訪 術后6個月復查胸部CT判定療效,觀察組CR和PR例數略高于對照組,SD和PD例數略低于對照組,客觀緩解率高于對照組,但差異均無統計學意義(均P>0.05),見表3。對照組術后原位復發患者9例(25.71%),觀察組術后原位復發患者2例(5.71%),差異有統計學意義(P=0.022)。
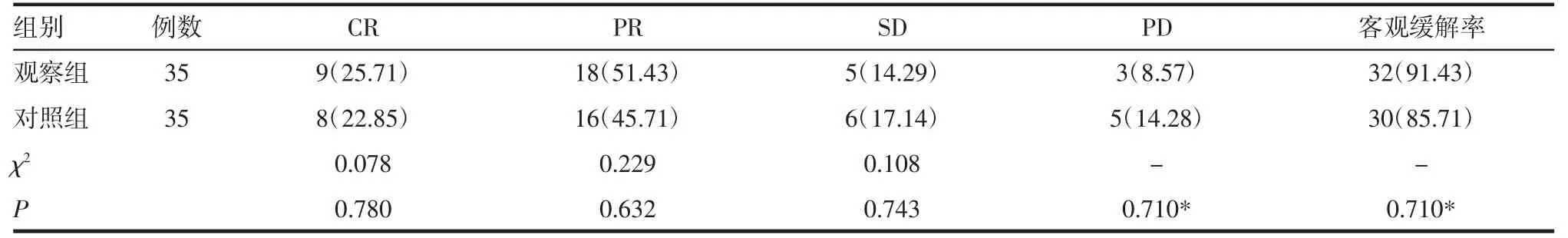
表3 兩組術后治療效果評價[n(%)]Tab 3 Evaluation of postoperativetherapeutic effect of two groups[n(%)]
全部患者完成1年隨訪,觀察組存活27例,死亡8例;對照組存活25例,死亡10例。觀察組中位無進展生存期為12.58個月,對照組中位無進展生存期為11.36個月,兩組生存曲線檢驗結果P=0.037(圖5)。
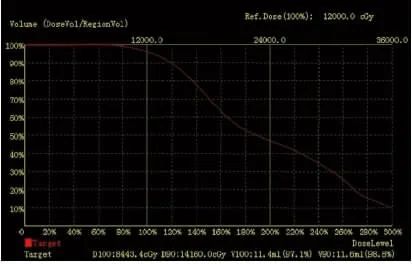
圖4 按照病灶邊緣外擴7 mm勾劃靶區粒子術后DVH劑量驗證Fig 4 Doseverification of DVH map after thetarget area delineated according to theedgeexpansion 7 mm of thelesion
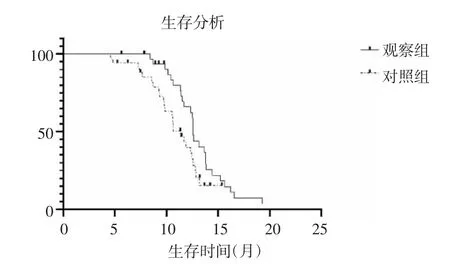
圖5 兩組生存函數曲線Fig 5 Survival function curveof two groups
3 討論
肺癌是世界上最常見的腫瘤之一,也是腫瘤死亡的主要原因。近10年來,NSCLC的治療取得了前所未有的發展。精確醫學的概念已被證明具有巨大的價值,并為腫瘤學家帶來了更多的希望和選擇。然而,目前尚無法在基因水平上對惡性腫瘤進行精確的根治。盡管放化療可以被認為是后續治療的一種選擇,但是傳統放療可以產生一系列嚴重并發癥,包括慢性阻塞性肺疾病(COPD)、放療性肺炎、放療性食管炎等[9]。
作為微創學科的產物,放射性125I粒子植入技術在臨床實踐中是一種近距離相對準確的治療方法。放射性粒子植入已成功應用于治療無法手術的孤立性肺癌,基于CT成像技術和計算機3D技術,近距離組織間植入放射粒子表現出更好的治療價值,從而改善患者生存質量。Dai等[14]分析了125I粒子植入療法的不同臨床病理特征與療效之間的相關性,發現125I粒子植入療法可以在任何臨床狀態下抑制晚期NSCLC患者的局部生長。隨著3D打印技術的臨床發展和應用,CT引導的3D模板輔助125I粒子植入技術進一步提高了在腫瘤靶區的放射效力,同時又保護了周圍脆弱的組織和器官。王喆和王若雨[15]建議NSCLC粒子治療靶區勾畫中,GTV需要外擴6~8 mm形成CTV,以確保臨床療效。基于此,本研究回顧性分析胸部CT在腫瘤實體邊緣外7 mm進行靶區勾畫,探討其對一線治療后局部進展NSCLC的療效。
本文選取的兩組病例術后采用DVH驗證劑量,對照組平均放射劑量為(243.34±17.42)Gy,觀察組平均放射劑量為(251.23±19.36)Gy,是處方劑量的近2倍,改善了因劑量不足導致的外照射不足;兩組D90均高于處方劑量,說明90%的腫瘤體積接受了高于處方劑量的輻射劑量,這也說明放射劑量的分布是合理的。結果顯示對照組復發率高于觀察組(P<0.05),差異有統計學意義。腫瘤外緣7 mm靶區勾畫患者的中位無進展生存期比病灶邊緣直接勾畫治療的患者稍有提高,說明在腫瘤邊緣7 mm勾畫靶區的治療方案保證了治療的有效率,降低了腫瘤原位復發率達到CR。究其原因可能是不論從肺窗或縱隔窗測量腫瘤,腫瘤真正的局部侵犯范圍并不僅僅是肉眼所見的腫瘤邊界,還包括一些微小的瘤栓,其并不能從CT圖像上肉眼發現。如果以實體瘤的邊界為靶區勾畫邊緣,微小的瘤栓難免會被排除在勾畫的靶區以外,因此以這樣的術前計劃進行放射性粒子植入不能有效地殺死微小的腫瘤病灶,從而導致肺癌原位復發。
近年來,我國學者在腫瘤粒子治療的實踐中做了大量的工作,已成為腫瘤綜合治療的重要手段,并逐漸得到國際同行的認可[16]。粒子植入具有靶區劑量高的優勢,累計劑量是外放療的數倍。其對周圍組織損傷小,植入后多無身體不適,生活質量好,重復性好,應用范圍廣,可以應用于身體較差或無法耐受手術的患者。此外,粒子植入兼容性好,可與化療、靶向、生物及免疫多種治療聯合應用。本研究結合術后相關劑量參數的驗證及1年的臨床隨訪觀察,進一步證實CT引導靶區勾畫的125I粒子植入對于一線治療后復發的NSCLC的療效和安全性,為今后NSCLC粒子治療提供了指導。但放射性粒子治療中仍存在一些問題,如靶區勾畫誤差、處方劑量確定等。同時考慮到本研究納入病例較少,可能導致研究結果出現偏倚,故還需開展更多大樣本臨床研究證實。

