鐮刀菌根腐病拮抗菌的篩選及鑒定
樊炳君 姚麗 段嬌 羅昆艷 楊雪剛 焦鈺 朱國(guó)興 魏薇 曹艷茹
摘要:為了獲得具有抑制鐮刀菌根腐病的生防菌,從研究較少的蘭坪鉛鋅尾礦極端環(huán)境中采集樣品分離菌株,運(yùn)用平板對(duì)峙法從中進(jìn)行4種鐮刀菌根腐病拮抗菌的初篩,共獲得10株有抑制效果的菌株。通過(guò)平板對(duì)峙法和發(fā)酵液涂布法進(jìn)行復(fù)篩,獲得1株抑菌活性較強(qiáng)的拮抗菌株KC 121。根據(jù)生理生化特性和16S rDNA測(cè)序結(jié)果分析,將KC 121菌株鑒定為特基拉芽孢桿菌(Bacillus tequilensis)。抑菌試驗(yàn)結(jié)果顯示,KC 121對(duì)根腐病的4個(gè)病原菌(腐皮鐮刀菌、禾谷鐮刀菌、尖孢鐮刀菌和擬枝孢鐮孢菌)均有不同程度的抑制效果。同發(fā)酵液相比,菌體的抑菌效果較好。KC 121對(duì)擬枝孢鐮孢菌的抑制效果達(dá)82.66%,對(duì)腐皮鐮刀菌的抑菌率達(dá)76.91%。KC 121的發(fā)酵液對(duì)擬枝孢鐮孢菌和腐皮鐮刀菌的抑菌率分別為84.76%和60.85%。本試驗(yàn)結(jié)果可以為根腐病的生物防治提供菌種資源,具有進(jìn)一步的研究和開(kāi)發(fā)價(jià)值。
關(guān)鍵詞:鐮刀菌屬;根腐病;生防菌;鑒定;特基拉芽孢桿菌
中圖分類(lèi)號(hào): S432.4+4? 文獻(xiàn)標(biāo)志碼: A
文章編號(hào):1002-1302(2021)20-0132-06
收稿日期:2021-02-27
基金項(xiàng)目:國(guó)家自然科學(xué)基金(編號(hào):31660002);云南省教育廳科學(xué)研究基金(編號(hào):2020Y0475);云南省地方本科高校(部分)基礎(chǔ)研究聯(lián)合專(zhuān)項(xiàng)資金(編號(hào):2018FH001-003);云南省“萬(wàn)人計(jì)劃”青年拔尖人才資助項(xiàng)目(編號(hào):YNWR-QNBJ-2018-011);省部共建云南生物資源保護(hù)與利用國(guó)家重點(diǎn)實(shí)驗(yàn)室開(kāi)放課題(編號(hào):2019KF005)。
作者簡(jiǎn)介:樊炳君(1996—),女,云南昆明人,碩士研究生,主要從事資源利用與植物保護(hù)研究。E-mail:fanbingjun928@sina.com。
通信作者:曹艷茹,博士,副教授,主要從事微生物多樣性及功能挖掘研究。E-mail:yanrucao3@aliyun.com。
鐮刀菌(Fusarium)隸屬于菌物界真菌門(mén),有性型是子囊菌門(mén)肉座菌的赤霉屬(Gibberella)、叢赤殼屬(Nectria)、麗赤殼屬(Calonectria)和小赤殼屬(Micronectriella),無(wú)性型是半知菌亞門(mén)瘤座孢菌科[1]。由于該屬菌株著生于子座上且具有月牙形或船形的分生孢子,1908年Link首次將其命名為鐮刀菌,并以粉紅鐮刀菌為模式種建立了鐮刀菌屬[2]。隨著科學(xué)技術(shù)的不斷進(jìn)步,鐮刀菌屬的分類(lèi)標(biāo)準(zhǔn)也逐步完善,目前被廣泛接受的種類(lèi)約70余種[1]。作為重要的植物病原菌,鐮刀菌屬的菌株可危害眾多糧食作物、蔬菜、水果、中藥材和花卉等,造成嚴(yán)重的經(jīng)濟(jì)損失[3-6]。鐮刀菌不僅會(huì)使作物萎蔫、腐爛和壞死,產(chǎn)生的毒素被人畜食用后也會(huì)引發(fā)中毒[7]。因此,針對(duì)該屬的防治研究一直受到人們的關(guān)注和重視。
鐮刀菌是一種土壤習(xí)居菌,以菌絲和孢子的方式越冬,常分布在植株的病殘?bào)w、帶病的種子和條件適宜的土壤中,具有寄主種類(lèi)多、致病能力強(qiáng)和危害嚴(yán)重等特點(diǎn)[8]。目前對(duì)于鐮刀菌的防治措施主要是化學(xué)防治,應(yīng)用于實(shí)際生產(chǎn)的生物防治研究還相對(duì)較少。劉利佳等通過(guò)篩選發(fā)現(xiàn),62.5 g/L的精甲·咯菌腈懸浮種衣劑對(duì)尖孢鐮刀菌(Fusarium oxysporium)的抑菌率達(dá)97.27%,是防治煙草鐮刀菌根腐病效果最佳的化學(xué)藥劑[9]。王國(guó)榮等研究發(fā)現(xiàn)甲基硫菌靈和戊唑醇及其復(fù)配制劑對(duì)芹菜莖基腐病病原菌尖孢鐮刀菌的抑制效果最好;在田間藥效試驗(yàn)中發(fā)現(xiàn),75%肟菌·戊唑水分散粒劑(WDG)和70%甲基硫菌靈可濕性粉劑(WP)的田間防效較好[10]。肖榮鳳等通過(guò)篩選發(fā)現(xiàn)2 000倍液的6.6%嘧菌酯·1.1%咯菌腈·3.3%精甲霜靈懸浮種衣劑和25%吡唑醚菌酯乳油對(duì)太子參根腐病病原菌尖孢鐮刀菌的抑菌率均高于75%[11]。許樂(lè)等從丹參植株中分離獲得一株內(nèi)生細(xì)菌多粘類(lèi)芽孢桿菌(Paenibacillus polymyxa)能夠有效抑制丹參根腐病病原菌腐皮鐮刀菌(Fusarium solani)的生長(zhǎng)[12]。牛世全等從鹽堿土壤中分離獲得一株枯草芽孢桿菌(Bacillus subtilis)對(duì)黃芪根腐病病原菌尖孢鐮刀菌的抑制效果較好[13]。
運(yùn)用生態(tài)環(huán)保的生物菌劑防治鐮刀菌屬菌株引起的病害,在綠色可持續(xù)防治病害的同時(shí),還能保護(hù)人畜的健康。本研究從蘭坪鉛鋅尾礦極端環(huán)境中分離原核微生物,從中篩選鐮刀菌根腐病的拮抗菌,為生物菌劑的研發(fā)提供更多菌種資源。
1 材料與方法
1.1 試驗(yàn)材料
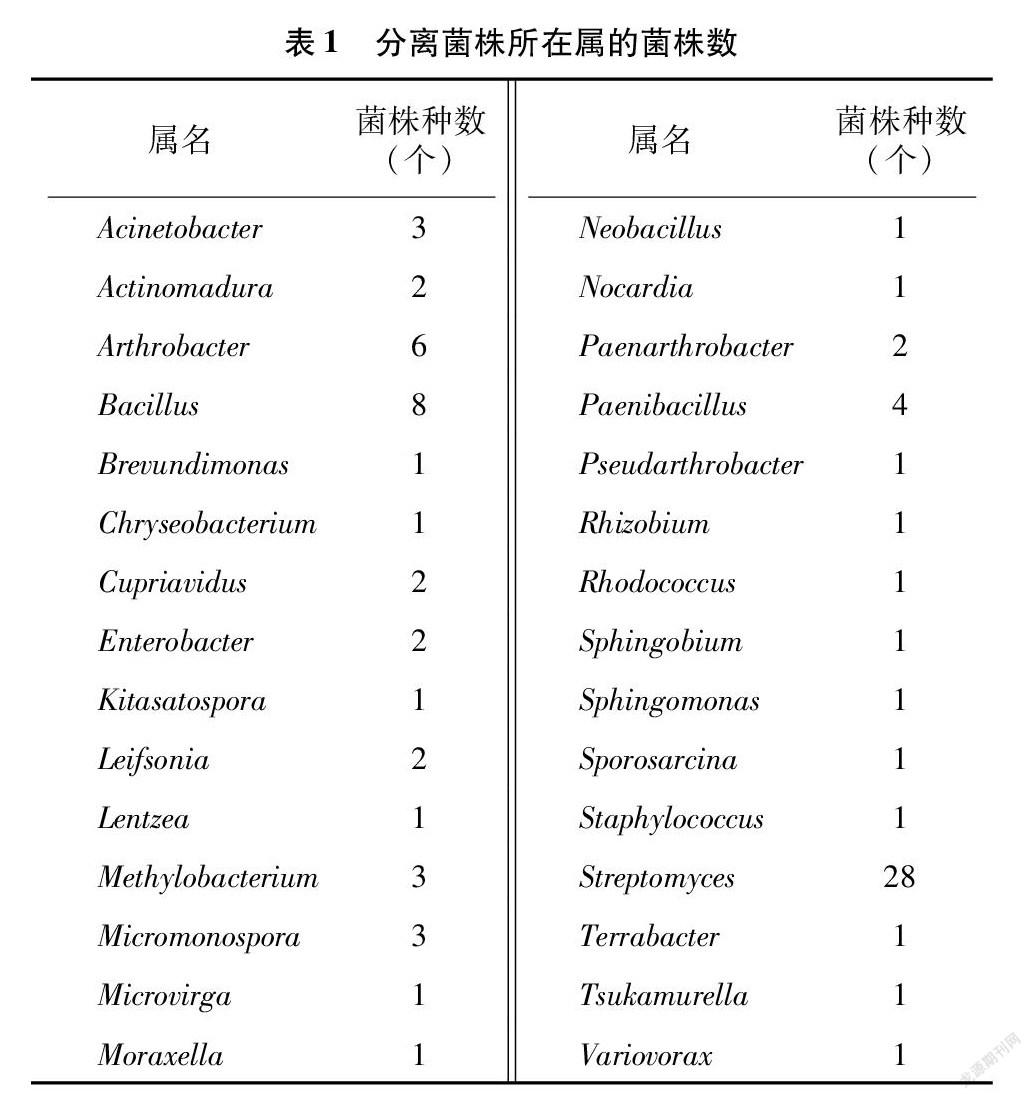
1.1.1 供試菌株 分離自筆者所在課題組于2019年9月采集的蘭坪鉛鋅尾礦樣品,采樣地的海拔范圍在 2 208~2 825 m,經(jīng)緯度范圍為26°22′~26°24′N(xiāo)、99°23′~99°28′E,年平均氣溫為10.4~11.8 ℃,屬溫帶山地主體型季風(fēng)氣候[14]。將重復(fù)菌株去除后,共從24個(gè)樣品中分離得到83個(gè)種的菌株,隸屬于4個(gè)門(mén)6個(gè)綱16個(gè)目22個(gè)科30個(gè)屬,具體信息見(jiàn)表1。
1.1.2 病原菌 腐皮鐮刀菌Fusarium solani(編號(hào)B6)、禾谷鐮刀菌Fusarium graminearum(編號(hào)B7)和尖孢鐮刀菌Fusarium oxysporum(編號(hào)B8)購(gòu)買(mǎi)自中國(guó)農(nóng)業(yè)微生物菌種保藏管理中心;擬枝孢鐮刀菌Fusarium sporotrichioides(編號(hào)B9)購(gòu)買(mǎi)自北京北納創(chuàng)聯(lián)生物技術(shù)研究院。
1.2 菌株培養(yǎng)
1.2.1 供試菌株培養(yǎng) 從保藏試管中挑取供試菌株接種在ISP 2培養(yǎng)基上,置于28 ℃恒溫箱中培養(yǎng) 3~7 d[15]。
1.2.2 病原菌培養(yǎng) 從保藏試管中挑取病原菌接種在馬鈴薯葡萄糖瓊脂(PDA)培養(yǎng)基上,置于 25 ℃ 恒溫箱中培養(yǎng)7 d[16]。
1.3 拮抗菌的初篩
運(yùn)用平板對(duì)峙法[17]將供試菌株接種于ISP 2平板上(10株/皿),于28 ℃恒溫箱中培養(yǎng)5~7 d后,在平板中央接種直徑為8 mm的病原菌菌塊,在 25 ℃ 恒溫箱中培養(yǎng)7 d后觀察抑菌效果,對(duì)有抑菌活性的陽(yáng)性菌株進(jìn)行復(fù)篩。
1.4 拮抗菌的復(fù)篩
1.4.1 供試菌體對(duì)病原菌生長(zhǎng)的影響 運(yùn)用平板對(duì)峙法把篩選出的陽(yáng)性菌株按4點(diǎn)法接種于PDA平板上,方法同“1.3”節(jié),每個(gè)處理重復(fù)3組,以不接供試菌株為空白對(duì)照。
1.4.2 供試菌株發(fā)酵液對(duì)病原菌生長(zhǎng)的影響 把篩選出的陽(yáng)性菌株接種于ISP 2液體培養(yǎng)基,置于200 r/min 28 ℃的搖床培養(yǎng)5 d后,離心收集上清液,得到菌株的發(fā)酵液,再將其用0.22 μm的細(xì)菌過(guò)濾器進(jìn)行過(guò)濾。將200 μL過(guò)濾發(fā)酵液涂布于PDA平板,待培養(yǎng)基表面將液體吸收后將直徑為 8 mm 的病原菌菌塊接種于其上[18],在25 ℃恒溫箱培養(yǎng) 7 d 后觀察抑制效果并計(jì)算抑菌率[19],每個(gè)處理重復(fù)3組,以清水涂板為空白對(duì)照。所獲數(shù)據(jù)通過(guò)SPSS Statistics軟件進(jìn)行差異顯著性分析。
抑菌率=對(duì)照組菌落直徑-處理組菌落直徑對(duì)照組菌落直徑-0.8 cm×100%。
1.5 拮抗菌的鑒定
1.5.1 形態(tài)觀察 在ISP 2培養(yǎng)基上將“1.4”節(jié)中篩選出的陽(yáng)性菌株進(jìn)行劃線培養(yǎng),28 ℃培養(yǎng)3 d后觀察菌落生長(zhǎng)情況及形態(tài)特征。
1.5.2 生理生化特性檢驗(yàn)[20] 測(cè)定菌株產(chǎn)生接觸酶、脲酶和酯酶的能力,檢測(cè)菌株水解淀粉、明膠液化、牛奶胨化、分解纖維素、還原硝酸鹽和產(chǎn)生硫化氫的能力,同時(shí)進(jìn)行甲基紅(MR)試驗(yàn)和V-P試驗(yàn)。
1.5.3 分子鑒定 采用酶法小量DNA提取法提取菌體的基因組DNA[15],運(yùn)用16S rRNA基因的通用引物(PA:5′-CAGAGTTTGATCCTGGCT-3′和PB:5′-AGGAGGTGATCCAGCCGCA-3′)[21]進(jìn)行PCR特異擴(kuò)增,隨后送到生工生物工程(上海)股份有限公司進(jìn)行測(cè)序。將獲得的16S rRNA基因序列提交到EzBioCloud(https://www.ezbiocloud.net/identify)進(jìn)行比對(duì),用MEGA 7軟件采用鄰接法(Neighbor-Joining)構(gòu)建系統(tǒng)發(fā)育樹(shù),確定菌株種屬。
2 結(jié)果與分析
2.1 拮抗菌的初篩
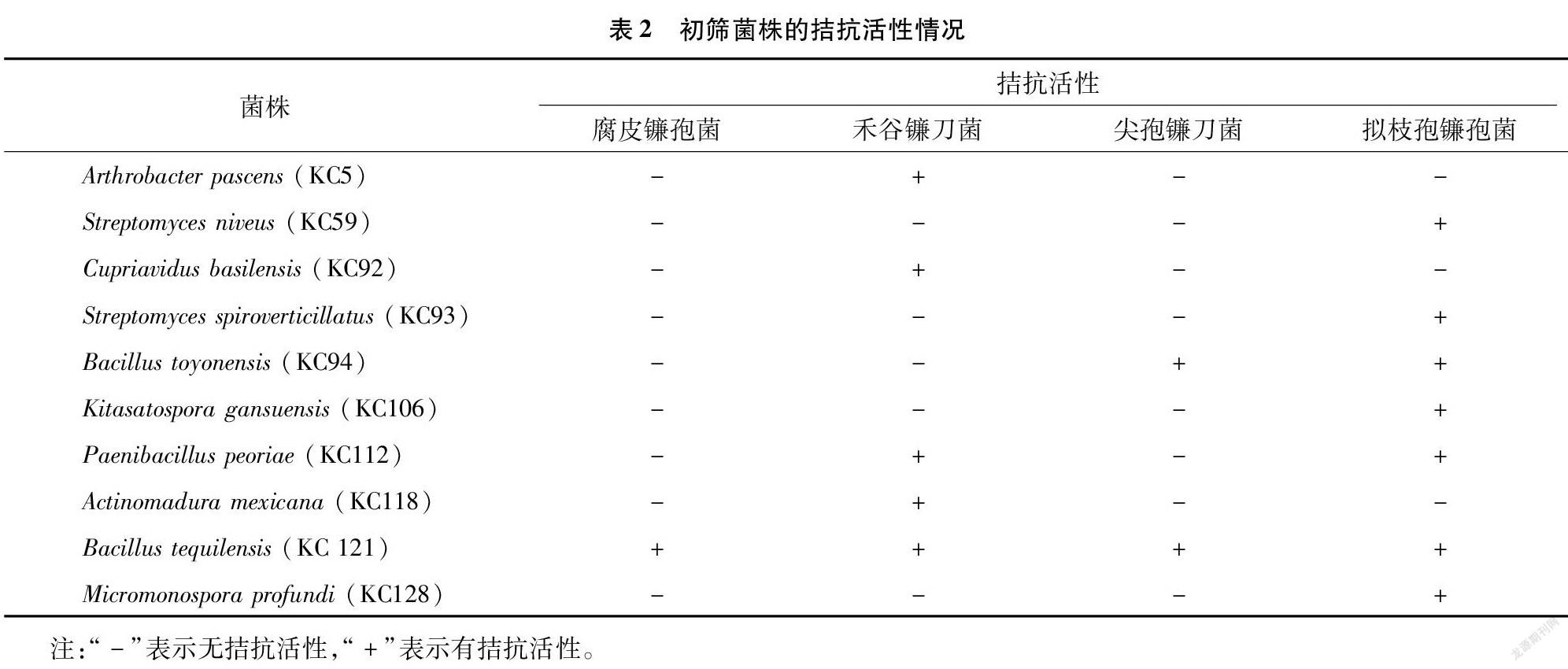
從前期分離獲得的83株菌株中,篩選得到10株具有不同程度抑制根腐病病原菌的菌株(表2)。其中,拮抗腐皮鐮孢菌的生防菌最少,僅有1株;而拮抗擬枝孢鐮孢菌和禾谷鐮刀菌的生防菌相對(duì)較多,分別有7株和5株。KC 94和KC 112對(duì)2種病原菌的生長(zhǎng)有拮抗作用,其余的7株供試菌株僅對(duì)1種病原菌有抑制效果。僅有KC 121對(duì)4種病原菌都具有拮抗活性,因此選擇KC 121進(jìn)行后續(xù)的復(fù)篩工作。
2.2 拮抗菌的復(fù)篩
2.2.1 拮抗菌KC 121對(duì)病原菌生長(zhǎng)的影響
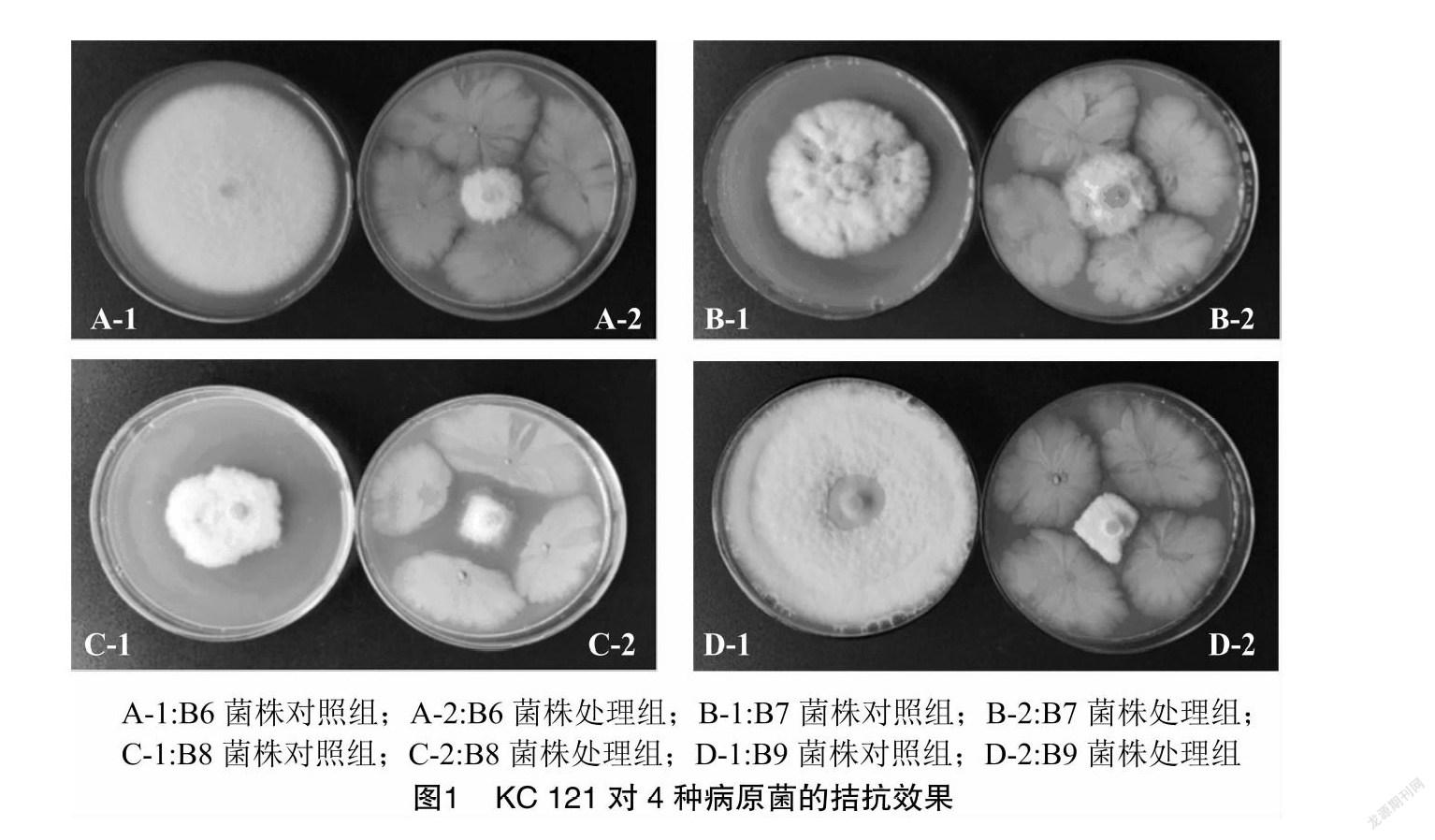
如圖1所示,KC 121對(duì)根腐病的4種病原菌都有不同程度的抑制作用。其中,除對(duì)尖孢鐮刀菌的抑制率較低外,對(duì)腐皮鐮孢菌、禾谷鐮刀菌和擬枝孢鐮孢菌的抑菌率均高于50%,抑制效果最為明顯的是擬枝孢鐮孢菌,高達(dá)82.66%(表3)。
2.2.2 拮抗菌KC 121發(fā)酵液對(duì)病原菌生長(zhǎng)的影響
病原菌在涂有發(fā)酵液的平板上培養(yǎng)7 d后觀察發(fā)現(xiàn)(表4),KC 121發(fā)酵液對(duì)腐皮鐮孢菌和擬枝孢鐮孢菌的抑制作用較好,抑菌率分別為60.85%和8476%;而對(duì)禾谷鐮刀菌和尖孢鐮刀菌的抑制作用則相對(duì)較差,均不到50%,抑菌率最低的為9.20%。
2.3 拮抗菌KC 121的鑒定
2.3.1 形態(tài)特征 KC 121在ISP 2培養(yǎng)基中 28 ℃、培養(yǎng)16 h后觀察發(fā)現(xiàn),菌落呈淺肉色,邊緣不規(guī)則且顏色淺于中央,表面褶皺、干燥(圖2)。
2.3.2 生理生化特性 如表5所示,KC 121是一株具有接觸酶和脲酶活性的菌株,能夠消化的脂肪酸鏈長(zhǎng)度為60,具有液化明膠、胨化牛奶、水解淀粉和還原硝酸鹽的功能,不具備分解纖維素和產(chǎn)生硫化氫的能力。
2.3.3 分子生物學(xué)鑒定 菌株KC 121經(jīng)16S rRNA基因測(cè)序后得到大小為1371bp的序列片段,將其提交到GenBank獲得16S rDNA序列登錄號(hào)為MW652665,同時(shí)在EzBioCloud (https://www.ezbiocloud.net/identify)進(jìn)行比對(duì), 用 MEGA 7軟件采用鄰接法(Neighbor-Joining)構(gòu)建系統(tǒng)發(fā)育樹(shù)[22]。KC 121的16S rRNA基因序列與Bacillus tequilensis(KF036187和MG004174)在系統(tǒng)發(fā)育樹(shù)上同屬一個(gè)分支,證明KC 121與特基拉芽孢桿菌(Bacillus tequilensis)的親緣關(guān)系最近(圖3)。
3 結(jié)論與討論
利用筆者所在課題組前期從蘭坪鉛鋅尾礦樣品中分離得到的83株菌進(jìn)行根腐病病原菌的生防菌篩選研究,初篩獲得10株對(duì)不同病原菌具有不同抑制效果的生防菌,從中選擇了1株能同時(shí)抑制腐皮鐮刀菌、禾谷鐮刀菌、尖孢鐮刀菌和擬枝孢鐮刀菌4種病原菌的菌株KC 121進(jìn)行后續(xù)的復(fù)篩試驗(yàn)。本試驗(yàn)借鑒醫(yī)學(xué)和藥理學(xué)等研究中的平板涂布法[18,23],首次將菌株的發(fā)酵液涂布于平板上進(jìn)行農(nóng)業(yè)病害拮抗菌的篩選。通過(guò)平板對(duì)峙法和發(fā)酵液涂布法2種方法進(jìn)行復(fù)篩,發(fā)現(xiàn)KC 121和其發(fā)酵液對(duì)擬枝孢鐮孢菌的抑制效果均較好,抑菌率均達(dá)80%以上;但對(duì)尖孢鐮刀菌的抑制效果相對(duì)較差,抑菌率均低于50%。在針對(duì)禾谷鐮刀菌時(shí),KC 121的菌體本身對(duì)病原菌菌絲生長(zhǎng)的抑菌率為65.31%,但發(fā)酵液對(duì)其的抑菌率僅有9.20%,出現(xiàn)該情況的原因可能是由于抑菌物質(zhì)為胞內(nèi)產(chǎn)物,或是發(fā)酵條件(溫度、培養(yǎng)基、時(shí)間和pH值等)不適宜所導(dǎo)致的。
結(jié)合形態(tài)學(xué)、生理生化試驗(yàn)檢測(cè)及分子生物學(xué)測(cè)定,鑒定KC 121菌株為特基拉芽孢桿菌。多項(xiàng)研究報(bào)道表明,特基拉芽孢桿菌在諸多方面都有十分重要的作用與應(yīng)用價(jià)值。在農(nóng)業(yè)上,Cuellar等發(fā)現(xiàn)特基拉芽孢桿菌產(chǎn)生的脂肽能夠顯著降低香蕉葉斑病發(fā)生的嚴(yán)重性[24];周瑚等研究發(fā)現(xiàn)特基拉芽孢桿菌對(duì)多種植物病原菌有抑制作用,例如稻瘟病菌、辣椒膠孢炭疽菌、煙草赤星病菌、黃瓜疫病菌和卵菌具有一定的抑制作用[22]。在工業(yè)上,Angural等將特基拉芽孢桿菌應(yīng)用在紙漿漂白中[25];Singh等研究發(fā)現(xiàn)特基拉芽孢桿菌能夠產(chǎn)生生物表面活性劑,該活性劑可作為一種消毒劑或類(lèi)似消毒劑的成分,對(duì)浮游細(xì)菌和生物膜中滯留的細(xì)菌均有殺菌作用[26]。在食品加工過(guò)程中,具有果膠酶活性的特基拉芽孢桿菌具備去除咖啡種子漿層的能力,部分純化的果膠酶具有澄清果汁的作用[27]。而本研究首次發(fā)現(xiàn)了特基拉芽孢桿菌能夠同時(shí)對(duì)鐮刀菌屬的腐皮鐮刀菌、禾谷鐮刀菌、尖孢鐮刀菌和擬枝孢鐮刀菌4種病原菌生長(zhǎng)起拮抗作用,其中對(duì)擬枝孢鐮孢菌的抑制效果最好,抑菌率達(dá)80%以上,為后期運(yùn)用生物手段防治該病害提供了菌種資源。
菌株KC 121來(lái)源于重金屬含量較高的尾礦極端環(huán)境。目前已有大量研究證明極端環(huán)境中存在豐富的防治農(nóng)業(yè)病蟲(chóng)害的微生物資源。王彥等在河西走廊敦煌地區(qū)的鹽堿土壤中分離篩選出1株鏈霉菌屬菌株對(duì)黃瓜枯萎病病菌有良好的拮抗效果[28];閆建芳等在連黃海海域海底沉積物樣品中獲得1株密旋鏈霉菌(Streptomyces pactum)對(duì)番茄潰瘍病菌(Clavibacter michiganensis)有較好的抑制作用[29];鄭梅霞等從高海拔的可可西里和西藏樣品中篩選得到2株能抑制番茄根腐病病原菌的枯草芽孢桿菌[30];羅曼等在南極沉積物樣品中獲得1株具有廣譜抑菌作用的枯草芽孢桿菌斯氏亞種(Bacillus subtilis subsp. spizizenii),對(duì)絲瓜和辣椒的枯萎病病菌均有較強(qiáng)的抑制效果,對(duì)長(zhǎng)豆褐腐病也有較明顯的拮抗作用[31]。針對(duì)尾礦地區(qū)微生物的研究主要集中在多樣性分析及重金屬的污染生態(tài)修復(fù)等方面[32-36],尚未發(fā)現(xiàn)農(nóng)業(yè)生防菌的相關(guān)研究和報(bào)道。本研究首次從含有大量重金屬的蘭坪鉛鋅尾礦極端環(huán)境中篩選生防菌,獲得了活性較好的菌株,但抑菌物質(zhì)、抑菌機(jī)理等方面還尚未明確,后續(xù)還需要進(jìn)行更為深入的試驗(yàn)及研究。
參考文獻(xiàn):
[1]賀運(yùn)春. 真菌學(xué)[M]. 北京:中國(guó)林業(yè)出版社,2008.
[2]張素軒. 鐮刀菌屬分類(lèi)進(jìn)展[J]. 真菌學(xué)報(bào),1991,10(2):85-94.
[3]周 默,白慶榮. 內(nèi)蒙古莫旗黃芪根腐病病原的分離與鑒定[J]. 東北農(nóng)業(yè)科學(xué),2021,46(2):52-55,61.
[4]張俊慶,鄭安科,高立紅,等. 辣椒枯萎病主要致病菌的分離鑒定及農(nóng)用拮抗菌篩選[J]. 安徽農(nóng)業(yè)科學(xué),2021,49(8):134-137.
[5]趙東曉,陳 悅,夏 博,等. 沙棘枝干枯萎病癥狀觀測(cè)與病原菌室內(nèi)化學(xué)藥劑篩選[J]. 中國(guó)水土保持,2021(4):50-53.
[6]王彤彤,鄔昊月,趙尊練,等. 陜西省大蔥葉部鐮刀菌枯萎病病原菌的鑒定[J/OL]. 植物病理學(xué)報(bào)(2021-04-01)[2021-04-20].https://doi.org/10.13926/j.cnki.oppd.000568.
[7]De Oliveira R L,Reis G M,Da Silva V N,et al. Molecular characterization and fumonisin production by Fusarium verticillioides isolated from corn grains of different geographic origins in Brazil[J]. International Journal of Food Microbiology,2011,145(1):9-21.
[8]林鎮(zhèn)躍,闕友雄,劉平武,等. 植物致病鐮刀菌的研究進(jìn)展[J]. 中國(guó)糖料,2014(1):58-64,78.
[9]劉利佳,李芳芳,何 雷,等. 煙草鐮刀菌根腐病病原菌的鑒定及其對(duì)5種殺菌劑的敏感性分析[J]. 河南農(nóng)業(yè)科學(xué),2021,50(7):101-109.
[10]王國(guó)榮,馮曉曉,吳慧明,等. 芹菜莖基腐病病原菌鑒定、消長(zhǎng)動(dòng)態(tài)調(diào)查與防治藥劑篩選[J]. 浙江農(nóng)業(yè)學(xué)報(bào),2021,33(4):661-669.
[11]肖榮鳳,陳燕萍,陳梅春,等. 太子參根腐病病原菌的鑒定及防治藥劑篩選[J]. 植物保護(hù)學(xué)報(bào),2020,47(6):1333-1342.
[12]許 樂(lè),王子強(qiáng),張 爽,等. 丹參根腐病拮抗細(xì)菌篩選、鑒定及生防機(jī)理研究[J]. 中國(guó)生物防治學(xué)報(bào),2021,37(4):846-854.
[13]牛世全,李 靜,張雪瑩,等. 一株抗黃芪根腐病芽孢桿菌的篩選、鑒定及抑菌物質(zhì)的初步研究[J]. 西北師范大學(xué)學(xué)報(bào)(自然科學(xué)版),2021,57(2):79-86.
[14]程先鋒,宋婷婷,陳 玉,等. 滇西蘭坪鉛鋅礦區(qū)土壤重金屬含量的高光譜反演分析[J]. 巖石礦物學(xué)雜志,2017,36(1):60-69.
[15]樊炳君,曹艷茹,紀(jì)開(kāi)娟,等. 桉樹(shù)根際放線菌的分離、初步鑒定及酶活篩選[J]. 昆明學(xué)院學(xué)報(bào),2020,42(3):64-70.
[16]樊炳君,趙玉美,陳俊珠,等. 云南核桃葉枯病病原鑒定及其生物學(xué)特性[J]. 植物保護(hù),2020,46(3):123-130.
[17]馬 騰,張知曉,戶(hù)連榮,等. 一株核桃真菌病害生防菌的鑒定及抑菌特性研究[J]. 中國(guó)森林病蟲(chóng),2020,39(6):10-15.
[18]宋劍武,王鵬霞,吳永繼,等. 迷迭香酸與抗菌藥聯(lián)合對(duì)含fosA3基因細(xì)菌抑菌效果的研究[J]. 中國(guó)畜牧獸醫(yī),2015,42(7):1851-1858.
[19]許麗婷,陳佳欣,李歡歡,等. 生防菌XC-1的篩選、鑒定及其對(duì)馬鈴薯黑痣病的防效研究[J]. 植物病理學(xué)報(bào),2021,51(3):413-422.
[20]東秀珠,蔡妙英. 常見(jiàn)細(xì)菌系統(tǒng)鑒定手冊(cè)[M]. 北京:科學(xué)出版社,2001:353-398.
[21]Marchesi J R,Sato T,Weightman A J,et al. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA[J]. Applied and Environmental Microbiology,1998,64(2):795-799.
[22]周 瑚,鄒秋霞,胡 玲,等. 特基拉芽孢桿菌JN-369的分離鑒定及其抑菌物質(zhì)分析[J]. 農(nóng)藥學(xué)學(xué)報(bào),2019,21(1):52-58.
[23]劉 波,李雪駝,徐和利,等. 5種中藥制劑殺滅幽門(mén)螺桿菌的實(shí)驗(yàn)研究[J]. 中國(guó)新藥雜志,2002,11(6):457-459.
[24]Cuellar G T Z,González J L M,Villegas E V. Role of Bacillus tequilensis EA-CB0015 cells and lipopeptides in the biological control of black Sigatoka disease[J]. Biological Control,2021,155(4):104523.
[25]Angural S,Kumar A,Kumar D,et al. Lignolytic and hemicellulolytic enzyme cocktail production from Bacillus tequilensis LXM 55 and its application in pulp biobleaching[J]. Bioprocess and Biosystems Engineering,2020,43(12):2219-2229.
[26]Singh A K,Sharma P. Disinfectant-like activity of lipopeptide biosurfactant produced by Bacillus tequilensis strain SDS21[J]. Colloids and Surfaces B-Biointerfaces,2020,185:110514.
[27]Koshy M,De S. Effect of Bacillus tequilensis SALBT crude extract with pectinase activity on demucilation of coffee beans and juice clarification[J]. Journal of Basic Microbiology,2019,59(12):1185-1194.
[28]王 彥,牛世全,鄭豆豆,等. 黃瓜枯萎病拮抗放線菌的篩選、鑒定及發(fā)酵條件優(yōu)化[J]. 微生物學(xué)通報(bào),2019,46(5):1062-1073.
[29]閆建芳,劉 秋,趙柏霞,等. 番茄潰瘍病生防菌YH23的發(fā)酵條件優(yōu)化及菌種鑒定[J]. 沈陽(yáng)農(nóng)業(yè)大學(xué)學(xué)報(bào),2019,50(5):608-613.
[30]鄭梅霞,朱育菁,劉 波,等. 高海拔來(lái)源芽胞桿菌根腐生防菌的篩選與鑒定[J]. 福建農(nóng)業(yè)學(xué)報(bào),2017,32(9):996-1000.
[31]羅 曼,萬(wàn)婧倞,黃仕新,等. 南極沉積物來(lái)源抗菌細(xì)菌的篩選及抑菌物質(zhì)的鑒定[J]. 微生物學(xué)通報(bào),2020,47(6):1787-1794.
[32]Njoku K L,Akinyede O R,Obidi O F. Microbial remediation of heavy metals contaminated media by Bacillus megaterium and Rhizopus stolonifer[J]. Scientific African,2020,10:1-17.
[33]楊雍康,藥 棟,李 博,等. 微生物群落在修復(fù)重金屬污染土壤過(guò)程中的作用[J]. 江蘇農(nóng)業(yè)學(xué)報(bào),2020,36(5):1322-1331.
[34]彭玙萍,曾偉民. 紫金山銅礦酸性礦山廢水微生物群落多樣性[J]. 微生物學(xué)通報(bào),2020,47(9):2887-2896.
[35]李司宇,劉 雪,王文婧,等. 微生物在重金屬離子污染修復(fù)及治理中的應(yīng)用研究[J]. 環(huán)境與可持續(xù)發(fā)展,2020,45(2):158-160.
[36]房保柱,王怡歡,張 堃,等. 凡口鉛鋅礦酸性底泥可培養(yǎng)微生物資源的探索分離[J]. 微生物學(xué)雜志,2020,40(2):10-21.

