蛋白二、三級結構對魚糜凝膠質構和持水力的影響及其測定方法研究進展
梁惲紅,盧 涵,張香美
(河北經貿大學生物科學與工程學院,石家莊 050061)
魚體經去頭、去內臟、采肉、漂洗、脫水、斬拌等工藝可制成魚糜(Surimi),斬拌后魚糜加入食鹽等調味料擂潰成黏稠魚肉糊后再加熱,成為彈性凝膠體,即魚糜凝膠。魚糜凝膠中最主要的蛋白質是肌原纖維蛋白(Myofibrillar protein,MP),對凝膠形成貢獻最大,因此肌原纖維蛋白結構對魚糜凝膠形成和品質具有重要影響[1]。
肌原纖維蛋白是一種鹽溶性蛋白,需在離子強度>0.5的中性鹽溶液中溶解,主要由肌球蛋白(Myosin)、肌動蛋白(Actin)、原肌球蛋白(Tropomyosin)及肌鈣蛋白(Troponin)構成,肌原纖維蛋白結構是維持魚肉肌肉及相關制品質構及持水力重要原因[2]。肌原纖維蛋白二級結構是指多肽主鏈骨架原子空間相對盤繞、折疊,主要形式包括α-螺旋、β-折疊、β-轉角及無規則卷曲,氫鍵是維持蛋白二級結構主要作用力;肌原纖維蛋白三級結構是二級結構通過側鏈基團借助次級鍵維系進一步卷曲、折疊所形成的特定空間構象,主要是疏水相互作用、氫鍵、離子鍵、二硫鍵共同作用[3],如圖1所示。魚糜凝膠形成與α-螺旋和β-折疊結構含量、蛋白質三級結構展開和聚集密切相關,因魚糜凝膠是肌原纖維蛋白在氫鍵、疏水相互作用、離子鍵、二硫鍵共同作用下相互交聯聚集形成的凝膠網狀結構,作用力變化影響魚糜凝膠質構和持水力。
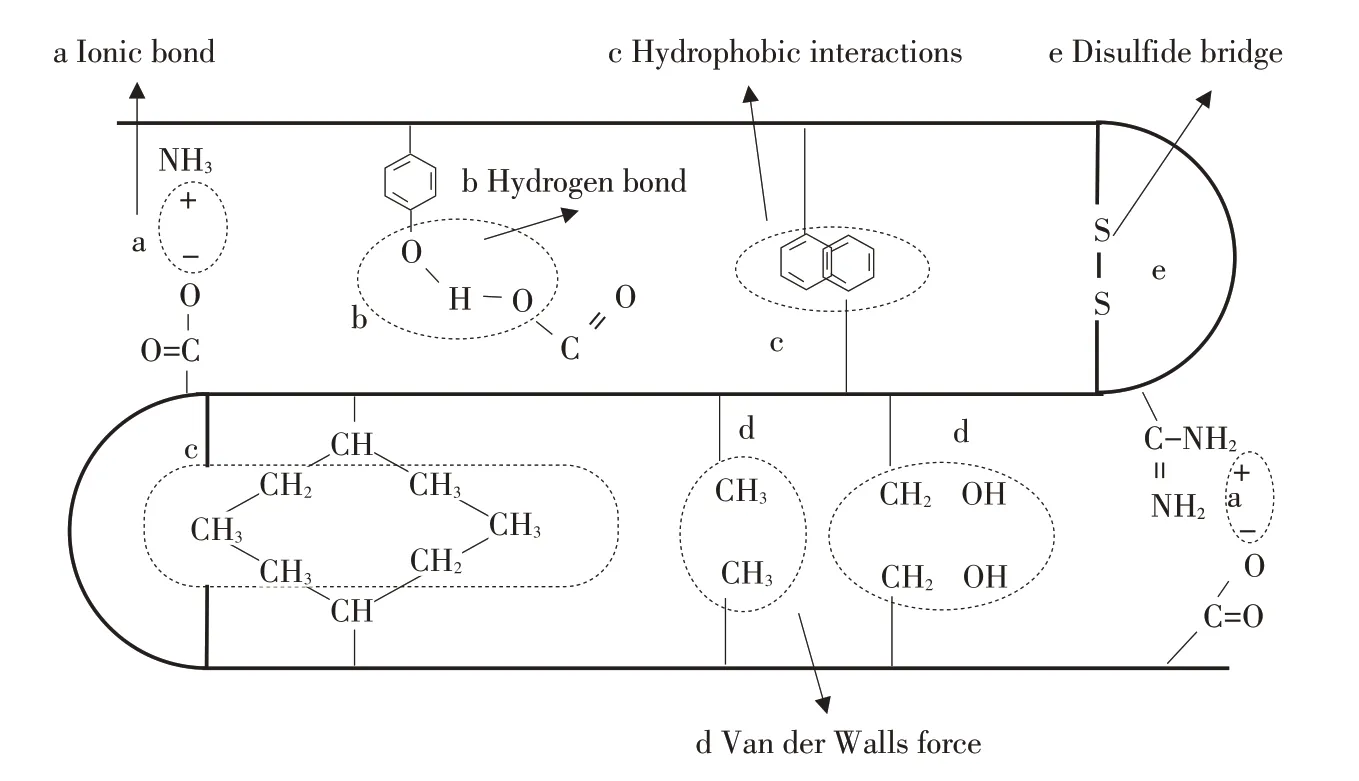
圖1 蛋白質分子間作用力[3]Fig.1 Intermolecular forces of proteins
在魚糜加工制作及運輸貯藏過程中,除去魚肉自身酶作用[4],肌原纖維蛋白不可避免受外部環境(如溫度、壓力、pH、環境中氧氣、斬拌速度等)影響而發生結構和構象變化,而肌原纖維蛋白結構變化在很大程度上影響魚糜凝膠品質。質構和持水力是評定魚糜凝膠品質兩個重要指標。質構特性體現魚糜制品新鮮度和魚糜凝膠內部特性細微變化,表現為硬度、內聚性、彈性、咀嚼性、回彈性和黏附性等參數;持水力指蛋白質凝膠保持水分能力,受凝膠微觀結構、蛋白質和水之間相互作用等因素影響[5]。另外,根據凝膠強度與硬度相似性,凝膠強度也可用于反映魚糜凝膠品質[6]。Andersen等報道,當肌原纖維結構被破壞,造成肌原纖維蛋白無序聚集,使形成的凝膠網絡孔隙不均、大小不一,破壞魚糜凝膠質構與持水力[7]。儀淑敏等試驗結果表明,高壓破壞蛋白質空間結構,重新締結成具有均勻網絡結構的蛋白凝膠體,同時更多自由水與蛋白質形成結合水,增強凝膠強度和持水性能[8]。但肌原纖維蛋白結構對凝膠質構及持水力的影響機制尚不清楚。
本文從蛋白分子間作用力角度出發,從氫鍵、疏水相互作用、離子鍵及二硫鍵等方面闡述肌原纖維蛋白結構變化對魚糜凝膠質構及持水力影響,并簡要介紹比較魚糜凝膠蛋白二、三級結構測定方法,如圖2所示,揭示肌原纖維蛋白結構變化對魚糜凝膠質構及持水力影響機制,為改進魚糜及魚糜制品品質,選擇更適合的結構測定方法提供理論參考。
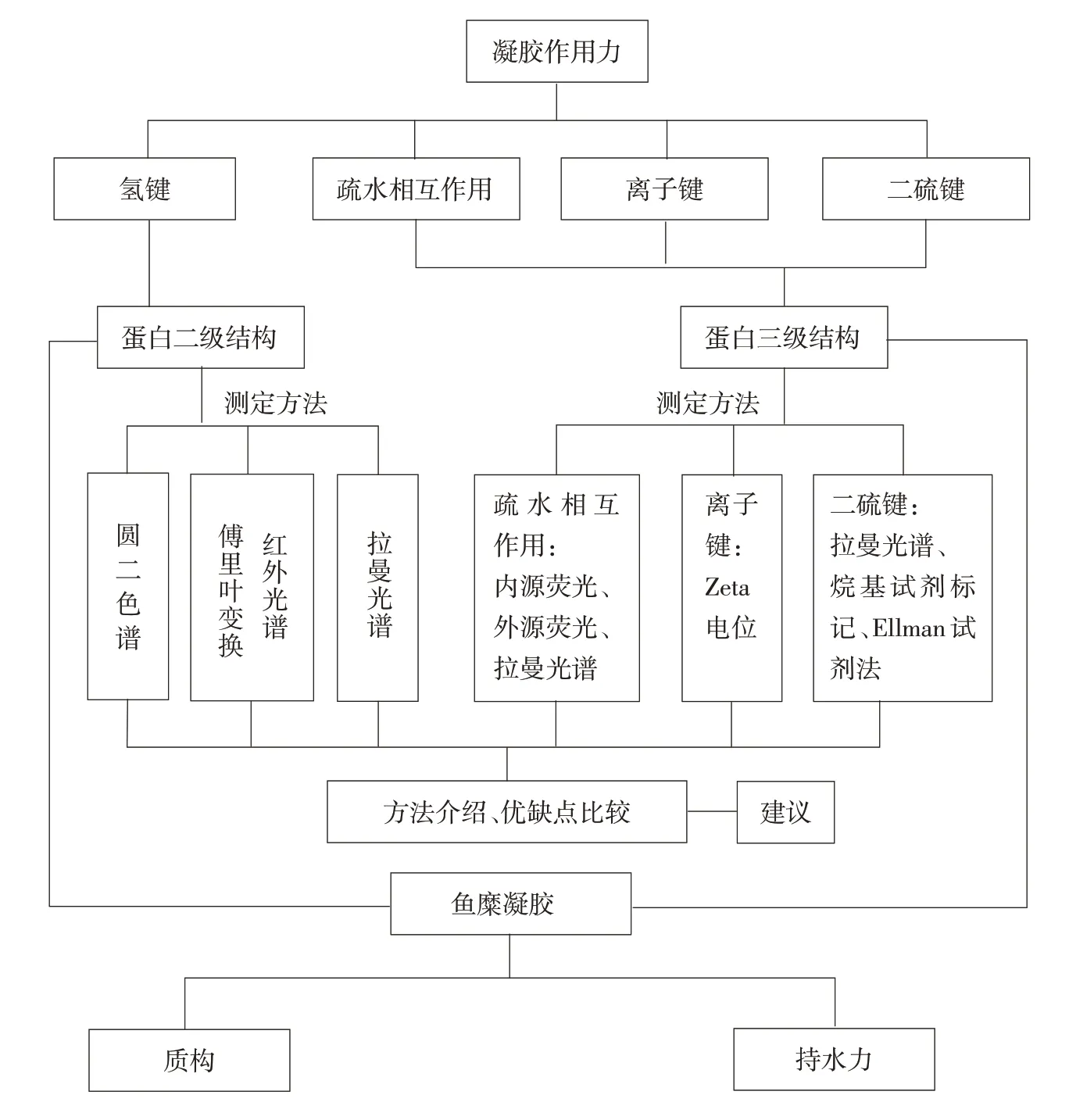
圖2 文章結構內容示意Fig.2 Structure and content of paper
1 氫鍵對魚糜凝膠質構和持水力的影響
1.1 氫鍵與魚糜凝膠質構和持水力關系
氫鍵是維持蛋白質二級結構主要作用力,也是魚糜凝膠有較好硬度和持水力原因之一。劉芳芳等認為,氫鍵在蛋白質受熱變性時發生斷裂,魚糜凝膠冷卻后重新形成,起穩定結合水、提高凝膠硬度的作用[9]。Wang等發現氫鍵含量顯著升高時,凝膠保水性也顯著增加[10]。張小燕等研究顯示,氫鍵含量增加時凝膠強度也增加,對維持凝膠網絡結構有積極作用[11]。因此,蛋白中氫鍵含量越高,對維持魚糜凝膠質構、持水力越有利。
1.2 二級結構與魚糜凝膠質構和持水力的關系
蛋白質二級結構主要有α-螺旋、β-折疊、β-轉角及無規則卷曲4種形式,不同形式間可互相轉化,其作用力主要由氫鍵維持。不同形式二級結構對魚糜凝膠質構和持水力影響有所不同。α-螺旋結構主要通過氨基酸C=O和N-H形成分子內氫鍵維持,如圖3a所示。研究表明,α-螺旋是天然蛋白質中二級結構主要構象,在魚糜加工制成魚糜凝膠時,α-螺旋結構部分解螺旋轉化成β-折疊、β-轉角或無規則卷曲[12]。β-折疊是有序平面結構,分為平行式和反平行式兩種,主要通過氨基酸分子之間形成的氫鍵維持,如圖3b所示。β-轉角表現為回轉結構,無規則卷曲是指無一定規律的松散肽鏈結構,通過氫鍵維持其構象[3]。β-轉角和無規則卷曲相較于α-螺旋和β-折疊結構更無序[13],α-螺旋向有序的β-折疊結構轉化更有利于形成規則的凝膠網絡,使魚糜凝膠質構和持水力較好,而α-螺旋向β-轉角和無規則卷曲轉化,導致魚糜凝膠質構和持水力較差[14]。Wang等研究顯示,β-折疊含量最高時,凝膠具有更均勻的微觀結構,凝膠強度與持水力也更大[10]。Zhang等提出高溫下形成的魚糜凝膠無規則卷曲含量最高,肌原纖維蛋白分子無序聚集,降低蛋白質間交聯程度,從而凝膠網狀結構不均勻、粗糙、孔大,降低魚糜產品凝膠強度[15]。因此,肌原纖維蛋白分子中氫鍵更多表現為α-螺旋或β-折疊時,對維持魚糜或魚糜凝膠結構、增強魚糜凝膠質構和持水力有利。
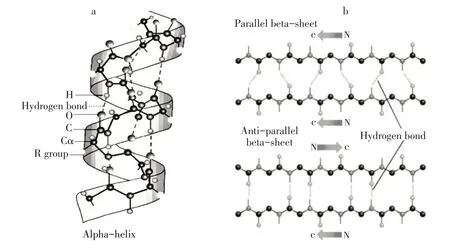
圖3 α-螺旋、β-折疊結構[3]Fig.3α-helix andβ-sheet structure
1.3 氫鍵及蛋白二級結構測定
1.3.1 氫鍵測定
拉曼光譜在830 cm-1和850 cm-1處峰值變化比值(I850/I830)可用于判斷酪氨酸殘基包埋程度及體系氫鍵含量,I850/I830值為0.9~1.45表示酪氨酸酚羥基基團與水分子形成氫鍵,比值為0.7~1.0表示與蛋白質中其他基團形成氫鍵[16]。Zhang等測得當壓力為0.1~200 MPa時,比值為0.965~1.029,表明酪氨酸殘基暴露,并與水分子形成氫鍵,此時凝膠持水力較高;當壓力大于300 MPa時,比值下降到0.705,表明酪氨酸中酚羥基與蛋白質分子產生氫鍵,有助于凝膠結構形成及凝膠強度增加[17]。
1.3.2 蛋白二級結構測定
蛋白質二級結構主要包括α-螺旋、β-折疊、β-轉角及無規則卷曲4種形式,其中α-螺旋和β-折疊結構對魚糜凝膠形成貢獻最高。目前,科研人員普遍采用圓二色譜、拉曼光譜以及傅里葉變換紅外光譜技術測定蛋白質二級結構,表1概括介紹3種方法。圓二色譜與波長有關,α-螺旋圓二色譜峰處于208~222 nm,β-折疊、無規則卷曲色譜峰為190~206 nm[18]。Cao和Xiong采用圓二色譜法檢測到氧化后肌原纖維蛋白在220 nm處螺旋發生顯著衰減,表明肌原纖維蛋白α-螺旋結構朝無規則卷曲結構轉化,使肌原纖維蛋白無規則聚集,對凝膠形成不利[19]。

表1 氫鍵蛋白二級結構測定方法總結Table 1 Summary of hydrogen bond and protein secondary structure determination methods
拉曼光譜通常用于表征二級結構的是酰胺Ⅰ區,區域范圍1 600~1 700 cm-1,具體各表征不同二級結構區域隨選用測定儀器不同有細微差別[20]。Jia等采用拉曼光譜測定肌原纖維蛋白二級結構對凝膠特性的影響,結果顯示,α-螺旋結構減少,β-折疊結構增加,表示α-螺旋向β-折疊轉化,凝膠強度較高[21]。
在傅里葉變換紅外光譜(FT-IR)中,大多通過酰胺I區(1 600~1 700 cm-1)光譜變化分析二級結構及其內部氫鍵結合情況[22]。趙冰等利用FT-IR法測定氧化對肌原纖維蛋白二級結構與凝膠關系,發現當α-螺旋和β-折疊部分遭到破壞,轉化成不規則β-轉角和無規卷曲結構時,蛋白質結構由穩定向不穩定轉變,進而造成凝膠結構松散,無法形成致密穩定的網狀結構,降低蛋白質凝膠強度和持水力[23]。
1.4 蛋白二級結構測定方法比較
圓二色譜、拉曼光譜與傅里葉變換紅外光譜對肌原纖維蛋白二級結構測定結果一致,即α-螺旋大部分轉化成β-折疊,形成的凝膠具有較好硬度與持水力,當α-螺旋和β-折疊氫鍵斷裂,形成較多β-轉角和無規卷曲時,凝膠硬度和持水力較差。但需注意的是,這3種方法各有利弊,詳見表2。

表2 蛋白二級結構測定方法比較Table 2 Comparison of protein secondary structure determination methods
2 疏水相互作用對凝膠質構和持水力的影響
2.1 疏水相互作用與凝膠質構和持水力的關系
疏水相互作用作為維持凝膠結構另一主要非共價作用力,由肌原纖維蛋白側鏈基團上某些特定疏水氨基酸殘基暴露于極性環境形成[24]。Du等研究發現,肌原纖維蛋白中部分掩蓋疏水氨基酸殘基隨三級結構展開而暴露,隨后由于蛋白質重新聚合,暴露的疏水氨基酸殘基又重新進入肌原纖維蛋白內部,疏水相互作用呈先增后降趨勢[25]。
適當的疏水基團暴露在極性環境中有利于蛋白質重新聚集,蛋白質重排形成孔隙均勻的網狀結構,凝膠具有較好質構和持水力[26],如圖4a~b所示,適當增加微波加熱頻率(300~500 W)使蛋白質結構展開,更多疏水基團暴露,增強蛋白質間相互作用,使其重新聚集形成更均勻凝膠網絡[27]。Yu等研究不同鍵斷裂劑對魚糜凝膠特性和蛋白構象的影響,結果顯示,在鍵斷裂劑SDS濃度較低時,蛋白質三級結構部分展開,疏水側鏈暴露,疏水相互作用增強,凝膠硬度和凝膠彈性增加[28]。Li等研究結果表明,疏水相互作用形成和二硫鍵增強凝膠網狀結構,因此更多的水分子可固定于凝膠結構,凝膠持水力增強[29]。而過度疏水基團暴露在極性環境中預示蛋白質結構過度展開,使形成凝膠所必需的交聯被破壞,也不利于水分子保留于凝膠,導致凝膠的質構和持水力較差,如圖4c所示,當微波加熱頻率從500 W升至800 W時,蛋白質結構被破壞,無法有序重新聚集,導致凝膠網絡結構不均勻,孔隙粗大且無序[27]。Chen等通過向肌原纖維蛋白中添加疏水基團,證實引入過多疏水基團時,蛋白質分子間形成凝膠所必需的交聯可能被破壞,導致凝膠網絡劣化,凝膠硬度和彈性均降低[30]。薛思雯等研究報道,過多暴露包埋的疏水基團可能對凝膠持水力起反作用,可能是因為肌原纖維蛋白分子過度展開而難以再形成致密凝膠網絡,不利于水分子包埋于凝膠網絡,導致凝膠持水力下降[31]。

圖4 不同微波加熱頻率下肌原纖維蛋白凝膠微觀結構[27]Fig.4 Microstructure of myofibrillar protein gel under different microwave heating power(SEM)
2.2 疏水相互作用測定
通常采用熒光光譜法和拉曼光譜法檢測魚糜凝膠中疏水相互作用的變化。其中內源熒光光譜法是通過檢測色氨酸熒光強度變化,表征蛋白質內部極性環境變化[32]。Wei等研究發現,適當暴露色氨酸殘基,使疏水相互作用增加,內源熒光強度降低,肌原纖維蛋白凝膠形成均勻致密的網絡結構,這預示肌原纖維蛋白疏水相互作用增強蛋白質間的相互作用,凝膠微觀網狀結構較好,具有良好彈性和持水力[27]。
另外,疏水殘基可與熒光探針結合,產生熒光效應。根據這一原理,可采用外源熒光光譜法加入熒光探針檢測肌原纖維蛋白中疏水性殘基。用于作為熒光探針的有8-苯胺基-1-萘磺酸(ANS)、溴酚藍[19]等。Xiao等采用ANS作為熒光探針檢測不同位置鱷魚肉中肌原纖維蛋白表面疏水性,結果顯示,尾部較肢體和腿部肌原纖維蛋白暴露的疏水基團更多,表面疏水性更強,因此尾部肌原纖維蛋白更易聚集,網狀結構更均勻致密,形成的凝膠強度及持水力顯著高于其他部位[33]。
芳香族氨基酸側鏈如色氨酸具有拉曼光譜特征吸收峰,可采用拉曼光譜法表征疏水基團變化情況。760 cm-1處特征峰歸因于色氨酸殘基環振動,當疏水微環境中掩埋的色氨酸殘基暴露于極性環境時,760 cm-1附近峰強度可能減少[34]。Wang等采用拉曼光譜測得肌原纖維蛋白凝膠中疏水相互作用變化,并表示色氨酸嵌入疏水環境中可能形成有序的凝膠網絡,有利于保持持水力[16]。這也表示過多疏水基團暴露可能不利于凝膠網絡和凝膠形成較好持水力。
2.3 疏水相互作用測定方法比較
將內源熒光光譜、外源熒光光譜、拉曼光譜3種方法作比較,具體如表3所示。

表3 疏水相互作用測定方法比較Table 3 Comparison of hydrophobic interaction determination methods
3 離子鍵對凝膠質構和持水力的影響
3.1 離子鍵與凝膠質構和持水力關系
在魚糜正常pH下,肽鏈上谷氨酸和天冬氨酸羧基基團帶負電,而賴氨酸和精氨酸氨基基團帶正電,這些基團間形成離子鍵,又稱為鹽橋。離子鍵有助于維持蛋白質三級結構,其形成加強蛋白質間交聯,通常在維持凝膠質構和持水力方面起輔助增強作用[35]。在肌原纖維蛋白形成魚糜凝膠過程中,通常添加氯化鈉以破壞蛋白質間離子鍵,使蛋白質解離,蛋白質解離對于熱凝膠彈性結構形成是必需的,解離后蛋白質又通過蛋白質間離子鍵、蛋白質與氯化鈉之間離子鍵共同作用增強魚糜凝膠強度[36]。
魚糜正常pH下肌原纖維蛋白凈電荷呈負電性,陽離子可通過形成蛋白質-陽離子-蛋白質橋加速蛋白質間相互作用,從而提高凝膠硬度和持水力,如圖5所示。勵建榮等研究表明帶正二價的鈣離子在相鄰蛋白質之間結合負電基團可形成離子鍵,有助于增加魚糜凝膠強度[36]。Arfat和Benjakul研究發現,Zn2+也可與蛋白質負電荷結構域之間形成鹽橋,而后蛋白質通過鹽橋交聯,改善蛋白質凝膠性質[37]。Wang等也表示,當肌原纖維蛋白凝膠中離子鍵含量達到最大時,凝膠具有最高含水率,原因可能是隨靜電相互作用增加,凝膠持水力提高[10]。
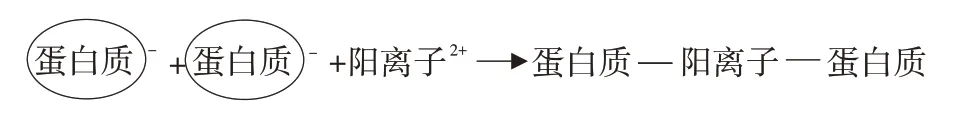
圖5 陽離子在蛋白質間作用過程Fig.5 Interaction process of cations between proteins
3.2 Zeta電位測定離子鍵
離子鍵可采用Zeta電位變化表示。具有高Zeta電位(絕對值)蛋白質膠體穩定,而具有低Zeta電位蛋白質傾向于凝聚或絮凝[38]。從目前研究結果看,較高Zeta電位絕對值可能增加蛋白結構穩定性,但Zeta電位值過高是否對蛋白結構穩定性造成不利影響還有待于進一步探究。Zhang等測定在不同壓力下Zeta電位變化,結果顯示,隨壓力增加(0.1~200 MPa),肌原纖維蛋白加熱成膠時,Zeta電位絕對值逐漸升高,蛋白質開始聚集成大分子聚合物,隨后蛋白質聚合物之間空間變大,具有更多負電荷,有助于吸引水分子;形成的凝膠由均勻小孔洞組成,有利于提高凝膠強度,且水分子被牢牢鎖在凝膠網絡中,使其具有更高硬度和較好持水力[17]。楊玉玲等通過研究氧化對凝膠質構和持水力影響發現,隨氧化程度增加,Zeta電位逐漸降低,預示離子鍵作用降低,凝膠網狀結構出現孔徑變大、膠束不均現象,進而影響凝膠超微結構和凝膠彈性[39]。
4 二硫鍵對凝膠質構和持水力的影響
4.1 二硫鍵與凝膠質構和持水力關系
二硫鍵形成被認為和巰基(-SH)變化高度相關,凝膠強度隨巰基含量增加而降低,巰基含量越低,凝膠強度越大,巰基含量減少主要由于蛋白質三級結構展開,位于肌原纖維蛋白內部的巰基暴露,游離的巰基受氧化作用形成二硫鍵[40]。蛋白質三級結構展開使巰基暴露,這與疏水相互作用形成過程中疏水基團暴露過程相似,且巰基氧化形成二硫鍵又加強蛋白質之間交聯,說明二硫鍵形成有助于凝膠強度增加,二硫鍵對凝膠結構形成有重要貢獻[11]。
適量二硫鍵可使魚糜凝膠有較好質構和持水力,但過量二硫鍵對魚糜凝膠持水力產生負面影響。鄭紅等研究表明,二硫鍵含量與鱔魚肉彈性、咀嚼性、回復性等質構特性之間呈顯著正相關(P<0.05),二硫鍵含量越低,蛋白結構越松散[41]。Chen等表示壓力處理后凝膠網狀結構不規則,二硫鍵含量增加可補償這一現象,從而使魚糜凝膠具有良好凝膠性能和網絡結構[42]。但過多二硫鍵并不能使魚糜凝膠有良好持水力,因為大量二硫鍵形成阻止肌原纖維蛋白最佳重排,形成的凝膠雖硬度較高但因不均一性和孔徑尺寸增加而導致持水力下降[43]。
4.2 二硫鍵測定
拉曼譜帶500~550 cm-1處是二硫鍵特征峰,且半胱氨酸巰基拉伸振動在2 550~2 580 cm-1區域產生弱拉曼帶,因此可采用拉曼光譜測定二硫鍵[16]。Wang等采用拉曼光譜檢測到位于525 cm-1附近拉曼光譜強度先增后降[44],因為蛋白質結構展開,使巰基暴露并形成二硫鍵(t-g-g構象),隨肌原纖維蛋白結構變化,二硫鍵又向其他兩種構象(t-g-t位于543 cm-1和g-g-g位于510 cm-1)[34]轉化,使S-S在525 cm-1處伸縮振動減弱。
相較于拉曼光譜,研究人員常用化學試劑檢測二硫鍵,這種方法優點在于可使二硫鍵形成來源及過程顯示更清楚。二硫鍵發生在一級或高級結構中相鄰半胱氨酸殘基之間,可在非還原條件下用碘乙酰胺(IAM)標記蛋白質中原有自由半胱氨酸,在加入還原劑打開二硫鍵后,再用N-乙基馬來酰亞胺(NEM)等其他烷基化試劑封閉新產生的自由巰基,通過烷基化標簽的質量數差異質譜分析其中的二硫鍵[45]。Lin等采用Ellman試劑法檢測二硫鍵含量[46],根據還原二硫鍵前后試劑DTNB與巰基結合顯色效果,二硫鍵增加使凝膠網絡結構更穩定,提高魚糜凝膠強度。
4.3 二硫鍵測定方法比較
拉曼光譜可反映蛋白中多個基團變化情況,但也因其包含信息量大,具有一定分析難度。烷基化試劑和Ellman試劑法均是通過將二硫鍵還原成巰基檢測,常被用于定量分析,同時可顯示出巰基與二硫鍵變化相關性,但檢測步驟較復雜,有一定操作難度。具體差異如表4所示。

表4 二硫鍵測定方法比較Table 4 Comparison of disulfide bonds determination methods
5 結論與展望
綜上,氫鍵是維持蛋白質二級結構主要作用力,二級結構中α-螺旋向β-折疊結構轉化有利于凝膠形成。疏水相互作用、離子鍵、二硫鍵均在蛋白三級結構中起作用。適當疏水相互作用及二硫鍵有利于魚糜凝膠質構和持水力,但過量疏水相互作用及二硫鍵對凝膠質構及持水力帶來不利影響。因而控制魚糜凝膠形成條件(鹽濃度、溫度、壓力、氧化強度等),使肌原纖維蛋白結構不被過度破壞,是改善魚糜制品品質關鍵。
通過比較幾種測定方法發現,拉曼光譜可應用范圍最廣,不僅可測定蛋白二、三級結構,還可檢測一些化學鍵與基團,但其靈敏度和準確性較其他測定方法差。因此,結合實際情況,選取幾種測定方法結合使用可使測定結果更加準確和全面。另外,除文章中所涉及測定結構方法外,掃描電鏡(SEM)、低場核磁共振(LF-NMR)、凝膠電泳(SDS-PAGE)、蛋白組學等方法,可共同確定蛋白質變化及其對魚糜凝膠質構及持水力的影響。

