擬南芥 AtFAD6 基因突變體的構建
徐雪珍 鄭月萍 張夏婷 宋孜元


摘要:? 運用優化后的CRISPR/Cas9基因編輯載體,創建了2個不同的擬南芥脂肪酸去飽和酶6基因(? AtFAD6? )突變體,其? AtFAD6? 基因的保守位點氨基酸序列均發生變化,同時終止密碼子被提前引入,基因功能喪失。脂肪酸組分分析結果顯示,這2種突變體的葉片中單不飽和脂肪酸 16∶ 1和 18∶ 1大量積累,多不飽和脂肪酸 16∶ 3和 18∶ 3含量則大幅下降,同時伴隨著葉片發黃、地上部生物量顯著降低、抽薹提前 2~ 3 d的表型變化。多不飽和脂肪酸 18∶ 3作為茉莉酸合成的前體物質,其含量的下降致使突變體中茉莉酸信號標記基因? AtVSP1? 在葉片中的表達量有所降低,而莖中的表達量提高了40%以上。所獲得的2個? AtFAD6? 功能喪失型突變體為進一步研究脂類代謝與植物生長發育之間的關系提供了重要的遺傳材料。
關鍵詞:? 擬南芥; CRISPR/Cas9; 脂肪酸去飽和酶( FAD ); 基因突變體
中圖分類號:? Q754??? 文獻標識碼: A??? 文章編號:? 1000-4440(2021)05-1125-06
Construction of?? Arabidopsis AtFAD6?? gene mutant
XU Xue-zhen, ZHENG Yue-ping, ZHANG Xia-ting, SONG Zi-yuan
(School of Agricultural and Food Sciences, Zhejiang A&F University, Hangzhou 311300, China)
Abstract:?? The optimized CRISPR/Cas9 gene editing vector was used to create two distinct ?Arabidopsis ???AtFAD6?? gene mutant. As the nucleotide sequence of the conserved amino acid residues was mutated, and the stop codon was introduced in advance, the?? fad6?? gene function of these two mutants was completely lost. The results of fatty acid composition analysis showed that monounsaturated fatty acids ?16∶ 1 and ?18∶ 1 accumulated significantly while the content of polyunsaturated fatty acids ?16∶ 3 and ?18∶ 3 decreased significantly in the leaves of these two mutants. At the same time, phenotypes of the mutants were appeared, including yellowed leaves, significantly decreased above-ground biomass, and bolting ?2- 3 days earlier than wild-type. The paly unsaturated fatty acid ?18∶ 3 was used as the precursor substance of jasmonic acid synthesis. The decrease of its content reduced the expression of the jasmonic acid signal marker gene?? AtVSP1?? in the leaves, while the expression in stems increased by more than 40%. The two?? AtFAD6?? loss-of-function mutants obtained in our study provide important genetic material for further research on the relationship between lipid metabolism and plant growth and development.
Key words:? ?Arabidopsis ; CRISPR/Cas9; fatty acid desaturase( FAD ); gene mutant
不飽和脂肪酸是植物細胞內一類重要的代謝物質,也是植物膜脂的主要結構成分,在植物生長發育、應答各種環境信號等過程中發揮重要作用? [1] 。脂肪酸去飽和酶( FAD )是催化脂肪酸鏈特定位置形成雙鍵和產生不飽和脂肪酸的酶類,它的種類和數量在很大程度上可以調控植物組織的脂肪酸組成。而膜脂中不飽和脂肪酸種類及其含量的改變常常引起膜功能的變化。在模式植物擬南芥( Arabidopsis thaliana )中, ?AtFAD6? 是質體內膜上的ω-6型脂肪酸去飽和酶,可將初步形成的甘油脂甘油骨架上的油酸( 18∶ 1)或棕櫚油酸( 16∶ 1)還原成亞油酸( 18∶ 2)或棕櫚亞油酸( 16∶ 2)? [2] ,它不僅對維持膜的穩定性和流動性具有重要作用,還參與茉莉酸(Jasmonic acid, JA)生物合成的前體物質三烯脂肪酸(Trienoic fatty acid)的合成? [3] 。茉莉酸是植物體內一種重要的內源激素,具有促進植物根系生長與再生、抑制擬南芥葉片和花瓣伸展、抑制植物下胚軸生長、調節氣孔開關、調控擬南芥雄蕊發育、促進葉片衰老等作用? ?[3] 。現有許多研究結果表明, ?FAD6? 在植物抵御低溫、高鹽脅迫等非生物脅迫中具有重要作用? [4] 。
在早期的基因功能研究中,研究者常采用反向遺傳學手段,構建基因突變體。受到技術水平的限制,前人構建突變體的方法多為化學誘變法。然而,這種方式構建的突變體常常只在目標基因發生點突變,使氨基酸殘基發生變化,不一定造成基因功能的完全喪失。例如有研究結果顯示使用EMS誘變創建的? ATS1? 基因突變體存在嚴重的基因滲透現象? [5] 。因此,構建功能完全喪失型突變體成為明晰基因功能的重要前提。隨著基因定點編輯技術的發展,CRISPR/Cas9系統的成功應用使構建功能喪失型突變體變得簡便。CRISPR/Cas9系統主要由sgRNA和Cas9蛋白兩部分構成,其基本工作原理是sgRNA在受體基因組中找到與其互補配對的片段,引導Cas9蛋白對該位點進行切割,而后在植物DNA自我修復過程中引入突變? [6] 。
目前在植物脂類代謝研究領域,使用的? AtFAD6? 基因突變體均為非同義突變,其中只有單個氨基酸殘基發生改變? [7] ,因而難以判定這類突變體是否含有部分 ?AtFAD6? 酶活性。在這種情況下,人們不能完全了解? AtFAD6? 基因的功能。因而,為了進一步闡明? AtFAD6? 的基因功能,本研究利用優化后的CRISPR/Cas9基因編輯載體對? AtFAD6? 基因進行定點編輯,構建功能完全喪失型突變體,并分析? AtFAD6? 基因功能的喪失對擬南芥抽薹及茉莉酸信號強度的影響。
1 材料與方法
1.1?? AtFAD6? 基因功能喪失型突變體的構建
1.1.1 CRISPR/Cas9載體的構建? CRISPR/Cas9靶序列的設計和載體的構建參照Wang等? [8] 和朱麗穎等? [9] 的方法。以擬南芥脂肪酸去飽和酶基因 ?AtFAD6? 為靶基因,從中選取G、C含量較高、基因特異性較強的2個關鍵片段? AtFAD6?? target sequence 1 (5′-CAGAAGAAGCAGCAAGCTTAGG-3′)和? AtFAD6?? target sequence 2 (5′-AAACCGCCATGGCTCATATGGG -3′)作為靶序列。其中,第一個靶序列含有 Hin d III酶切位點,可規避常用的PAGE法篩選遇到的難以篩選到堿基替換和小片段缺失的問題? [10] 。用高保真酶以稀釋100倍的pCBC-DT1T2為模板進行四接頭引物(5′-TGCAGAAGAAGCAGCAAGCTTGTTTTAGAGCTAGAAATAGC-3′,5′-AACATA ̄T ̄G ̄A ̄G ̄C ̄C ̄A ̄T ̄G ̄G ̄C ̄G ̄G ̄T ̄T ̄T ̄CAATCTCTTAGTCGACTCTCTAC-3′, ̄5′-A ̄T ̄A ̄T ̄A ̄T ̄G ̄G ̄T ̄C ̄T ̄C ̄G ̄A ̄T ̄T ̄G ̄C ̄A ̄G ̄A ̄A ̄G ̄A ̄A ̄G ̄C ̄A ̄G ̄C ̄A ̄A ̄G ̄C ̄T ̄T ̄G ̄T ̄T ̄-3′和5′-A ̄T ̄T ̄A ̄T ̄T ̄G ̄G ̄T ̄C ̄T ̄C ̄G ̄A ̄A ̄A ̄C ̄A ̄T ̄A ̄T ̄G ̄A ̄G ̄C ̄C ̄A ̄T ̄GGCGGTTTC -3′ )PCR擴增并純化回收PCR產物。同時用? Bsa? I酶切回收的PCR產物和CRISPR/Cas9載體,T4連接酶組裝最終載體,獲得雙靶點CRISPR/Cas9基因編輯載體。
1.1.2 擬南芥的遺傳轉化? 供試材料為哥倫比亞野生型擬南芥(Col-0),生長條件為14 h光照/10 h黑暗,晝夜溫度為22 ℃/18 ℃,相對濕度為40%,水肥供應充足。使用農桿菌侵染法將構建好的編輯基因載體轉化至擬南芥? [11] 。
1.1.3 擬南芥陽性轉基因后代的篩選? 我們在CRISPR/Cas9編輯載體中克隆了種子特異性表達的? At2S3? 啟動子驅動的熒光蛋白報告基因? mCherry? 作為篩選標記? [9] ,因此,在將編輯載體轉化擬南芥獲得T ?1 代轉基因種子后,使用熒光顯微鏡篩選轉基因陽性種子。轉基因陽性種子具有熒光蛋白報告基因 ?mCherry? 的轉入,在藍色激發光下可以顯示紅色熒光? [12] 。
1.1.4 突變體的分子篩選? 在靶序列? AtFAD6?? target sequence 1和? AtFAD6?? target sequence 2兩端分別設計引物,使PCR產物為包括靶序列在內約200 bp的片段。提取T ?1 代陽性轉基因植株葉片的DNA為模板進行PCR。取具有? AtFAD6?? target sequence 1序列的PCR產物用 Hind Ⅲ充分酶切,經2%瓊脂糖凝膠電泳檢測。取具有? AtFAD6?? target sequence 2序列的PCR產物用8%的非變性聚丙烯酰胺凝膠(丙烯酰 胺∶ 甲叉雙丙烯酰 胺=? 29∶ 1)檢測? [9] 。
1.2 葉片脂肪酸組分分析
取生長33 d的植株葉片樣品,經液氮研磨后稱取500 mg進行試驗。以100 μl 100 ?μg/ml 的十七烷酸甘油三酯正己烷溶液為內標,用6 ml氯 仿∶ 甲 醇∶ 甲酸 (10∶? 10∶ 1,體積比)和2 ml氯 仿∶ 甲 醇∶ 水 (5∶? 5∶ 1,體積比)經2次抽提,合并上清提取液,加入3 ml含0.2 ?mol/L 磷酸和1.0 ?mol/L 氯化鉀的水溶液,抽提下層氯仿相。經氮氣吹干后,加入 300 μl氯仿將沉淀重新溶解,再加入2 ml 1%硫酸-甲醇溶液,于80 ℃恒溫干式金屬浴2 h。冰上冷卻,用2 ml 0.9% NaCl(質量體積比)溶液和2 ml正己烷萃取后,再用2 ml正己烷二次萃取,合并萃取液。通過氮吹法濃縮萃取液體積至100 μl? [9] ,然后用氣相色譜儀進行檢測? [13] 。每個株系設置3個生物學重復。用單因素方差分析法分析株系間的差異顯著性。
1.3 葉綠素含量測定
取播種后 3~ 4周的植株整個地上部,放入干凈的12 ml帶蓋玻璃管中,加入3 ml 80%丙酮溶液。4 ℃下保存14 h,參照Arnon的方法對其葉綠素含量進行測定? [14] 。每個株系設置5個生物學重復,用單因素方差分析法分析株系間的差異顯著性。
1.4 地上部生物量測定
取播種后 21~ 28 d的植株整個地上部,分別在烘干前、后稱量其鮮質量與干質量,通過其鮮質量與干質量的差值占鮮質量的比例計算含水量。每個株系設置10個生物學重復,用單因素方差分析法分析株系間的差異顯著性。
1.5 基因表達量分析
基因表達量分析采用qRT-PCR 法。根據已知的? AtVSP1? 和? AtVSP2? 基因(Gene ID: AT5G24780)序列(數據來源于擬南芥信息資源庫www. Arabidopsis .org)設計實時定量PCR引物。? AtVSP1? 的正向引物和反向引物分別為5′-TGGATCTTTGACCTAGACGACA-3′和5′-CGAGTTCCAAGAGGTTTTVGTA-3′。
取播種后40 d的相同葉位葉片和莖,依次進行總RNA的提取(Trizol法)及基因組DNA的去除、反轉錄,并以反轉錄形成的cDNA為模板進行qRT-PCR檢測。以擬南芥 AtACTIN 為內參基因,其擴增引物序列為5′-GTCGTACAACCGGTATTGTGCT-3′和5′- TGTCTCTTACAATTTCCCGCTCT-3′。采取2? -△△ Ct? 法計算待測基因的相對表達量? [15] 。
2 結果與分析
2.1?? AtFAD6? 基因突變體的獲得
2.1.1?? AtFAD6? 基因突變體基因型的分子鑒定? 使用酶切法和PAGE法對轉基因陽性植株進行基因型鑒定。經過多代連續篩選鑒定后,獲得了2個純合的突變體,沿襲前人命名方式,并根據獲得突變體的順序,將其命名為? fad6? -2和? fad6? -3。
獲得純合可穩定遺傳的突變體后,對其靶位點附近序列進行分析驗證。結果表明? fad6? -2和? fad6? -3突變體分別在2個靶位點處,即第5個和第2個外顯子處,發生了47 bp缺失和1 bp插入的突變(圖1),其CDS序列發生相應變化,造成移碼突變。在轉錄后翻譯過程中,fad6-2的第187位氨基酸殘基由蘇氨酸(T)突變為甲硫氨酸(M),并在繼續錯誤翻譯2個氨基酸(VG-AV)后,引入終止密碼子UAA,提前終止翻譯;fad6-3的第25位氨基酸殘基由亮氨酸(L)突變為絲氨酸(S),并在繼續錯誤翻譯17個氨基酸(AASSARVSPGVYAVKPI-CCFFCSCFSWCICCEAD)后,引入終止密碼子UGA,提前終止翻譯。二者均造成由原位于207、210、211、367、370、371位點處的6個組氨酸殘基的氨基酸序列發生變化,而這些位點對鐵離子的結合具有重要作用? [16] 。因此,我們構建的突變體可判斷為功能喪失型突變體。
2.1.2??? AtFAD6? 基因突變體的脂肪酸組分分析??? AtFAD6? 負責編碼質體脂肪酸去飽和酶,它可以催化在單不飽和脂肪酸 16∶ 1或 18∶ 1中再引入一個雙鍵成為 16∶ 2或 18∶ 2的反應,因此,還可以通過測定葉片脂肪酸組分的變化驗證? AtFAD6? 的基因功能完整性。對生長33 d的植株葉片進行脂肪酸組分分析,結果(表1)顯示,與野生型相比,2個突變體中? AtFAD6? 的底物 16∶ 1和 18∶ 1大量累積,均上升5倍以上。而其最終產物不飽和脂肪酸 16∶ 3和 18∶ 3含量大幅下降,此結果同樣表明獲得的突變體為? AtFAD6? 基因功能喪失型突變體。
2.2?? AtFAD6? 基因突變體的表型分析
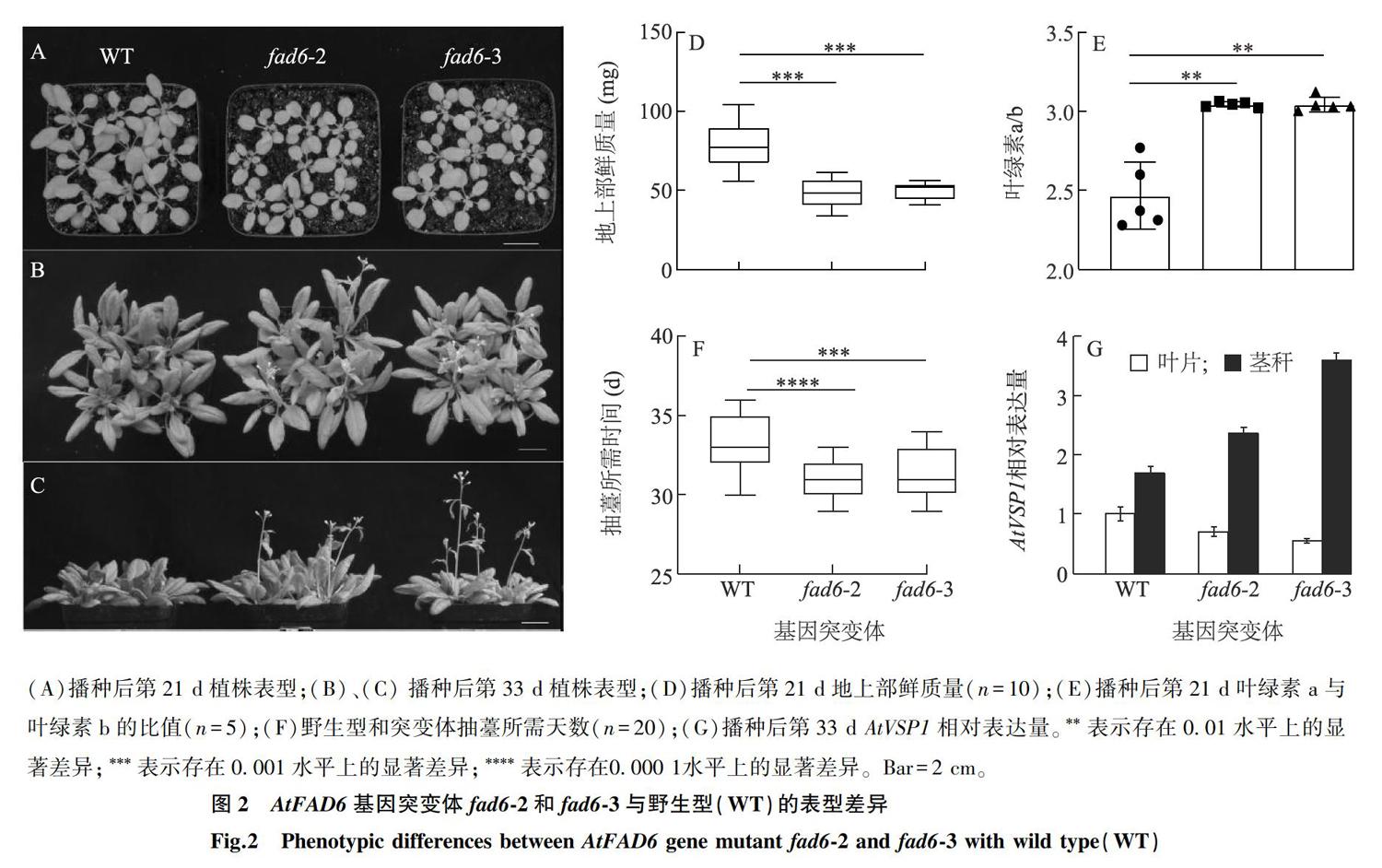
播種后21 d,? AtFAD6? 基因功能喪失型突變體與野生型相比表現出了明顯的表型差異。植株葉片變黃(圖2A);葉綠素a與葉綠素b的比值約上升23.4%(圖2E);地上部生長勢變弱,地上部生物量減少至野生型的62%左右(圖2D),而葉片含水量未發生顯著變化(數據未顯示)。另外,?? AtFAD6? 基因功能的喪失可顯著加速植物抽薹(圖2C),突變體擁有 8~ 9片蓮座葉時即可抽薹,而野生型蓮座葉需 11~ 13片時開始抽薹(圖 2B),與野生型相比,突變體抽薹日期比野生型提前了 2~ 3 d(圖2F)。另外,? AtFAD6? 產物 18∶ 3參與植物體內茉莉酸的生物合成? [3] , ??AtFAD6? 基因突變可能影響植物體內茉莉酸信號強度。本研究對茉莉酸信號標記基因? AtVSP1? 進行了表達量分析。結果顯示? AtVSP1? 表達量在葉片中稍有下降,在莖稈中提高了40%以上(圖2G),表明該生長階段,? AtFAD6? 功能的喪失對植物體內茉莉酸信號的影響具有組織特異性。
3 討 論
AtFAD6? 是質體 ω -6型脂肪酸去飽和酶,對葉片中脂肪酸組分具有重要影響。在本研究中創制的2個? AtFAD6? 基因功能喪失型突變體中,底物 16∶ 1和 18∶ 1大幅積累,產物 16∶ 3和 18∶ 3含量大幅下降,這與前人研究結果一致? [16-17] 。另外,脂肪酸組分的改變常常影響質體膜的完整性和流動性,進而影響植物對逆境脅迫的響應? [7,18] 。研究發現,在正常生長條件下, ?AtFAD6? 基因突變導致植株葉片整體發黃。出現葉片整體發黃表型的原因通常為受到了光、溫、水、土、肥、病蟲等方面非生物和生物脅迫,或自然衰老代謝。本研究中,植株生長過程中未受到生物和非生物脅迫,葉片含水量也未發生顯著變化,表明該表型不是由于葉片生理性缺水或衰老造成的。突變體葉片發黃可能是由于? AtFAD6? 直接負責質體內膜脂合成,其功能喪失影響了葉綠體內膜的完整性和流動性,進而導致葉綠體含量下降。而由于在不同部位形成的不飽和脂肪酸之間存在交換? [19] ,因此 ?AtFAD6? 基因喪失功能后,植株僅出現葉片發黃的表型,未直接死亡。而? AtFAD6? 基因功能的喪失是否導致了植株內源性氮元素的缺乏,還需進一步探究。
(A)播種后第21 d植株表型;(B)、(C) 播種后第33 d植株表型;(D)播種后第21 d地上部鮮質量( n =10);(E)播種后第21 d葉綠素a與葉綠素b的比值( n =5);(F)野生型和突變體抽薹所需天數( n =20);(G)播種后第33 d?? AtVSP1? 相對表達量。? * * 表示存在0.01水平上的顯著差異;? * * * 表示存在0.001水平上的顯著差異;? * * * * 表示存在 0.000 1 水平上的顯著差異。Bar=2 cm。
早期研究結果表明,在正常生長條件下,? AtFAD6? 基因功能的喪失對植株的生長及生長發育進程無明顯影響? [17] ,但本研究結果與其并不完全一致。我們發現, ?AtFAD6? 基因的突變造成植株地上部生物量顯著下降,抽薹顯著提前。這可能是由于在早期研究中,植株基因突變體的創建主要通過EMS誘變的途徑,創建的突變體? fad6? -1僅發生非同義突變,其翻譯的多肽鏈中,僅第160位的甘氨酸(G)殘基突變為精氨酸(R)? [7] ,在這種突變體中, ?AtFAD6? 基因功能可能未完全喪失,而我們構建的突變體為功能喪失型突變體。這些差異表明,我們獲得的功能喪失型突變體將有助于徹底了解? AtFAD6? 基因功能。同時也表明,利用CRISPR/Cas9基因編輯技術創制基因功能喪失的植物突變體具有重要的實踐應用價值? [20-21] 。
在本研究中,我們還對茉莉酸信號標記基因? AtVSP1? 在擬南芥野生型和突變體抽薹期葉片和莖稈中的表達量進行比較分析,結果顯示,? AtFAD6? 的突變造成? AtVSP1? 在植株葉片中表達量稍有降低,在莖稈中表達量大幅提升,表明? AtFAD6? 對植物體內茉莉酸信號的影響具有組織特異性。大量研究結果表明,茉莉酸信號途徑對植物開花時間和雄蕊發育等生育進程具有重要的調控作用? [22] 。 ?AtFAD6? 基因是否通過影響茉莉酸合成前體多不飽和脂肪酸的形成,進而影響茉莉酸信號強度的變化對植物抽薹以及生育期造成影響,及其具體分子機制還需進一步研究。
利用CRISPR/Cas9基因編輯技術創建? AtFAD6? 基因功能喪失型突變體,不僅有助于完善對? AtFAD6? 基因功能的認識,同時為進一步研究脂類代謝與植物生長發育的關系提供了有用的遺傳材料。
參考文獻:
[1]? 戴曉峰,肖 玲,武玉花,等.植物脂肪酸去飽和酶及其編碼基因研究進展[J].植物學通報,2007,24(1):106-115.
[2] OHLROGGE J B, BROWSE J A. Lipid biosynthesis[J]. Plant Cell, 1995, 7: 957-970.
[3] HUANG H, LIU B, LIU L, et al. Jasmonate action in plant growth and development[J]. Journal of Experimental Botany, 2017, 68(6):1349-1359.
[4] 劉 華,張建濤,陳海燕,等.脂肪酸去飽和酶參與植物對脅迫的響應[J].東北農業大學學報,2013,44(1):154-160.
[5] XU C C, YU B, CORNISH A J, et al. Phosphatidylglycerol biosynthesis in chloroplasts of ?Arabidopsis ?mutants deficient in acyl-ACP glycerol-3-phosphate acyltransferase[J]. Plant Journal, 2006, 47(2): 296-309.
[6] JAVED M R, SADAF M, AHMED T, et al. CRISPR-Cas system: history and prospects as a genome editing tool in microorganisms[J]. Current Microbiology, 2018, 75: 1675-1683.
[7] ZHANG J T, ZHU J Q, ZHU Q, et al. Fatty acid desaturase-6 (Fad6) is required for salt tolerance in ?Arabidopsis thaliana [J]. Biochemical and Biophysical Research Communications, 2009, 390: 469-474.
[8] WANG Z P, XING H L, DONG L, et al. Egg cell-specific promoter-controlled CRISPR/Cas9 efficiently generates homozygous mutants for multiple target genes in ?Arabidopsis ?in a single generation[J]. Genome Biology, 2016, 16: 144-155.
[9] 朱麗穎,鄭月萍,徐雪珍,等.一種準確、簡便測定CRISPR/Cas9 基因編輯效率的方法[J].江蘇農業學報,2020,36(2):299-305.
[10] ZHU X X, XU Y J, YU S S, et al. An efficient genotyping method for genome-modifid animals and human cells generated with CRISPR/Cas9 system[J]. Scientific Reports, 2014, 4:6420.
[11] 郭 勇,王玉成,王智博.一種基于農桿菌介導的擬南芥瞬時轉化技術優化[J]. 東北林業大學學報,2016,44(6):41-44,83.
[12] 陳 娟,周 潔,嚴其成,等.HPT-mCherry 融合標簽在水稻轉基因篩選鑒定中的應用[J]. 生物技術通訊,2013,24(5):677-681.
[13] 徐明明,史卓維,鄭璐俠,等.蓖麻油、氫化蓖麻油及其聚氧乙烯衍生物中的主要脂肪酸的鑒別[J]. 藥物分析雜志,2015,35(10):1862-1865.
[14] ARNON D. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in ?Beta vulgaris [J]. Plant Physiology, 1949, 24: 1-15.
[15] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative pcr and the 2? -△△ Ct? ?method[J]. Methods, 2001, 25: 402-408.
[16] FALCONE L D, GIBSON S, LENIEUX B, et al. Identification of a gene that complements an ?Arabidopsis ?mutant deficient in chloroplast ω6 desaturase activity[J]. Plant Physiology, 1994, 106: 1453-1459.
[17] BROWSE J, KUNST L, ANDERSON S, et al. A mutant of ?Arabidopsis ?deficient in the Chloroplast ?16∶ 1/ 18∶ 1 desaturase[J]. Plant Physiology, 1989, 90: 522-529.
[18] KACHROO P, SHANKLIN J, SHAH J, et al. A fatty acid desaturase modulates the activation of defense signaling pathways in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98: 9448-9453.
[19] JOHN O, JOHN B. Lipid biosynthesis[J]. Plant Cell, 1995, 7: 957-970.
[20] 李星坤,潘 慧,李 攀,等. 基于? CRISPR/Cas9? 系統的擬南芥? ugt84a1/ugt84a2? 雙突變體制作及突變位點分析[J].江蘇農業科學,2020,48(20):49-55.
[21] 易 勇,鄭 瑞,楊 波,等.水稻鋅指蛋白基因? CRISPR/Cas9? 突變體的構建及突變分析[J].南方農業學報,2020,51(11):2607-2613.
[22] 陳金煥,田玉如,李艾佳,等.茉莉酸信號及其在木本植物中的研究進展[J]. 中國科學,2020,50(2):215-226.
(責任編輯:張震林)

