復(fù)雜信號(hào)通路參與調(diào)控水稻粒重相關(guān)基因研究進(jìn)展
陳 可,周新橋,陳達(dá)剛,郭 潔,陳平麗,李逸翔,2,劉傳光,陳友訂
(1.廣東省農(nóng)業(yè)科學(xué)院水稻研究所/廣東省水稻育種新技術(shù)重點(diǎn)實(shí)驗(yàn)室/廣東省水稻工程實(shí)驗(yàn)室,廣東 廣州 510640;2.廣東海洋大學(xué)濱海農(nóng)業(yè)學(xué)院,廣東 湛江 524088)
作為全球范圍內(nèi)最重要的糧食作物之一,水稻提供了約50%世界人口的每日主糧[1]。因此,研究高產(chǎn)、優(yōu)質(zhì)的水稻及其分子機(jī)理有著重要的生物學(xué)和生產(chǎn)實(shí)踐意義。20 世紀(jì)50 年代開始的第一次“綠色革命”,包括水稻育種的半矮稈基因(semi-dwarf 1)sd1的應(yīng)用、70 年代三系雜交水稻的應(yīng)用,極大地促進(jìn)了谷物產(chǎn)量增長(zhǎng)[2]。這一階段主要關(guān)注水稻和小麥半顯性基因的應(yīng)用及以胞質(zhì)雄性不育(CMS)在雜交水稻的應(yīng)用[3]。進(jìn)入21 世紀(jì),“超級(jí)稻”概念、“理想株型”模型及基因編輯技術(shù)的發(fā)展為我國(guó)水稻產(chǎn)量持續(xù)增長(zhǎng)奠定了理論基礎(chǔ)[4]。特別是在新冠病毒肆虐的2020 年以后,我國(guó)水稻生產(chǎn)又面臨新的嚴(yán)峻挑戰(zhàn),“三胎”政策的開放促進(jìn)人口增長(zhǎng)、經(jīng)濟(jì)發(fā)展導(dǎo)致耕地過快減少的態(tài)勢(shì)與“18 億畝耕地紅線”嚴(yán)防死守的矛盾等。2021 年中央一號(hào)文件把提升糧食和重要農(nóng)產(chǎn)品供給保障能力作為加快推進(jìn)農(nóng)業(yè)現(xiàn)代化的首要任務(wù)。因此,如何突破傳統(tǒng)育種瓶頸,將水稻分子育種和功能基因組學(xué)系統(tǒng)結(jié)合應(yīng)用于水稻育種改良,已經(jīng)成為新時(shí)代我國(guó)糧食安全和農(nóng)業(yè)現(xiàn)代化面臨的亟待解決的重大科學(xué)問題[5]。
水稻單株產(chǎn)量主要由有效穗數(shù)、每穗粒數(shù)、粒重3 個(gè)因素決定。多年來的水稻基礎(chǔ)研究不斷豐富水稻基因組序列信息和注釋,并且超過120個(gè)主效及微效(數(shù)量性狀遺傳位點(diǎn))QTLs 位點(diǎn)已經(jīng)成功克隆、鑒定及功能分析[6]。在超過1 萬年的水稻馴化過程中,人類通過人工選擇產(chǎn)生了許多水稻亞種和品種,并且使得水稻的分布從熱帶地區(qū)擴(kuò)展到溫帶地區(qū)的五大洲。近年來,基于圖位克隆的遺傳分析、規(guī)律成簇的間隔短回文重復(fù)(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR)及其衍生的基因編輯技術(shù)快速發(fā)展,在多種水稻農(nóng)藝性狀的研究中發(fā)揮了重要作用[7]。本文綜述總結(jié)了近年來水稻粒重相關(guān)基因的研究進(jìn)展,包括QTL 和質(zhì)量性狀相關(guān)基因,并且深入討論其在現(xiàn)代農(nóng)業(yè)育種上的應(yīng)用,結(jié)合5G 時(shí)代數(shù)字化智能化生物現(xiàn)代育種,對(duì)我國(guó)目前生物育種4.0 時(shí)代進(jìn)行展望。
1 水稻粒重影響因素及相關(guān)基因
水稻粒重(千粒重、鮮重)受到水稻粒長(zhǎng)、粒寬、粒厚和灌漿等因素影響[8],這些基因協(xié)同作用,共同調(diào)控水稻粒重這一數(shù)量性狀,維持水稻產(chǎn)量的動(dòng)態(tài)平衡。水稻的拔節(jié)孕穗期是營(yíng)養(yǎng)生長(zhǎng)與生殖生長(zhǎng)的并進(jìn)時(shí)期,這期間水稻生物量迅速增大,以幼穗發(fā)育為中心的生殖發(fā)育迅速起始,特別是水稻幼穗發(fā)育8 個(gè)時(shí)期中的第3 期-第2次枝梗原基及穎花原基分化期決定水稻穗型、第5 期到第8 期穎殼發(fā)育期決定水稻粒型。從細(xì)胞生物學(xué)角度來評(píng)估水稻粒重的變化,可以追溯到原基發(fā)育時(shí)分生組織的細(xì)胞數(shù)量、細(xì)胞分裂能力和細(xì)胞伸長(zhǎng)范圍等。而水稻幼穗分化完成期及水稻灌漿期是對(duì)已定型的完成授粉的水稻籽粒進(jìn)行營(yíng)養(yǎng)運(yùn)輸?shù)亩畏峙洌ㄔ?庫(kù)-流理論)的時(shí)期,灌漿效率及淀粉等營(yíng)養(yǎng)物質(zhì)的組成均對(duì)水稻粒重產(chǎn)生明顯影響。迄今為止,幾乎大部分的主效粒重相關(guān)QTLs 已經(jīng)被報(bào)道,多個(gè)綜述也從不同角度總結(jié)這些基因及其作用[8-9]。除了上述因素外,穎殼的發(fā)育對(duì)水稻粒型的長(zhǎng)度和寬度也有重要影響。水稻灌漿過程和胚乳發(fā)育過程影響光合產(chǎn)物及其積累。表1 為近年來克隆鑒定的影響水稻粒寬、粒長(zhǎng)、粒厚及灌漿速率的QTL 和功能基因。
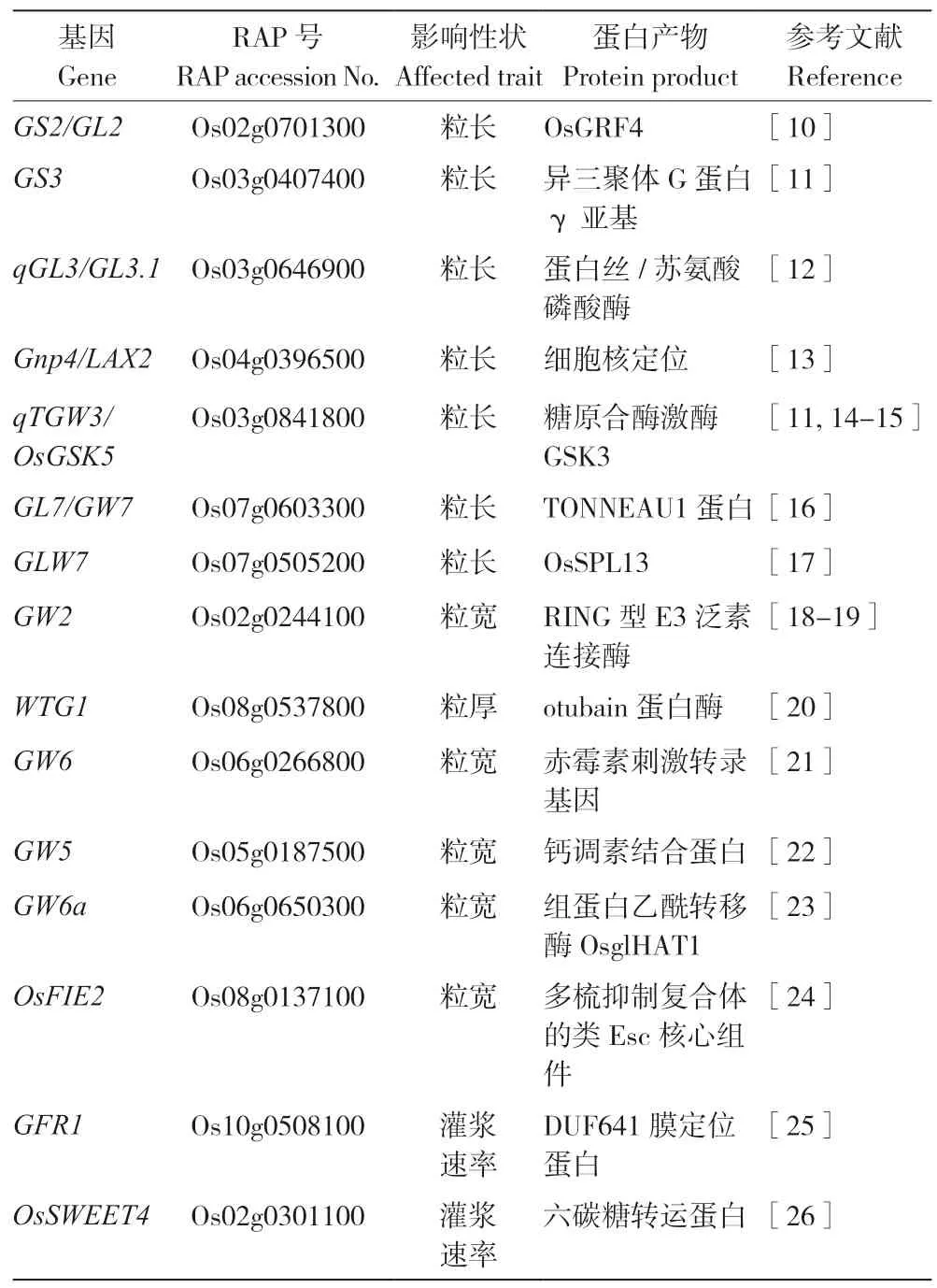
表1 水稻部分粒重相關(guān)基因和QTLsTable 1 Partially grain weight related genes and QTLs
2 不同信號(hào)調(diào)控途徑的水稻粒重相關(guān)基因
過去20 年的研究揭示了水稻粒重受到多種信號(hào)途徑調(diào)控,包括泛素化修飾途徑、植物激素信號(hào)途徑、G 蛋白信號(hào)途徑、光合產(chǎn)物積累運(yùn)輸相關(guān)途徑、胚乳發(fā)育途徑、表觀修飾途徑及小微RNA 途徑等[27]。本文對(duì)上述途徑的水稻粒重相關(guān)基因進(jìn)行總結(jié)與梳理。
2.1 泛素化調(diào)控途徑
泛素介導(dǎo)的蛋白酶體降解途徑是細(xì)胞體內(nèi)代謝和蛋白動(dòng)態(tài)變化的主要途徑。泛素化調(diào)控途徑包括3 種泛素酶的協(xié)同作用:由泛素激活酶E1、泛素結(jié)合酶E2 和泛素連接酶E3 特異性識(shí)別靶蛋白并且標(biāo)記泛素,進(jìn)而受到蛋白酶體識(shí)別降解[28]。Grain Width 2(GW2)是粳稻主效調(diào)控粒寬的QTL,編碼一個(gè)細(xì)胞核定位RING-type 的E3泛素連接酶。失活的GW2等位基因能增大細(xì)胞面積,過表達(dá)GW2造成粒型減少,表明GW2是一個(gè)水稻粒寬的負(fù)調(diào)控因子。GW2 能與幾丁質(zhì)酶(CHT14)和磷酸甘油酸酯激酶(PGK)相互作用,并通過改變這兩個(gè)蛋白的活性和穩(wěn)定性影響水稻種子碳代謝途徑[18]。另外,水稻去泛素化酶15(OsUBP15)能夠與水稻的泛素受體(OsDA1)相互作用,遺傳證據(jù)顯示OsUBP15 可能在功能上部分依賴GW2 通過泛素化和去泛素化的動(dòng)態(tài)變化調(diào)控下游底物蛋白量的變化[19]。另一個(gè)去泛素化酶WIDE AND THICK GRAIN 1(WTG1,同OsOTUB1和GWC1)能夠正向調(diào)控穎殼細(xì)胞延伸和稻米品質(zhì)。Heading and Grain Weight(HGW)編碼一個(gè)能夠與多種水稻種子發(fā)育和開花期相關(guān)蛋白共表達(dá)的新的核質(zhì)共定位多聚泛素結(jié)合酶(UBA)[20]。擬南芥中發(fā)現(xiàn)將泛素連接酶E3 和UBA 突變后明顯影響種子護(hù)穎及表皮的發(fā)育,表明這條泛素介導(dǎo)的蛋白酶體降解途徑在植物種子發(fā)育過程非常保守。
2.2 植物激素調(diào)控途徑
植物激素參與了多種植物生長(zhǎng)發(fā)育過程。到目前為止,幾乎所有的植物激素(生長(zhǎng)素、乙烯、赤霉素、細(xì)胞分裂素、油菜素內(nèi)酯和茉莉酸等)均能調(diào)控水稻粒重,這些激素可能通過協(xié)同作用或拮抗作用調(diào)控水稻粒重。多種激素途徑相關(guān)基因能夠改變并產(chǎn)生多種水稻表型。
2.2.1生長(zhǎng)素 作為第一個(gè)被發(fā)現(xiàn)的植物激素,生長(zhǎng)素(Auxin)的作用是促進(jìn)細(xì)胞分化與分裂。生長(zhǎng)素在包括種子生長(zhǎng)、胚胎發(fā)育及配子體形成等植物多個(gè)發(fā)育階段發(fā)揮重要作用。生長(zhǎng)素極性運(yùn)輸(PAT)和生長(zhǎng)素信號(hào)傳導(dǎo)同樣影響籽粒發(fā)育成熟過程[29]。Tillering and Small Grain 1(TSG1)是FISH BONE(FIB)基因的等位基因,編碼一個(gè)色氨酸氨基轉(zhuǎn)移酶[30]。tsg1突變體對(duì)外源吲哚乙酸敏感,在水稻的4 個(gè)色氨酸氨基轉(zhuǎn)移酶同源基因中,TSG1對(duì)生長(zhǎng)素合成起主要作用。2018 年3 個(gè)課題組同時(shí)在Molecular Plant發(fā)表qTGW3/GL3.3/TGW3作為水稻新的粒重QTL 負(fù)調(diào)控粒型的研究成果[11,14-15]。這個(gè)QTL 位點(diǎn)編碼一個(gè)糖原合成酶激酶3,能夠分別與生長(zhǎng)素響應(yīng)因子OsARF4 和水稻主效粒型QTLGS3發(fā)生相互作用。OsARF多個(gè)基因參與水稻粒型調(diào)控作用。另一個(gè)水稻粒重的微效QTLGSA1編碼一個(gè)UDP-葡萄糖轉(zhuǎn)移酶,通過影響類黃酮介導(dǎo)的生長(zhǎng)素含量變化及相關(guān)基因表達(dá)量形成抗逆和產(chǎn)量的動(dòng)態(tài)平衡關(guān)系[31]。除了上文提到的OsARF4影響水稻粒型外,Qiao 等揭示一條全新的miR167a-OsARF6-OsAUX3調(diào)控水稻粒長(zhǎng)和粒重的分子調(diào)控模塊[32];OsARF25的T-DNA 插入突變體表現(xiàn)出粒型變短的表型;稀穗基因Gnp4/LAX2能與OsIAA3互作干擾OsIAA3-OsARF25 調(diào)控模塊,進(jìn)而影響下游OsERF142/SMOS1(Small Organ Size 1)基因表達(dá)[13]。OsARF11正調(diào)控水稻粒型及植物發(fā)育過程[33]。SMOS1和SMOS2分別編碼一個(gè)生長(zhǎng)素調(diào)控的APETALA2 轉(zhuǎn)錄因子和與赤霉素相關(guān)的GRAS 轉(zhuǎn)錄因子〔與DWARF AND LOW-TILLERING(DLT)基因相同〕。這其中是否存在更廣義的互作及調(diào)控機(jī)制,有待進(jìn)一步研究。
2.2.2乙烯 作為唯一的氣體植物激素,乙烯(Ethylene)在促進(jìn)葉片衰老、水果成熟、種子休眠及種子的三重反應(yīng)中發(fā)揮重要作用[34]。以“貓胡子”(MHZs)表型的乙烯相關(guān)的突變體揭示乙烯調(diào)控水稻發(fā)育過程的重要調(diào)控網(wǎng)絡(luò)。MHZ3編碼一個(gè)內(nèi)質(zhì)網(wǎng)(ER)定位蛋白。其蛋白N 端C端能夠與OsEIN2發(fā)生相互作用。過表達(dá)MHZ3可顯著增加OsEIN2 的數(shù)量和水稻種子大小[35]。EIN3 水稻同源基因OsEIL/MHZ6也通過實(shí)驗(yàn)證明與水稻種子大小呈正相關(guān)[36]。過量表達(dá)乙烯受體ETR2導(dǎo)致水稻粒重減少,類似結(jié)果在百脈根(Medicago sativaL.)也得到驗(yàn)證[37]。這些結(jié)果表明水稻粒型與乙烯信號(hào)傳導(dǎo)呈正相關(guān)關(guān)系。與其相關(guān)的一個(gè)水稻基因OsSPMS1編碼一個(gè)熱精胺合成酶,通過負(fù)調(diào)控乙烯前體1-氨基環(huán)丙烷羧酸(ACC)含量調(diào)控水稻粒型[38]。Ahmadizadeh等總結(jié)和預(yù)測(cè)了擬南芥和水稻乙烯合成途徑具有功能的編碼基因,并且這些基因的啟動(dòng)子區(qū)順式元件與光反應(yīng)、缺水、細(xì)胞周期及水楊酸誘導(dǎo)相關(guān)。可以預(yù)期未來會(huì)有更多的乙烯相關(guān)基因與水稻粒重的調(diào)控關(guān)系被揭示[39]。
2.2.3赤霉素 赤霉素(Gibberellins,GAs)由一系列具有共同結(jié)構(gòu)的植物激素家族組成,對(duì)種子萌發(fā)、株高增加、葉形態(tài)建成、開花誘導(dǎo)等有重要促進(jìn)作用[40]。Grain Number per Panicle 1(GNP1)編碼GA 20 氧化酶1(OsGAox1),參與水稻品種特青的穗粒數(shù)和產(chǎn)量的調(diào)控[41]。值得注意的是,其同源基因OsGAox2正是“第一次綠色革命”廣泛應(yīng)用的sd1基因[2]。Small and dwarf 2(sgd2)突變體表現(xiàn)出植株株高變矮及粒型減少等表型,通過正向定位發(fā)現(xiàn)該基因編碼一個(gè)亮氨酸拉鏈Ⅱ(HD-Zip)家族轉(zhuǎn)錄因子,其通過轉(zhuǎn)錄水平調(diào)控多個(gè)GA合成相關(guān)基因的表達(dá)量,從而影響水稻粒型[42]。GAST 家族基因編碼具有一個(gè)保守的富半胱氨酸多肽,其表達(dá)量受到GA的誘導(dǎo)[43],迄今為止,3 個(gè)GAST 家族基因都被報(bào)道與水稻粒型相關(guān),包括OsGASR9、GW6和OsGASR1[21,44-45]。這些結(jié)果表明,GAST 家族基因在調(diào)控GA 通路和水稻穗部發(fā)育功能方面高度保守和一致。細(xì)葉基因Narrow Leaf 2和Narrow Leaf 3編碼WUSCHEL 同源盒3A(WOX3A)轉(zhuǎn)錄因子,能夠特異性負(fù)調(diào)控GA 合成和GA 前體代謝物的動(dòng)態(tài)平衡。過表達(dá)OsWOX3A基因能夠模擬GA 缺陷表型,包括株高變矮、葉片變細(xì)、穗粒數(shù)減少及粒型變小[46]。綜上,GA 信號(hào)調(diào)控途徑能夠顯著影響水稻粒重相關(guān)表型。
2.2.4細(xì)胞分裂素 植物激素細(xì)胞分裂素(Cytokinin,CK)能夠促進(jìn)細(xì)胞分裂和細(xì)胞分化,主要在植物根部、莖部、頂端優(yōu)勢(shì)、細(xì)胞衰老、果實(shí)成熟、生物和非生物脅迫等生長(zhǎng)發(fā)育過程發(fā)揮重要作用。在CK 合成過程中,異戊二酰轉(zhuǎn)移酶(IPT)是重要的合成限速步驟,而細(xì)胞分裂素氧化酶(CKXs)調(diào)控CK 降解。外源施加CK能夠抑制CKXs 表達(dá),增加種子大小[47]。林鴻宣課題組報(bào)道一個(gè)水稻的鹽旱耐受突變體dst能夠增加水稻非生物脅迫抗性同時(shí)影響葉片寬度和水稻粒型。作為一個(gè)鋅指轉(zhuǎn)錄因子,DST 能夠結(jié)合H2O2代謝相關(guān)基因啟動(dòng)子區(qū)調(diào)控水稻對(duì)于非生物脅迫響應(yīng)。進(jìn)一步研究發(fā)現(xiàn),DST 能夠結(jié)合OsCKX2啟動(dòng)子調(diào)控OsCKX2在穗部表達(dá)。Glo 等發(fā)現(xiàn)MAPK6 能夠直接結(jié)合DST 并且對(duì)其磷酸化以激活OsCKX2的表達(dá)[48]。水稻中過表達(dá)IPT基因能夠增加水稻產(chǎn)量[49]。OsSGL編碼一個(gè)未知功能結(jié)構(gòu)域(DUF1645)蛋白正向調(diào)控CK 信號(hào)途徑和水稻非生物脅迫。除此之外,對(duì)嘌呤滲透酶家族(OsPUPs)的研究表明其可以調(diào)控CK運(yùn)輸和改變種子大小和重量。OsPUP4(BG3)直接對(duì)遠(yuǎn)距離CK 運(yùn)輸和本地分布產(chǎn)生影響[50]。以上結(jié)果表明,CK 參與水稻的非生物脅迫響應(yīng)和幼穗發(fā)育過程。
2.2.5油菜素內(nèi)酯 早在1979 年,科學(xué)家就從油菜分離出一類與人類類固醇結(jié)構(gòu)相近的化合物并且命名為油菜素內(nèi)酯(Brassinosteroids,BRs)[51]。BR 能夠影響種子萌發(fā)、氣孔形成、維管束分化、花粉育性及衰老等重要生理生化過程,特別是對(duì)株高、葉傾角、粒型及分蘗數(shù)等重要農(nóng)藝性狀產(chǎn)生顯著影響。BR 合成途徑或者信號(hào)傳導(dǎo)缺陷突變體,包括D11,OsBR6ox/BRD1,D2,BRD2等,均表現(xiàn)出株高變矮、穗長(zhǎng)變短、葉片顏色變深、水稻粒型變小等表型[52]。突變體Slender grain Dominant(slg-D)表現(xiàn)出BR 過量表型,包括植株松散、較大的葉傾角和更長(zhǎng)水稻粒長(zhǎng)[53]。GW5與一個(gè)糖原合成酶激酶2(GSK2)相互作用,通過對(duì)BR 信號(hào)傳導(dǎo)通路BZR1 和DLT 磷酸化調(diào)控BR 介導(dǎo)的水稻粒型建成[22]。值得注意的是,GW5及其同源基因能夠與BR 信號(hào)通路關(guān)鍵成分GSK2 和BIN2 互作導(dǎo)致DLT 和OsBZR1 的磷酸化程度降低[54]。一個(gè)含有OVATE 結(jié)構(gòu)的家族蛋白成員(OFPs)被證明受到GSK2 的磷酸化過程參與BR 信號(hào)途徑介導(dǎo)的水稻粒型調(diào)控。包括OFP1、OFP3、OFP8 及OFP14 等[55]。Yu 等在對(duì)水稻OFP 家族蛋白表達(dá)模式和亞細(xì)胞定位分析發(fā)現(xiàn)OFP15 也是具有BR信號(hào)誘導(dǎo)表達(dá)的特征,可能也參與BR 信號(hào)調(diào)控水稻株型和粒型性狀[56]。
除了上述一直報(bào)道的BR 信號(hào)成員調(diào)控水稻粒型外,仍有許多新的未知的分子機(jī)制參與BR信號(hào)介導(dǎo)的水稻粒型調(diào)控。G-蛋白α 亞基D1/RGA1對(duì)BR 處理呈正相關(guān),其功能失活突變體d1表現(xiàn)出株高變矮及小粒[57]。進(jìn)一步研究發(fā)現(xiàn)D1/RGA1能夠與一個(gè)U-BOX 結(jié)構(gòu)域的E3 泛素連接酶(TUD1)發(fā)生相互作用,d1tud1-5雙突變體表現(xiàn)出節(jié)間縮短、葉傾角減少、粒型變小等表型[58]。另一個(gè)大的轉(zhuǎn)錄因子家族GATA 包括鋅指結(jié)構(gòu)域和DNA 結(jié)合區(qū)域,對(duì)OsGATA7進(jìn)行RNAi和基因敲除發(fā)現(xiàn),轉(zhuǎn)基因水稻對(duì)BR 處理不敏感,而過量表達(dá)則表現(xiàn)出相反表型[59]。除了上述這些基因外,絲裂原活化蛋白激酶(MAPKs)與BR 信號(hào)通路有很強(qiáng)的交互作用。SMALL GRAIN 1(SMG1)編碼水稻OsMKK4基因,其突變體smg1表現(xiàn)出與D61/OsBRI1,OsBZR1,OsGSK2和DLT缺陷突變體類似的BR缺乏表型[60]。Dwarf and Small Grain 1(DSG1)編碼OsMAPK6,其作為OsMKK4 下游靶基因共同調(diào)控水稻粒型。MAPK 上游OsMKKK10 結(jié)合并且磷酸化OsMKK4 調(diào)控水稻粒型大小。其功能失活突變體osmkkk10突變體表現(xiàn)出更小的水稻粒型和粒重。組成性過表達(dá)(CA-OsMKKK10)表現(xiàn)出穗型和粒型增大。GRAIN SIZE AND NUMBER 1(GSN1)能夠?qū)APK6 進(jìn)行去磷酸化修飾,參與GSN1-MAPK 分子調(diào)控模塊[61]。在MAPK調(diào)控途徑最上游,類受體激酶(RLK)OsER1 能夠?qū)sMPKKK10 進(jìn)行磷酸化,通過MAPK 信號(hào)調(diào)控途徑影響DST[48]。除此之外,小G 蛋白OsRac1 也可以與OsMAPK6 相互作用正向調(diào)控水稻粒型[62]。作為主要的調(diào)控水稻粒長(zhǎng)QTL,qGL3/GL3.1編碼一個(gè)Kelch 重復(fù)絲/蘇氨酸蛋白磷酸激酶OsPPKL1,其底物包括細(xì)胞周期蛋白Cyclin-T1;3 和GSK3[12]。綜上所述,BR 信號(hào)途徑、MAPK 信號(hào)途徑通過磷酸化修飾精確調(diào)控水稻粒型和穗型動(dòng)態(tài)平衡。
2.3 G 蛋白調(diào)控途徑
異源三聚體G 蛋白(G-proteins)在植物和動(dòng)物信號(hào)傳導(dǎo)通路差異較大,由Gα、Gβ 和Gγ組成,水稻中調(diào)控多種激素、干旱、抗病、側(cè)根形成等發(fā)育過程[63]。水稻中G 蛋白均已報(bào)道與穗部發(fā)育、粒型、灌漿速率及每穗粒數(shù)等直接相關(guān)。上文提到Gα(RGA1)蛋白通過調(diào)控BR 信號(hào)途徑影響水稻粒型。Gβ(RGB1)正調(diào)控水稻粒型和株型[64]。Gγ 則包括RGG1、RGG2、GS3、GGC2 及DEP1[65]。然而,雖然DEP1 蛋白結(jié)構(gòu)上類似GS3,但是DEP1 的表型卻與GS3 相反,DEP1是正調(diào)控水稻粒型基因[66]。G-蛋白下游靶基因包括編碼OsMADS1基因等的轉(zhuǎn)錄活性影響水稻粒型和胚乳淀粉含量[67]。綜上所述,G蛋白信號(hào)途徑對(duì)水稻粒型影響起重要調(diào)控作用。
2.4 光合作用及胚乳發(fā)育調(diào)控途徑
穎殼大小及灌漿程度是影響水稻粒重和品質(zhì)的重要因素。對(duì)于水稻粒型的有關(guān)綜述已多次指出調(diào)控穎殼細(xì)胞伸長(zhǎng)和分裂和胚乳發(fā)育相關(guān)基因?qū)λ玖V氐挠绊懀?8]。QUASIMODO2(OsQUA2)編碼一個(gè)果膠甲基轉(zhuǎn)移酶,對(duì)胚乳細(xì)胞壁乳糖醛酸的甲基酯化有重要作用,支持了光合產(chǎn)物遠(yuǎn)距離運(yùn)輸?shù)摹霸?庫(kù)”理論[69]。液泡轉(zhuǎn)換酶OsINV2 和OsINV3 正向調(diào)控水稻淀粉組成和糖代謝過程,特別是OsINV3 對(duì)水稻粒型正向調(diào)控[70]。OsSWEET4編碼一個(gè)糖轉(zhuǎn)運(yùn)蛋白促進(jìn)六碳糖從韌皮部向胚乳細(xì)胞的轉(zhuǎn)運(yùn)影響水稻粒重[26]。另外一個(gè)膜蛋白GRAIN-FILLING RATE 1(GFR1),通過與Rubisco 小亞基相互作用調(diào)控水稻種子灌漿速率[25]。
胚乳顆粒的形成是一個(gè)復(fù)雜過程,胚乳主要由兩種多聚物組成,直鏈淀粉和支鏈淀粉的比例影響稻米品質(zhì)。多年來,大量稻米品質(zhì)相關(guān)突變體如f loury endosperm(FLOs)已經(jīng)被揭示與胚乳正常形成、水稻粒重密切相關(guān)。包括FLO2、FLO7、FLO10、FLO11-2、FLO13及FLO19等,他們編碼不同的基因在不同調(diào)控途徑發(fā)揮作用,影響胚乳及正常灌漿[27]。此外,水稻細(xì)胞核Y家族對(duì)于水稻灌漿期調(diào)控非常重要。如OsNFYB1的RNAi轉(zhuǎn)基因植株表現(xiàn)出堊白率增加,通過結(jié)合GCC 盒ERF 轉(zhuǎn)錄因子和OsYUC11等調(diào)控水稻灌漿期表型[10,71-72];OsNF-YB1、OsNFYC12 和OsbHLH144 三者形成復(fù)合體通過減少OsYNF-YB1 被26S 蛋白酶體降解的數(shù)量維持OsNF-YB1 的穩(wěn)定性,OsNF-YC12 也可以通過結(jié)合FLO6和OsGS1;3啟動(dòng)子區(qū)調(diào)控稻米品質(zhì)[27]。除了上述這些基因外,OsNF-YC10、OsNF-YB9、OsNF-YC2、及OsNF-YC4參與水稻穗形態(tài)建成和粒型發(fā)育調(diào)控[73-75]。上述這些結(jié)果表明,細(xì)胞核Y 家族蛋白調(diào)控水稻粒型和品質(zhì)。
2.5 表觀修飾調(diào)控途徑
表觀修飾主要指不改變DNA 序列的可遺傳表型變化[76]。對(duì)組蛋白的包括H3 和H4 的甲基化、乙酰化修飾在水稻的功能研究最為透徹。作為第一個(gè)參與表觀修飾調(diào)控的水稻粒型QTL,GW6a編碼一個(gè)含有GNAT 結(jié)構(gòu)域組蛋白乙酰轉(zhuǎn)移酶Osg1HAT1,過表達(dá)GW6a 能增加穎殼細(xì)胞數(shù)量、籽粒灌漿速率、籽粒大小及千粒重;此外,Osg1HAT1 也促進(jìn)參與組蛋白H4 乙酰化修飾[23]。通過酵母雙雜交實(shí)驗(yàn)篩選,水稻DA1 的同源蛋白HDR3 能夠與GW6a 發(fā)生相互作用。HDR3 是一個(gè)能夠正向調(diào)控水稻籽粒大小的具有泛素結(jié)合活性的泛素受體蛋白,有趣的是,HDR3 是通過增強(qiáng)GW6a 泛素化水平來延緩而不是促進(jìn)GW6a 依賴26S 蛋白酶體的降解,從而提高GW6a 蛋白數(shù)量和酶活增強(qiáng)后者對(duì)下游靶基因的表達(dá)調(diào)控[77]。SDG725編碼一個(gè)H3K36 甲基轉(zhuǎn)移酶,其功能缺失突變體展現(xiàn)出類似BR 缺陷表型,包括植株矮化、葉傾角減少基小圓粒表型[78]。另一類PcG多梳蛋白也被驗(yàn)證通過H3 甲基化調(diào)控影響胚乳發(fā)育狀態(tài)。兩個(gè)同源基因OsFIE1 和OsFIE2 對(duì)水稻粒寬、稻米品質(zhì)等產(chǎn)生多種影響,特別是OsFIE2 能夠通過影響OsMADS6的H3K27me3 甲基化程度影響水稻花器官發(fā)育過程[24,79]。這些基因表明各類表觀修過調(diào)控與水稻粒重有密切的調(diào)控關(guān)系。
2.6 microRNA 調(diào)控途徑
microRNAs(miRNAs)是一類存在植物體內(nèi)非編碼RNA。經(jīng)過多種miRNA 加工酶加工后,其最終產(chǎn)物能夠靶向結(jié)合某些特定基因序列調(diào)控他們的翻譯起始或者促進(jìn)這些基因降解。miRNA參與許多植物生長(zhǎng)發(fā)育過程調(diào)控,包括生物脅迫及非生物脅迫反應(yīng)、環(huán)境適應(yīng)性及衰老等[80]。OsSPL14(IPA1)編碼一個(gè)SPL 家族轉(zhuǎn)錄因子,是重要的調(diào)控水稻莖稈和粒型的QTL。其受到水稻miR156調(diào)控[81-82]。OsSPL14基因通過結(jié)合水稻株型基因OsTB1和OsDEP1啟動(dòng)子區(qū)分別調(diào)控植物的株型和穗型。過表達(dá)miR156能顯著減少OsSPL14的表達(dá)量而表現(xiàn)出矮化、莖桿變細(xì)及分蘗變少等表型。另外一個(gè)SHORT INTERNODES 1(OsSHI1)編碼一個(gè)含有IGGH 結(jié)構(gòu)域的轉(zhuǎn)錄因子也可以與IPA1 結(jié)合,相互拮抗調(diào)控水稻株型[83]。上述這些基因構(gòu)建了以IPA1為中心的水稻株型和粒型的調(diào)控網(wǎng)絡(luò)。SPL 家族的另外一個(gè)成員OsSPL16編碼一個(gè)正向調(diào)控水稻粒寬的QTL,同樣受到miR156的調(diào)控,同時(shí)其作為轉(zhuǎn)錄因子調(diào)控結(jié)合GL7/GW7 啟動(dòng)子區(qū)促進(jìn)穎殼細(xì)胞伸長(zhǎng)[16,84-85]。OsSPL13是第一個(gè)通過全基因組關(guān)聯(lián)分析(GWAS)找到的調(diào)控水稻粒重和產(chǎn)量的QTL[86]。其3’-UTR 同樣包含一個(gè)miR156的結(jié)合區(qū)域。此外,OsSPL13結(jié)合在Small and Round Seed 5(SRS5)基因的啟動(dòng)子區(qū)調(diào)控穎殼細(xì)胞大小。上述結(jié)果構(gòu)建miR156-OsSPL13/GLW7-SRS5水稻粒型調(diào)控網(wǎng)絡(luò)[17]。OsSPL18可以結(jié)合在OsDEP1啟動(dòng)子區(qū),也受到OsmiR156k的靶向降解,表明一個(gè)新的OsmiR156k-OsSPL18-OsDEP1的調(diào)控網(wǎng)絡(luò)參與水稻粒型建成[87]。OsSPL9 通過直接激活RCN1調(diào)控水稻早期穗粒數(shù)原基發(fā)生[88]。Jiang 等對(duì)水稻的SPL 家族蛋白進(jìn)行總結(jié)和分類,也揭示了另外8個(gè)SPL家族蛋白存在穗部表型[89]。
除了miR156調(diào)控水稻粒型穗型外,其他miRNA 也參與了水稻粒型調(diào)控過程。OsmiR535是OsSPL7/12/16的靶向miRNA,下游對(duì)OsPIN1B、OsDEP1、OsLOG及OsSLR1的表達(dá)量調(diào)控[90]。OsmiR397調(diào)控OsLAC基因影響穗部的粒長(zhǎng)、粒寬和千粒重[91]。OsmiR396通過影響Growth Regulating Factor(GRF)轉(zhuǎn)錄因子的表達(dá)調(diào)控水稻穗粒數(shù)和粒型關(guān)系,建立了OsmiR396-GRF-GIF調(diào)控網(wǎng)絡(luò)[92]。Zhao 等通過應(yīng)用Short Tandem Target Mimic(STTM)方法阻斷OsmiR159與靶基因的相互作用,發(fā)現(xiàn)多個(gè)MYB 結(jié)構(gòu)域基因,如OsGAMYB 和OsGAMYBL1,表達(dá)量明顯上調(diào),進(jìn)而對(duì)水稻株高、葉長(zhǎng)和粒型進(jìn)行調(diào)控[93]。OsmiR530分別靶向OsPIL15和OsPL3正調(diào)控水稻粒型[94]。上述結(jié)果說明,miRNA 通過靶向與水稻粒重相關(guān)基因來影響水稻粒型。
3 結(jié)語(yǔ)與展望
水稻粒型發(fā)育及調(diào)控是一個(gè)復(fù)雜過程,除了受到許多基因參與調(diào)控,環(huán)境因素包括營(yíng)養(yǎng)、田間管理、種植區(qū)域等也有顯著影響。本文綜述總結(jié)了水稻粒重相關(guān)的表觀調(diào)控途徑、轉(zhuǎn)錄水平、蛋白質(zhì)互作等分子調(diào)控過程,與光合作用、蔗糖運(yùn)輸?shù)却x過程及細(xì)胞分裂與分化細(xì)胞學(xué)層面調(diào)控過程。這些基因相互作用,有的形成調(diào)控網(wǎng)絡(luò)發(fā)揮作用,有的仍然不清楚其具體功能。目前多個(gè)證據(jù)表明,水稻不同性狀之間存在微妙的動(dòng)態(tài)平衡[31,48,61]。本文從泛素化途徑、G-蛋白偶聯(lián)途徑、激素調(diào)控途徑、光合作用調(diào)控途徑、表觀調(diào)控途徑和micro-RNA 調(diào)控途徑列舉和整理與水稻粒重相關(guān)的重要QTL 和功能基因。由于合子(胚和胚乳)決定種子大小,在作物馴化過程受到強(qiáng)烈人工選擇以優(yōu)化種子大小與品種有益等位基因組合。不同物種在進(jìn)化過程可能存在相似的調(diào)控機(jī)制[9]。比如擬南芥的DA1基因調(diào)控種子大小,在水稻中也有相似機(jī)制[19];擬南芥MAPK 信號(hào)途徑調(diào)控植物廣譜抗病性分子機(jī)制,然而在水稻中主要在調(diào)控水稻粒型和穗粒數(shù)平衡[61]。此外,對(duì)于多基因調(diào)控網(wǎng)絡(luò)的研究也大大加深我們對(duì)于水稻粒重這一復(fù)雜性狀的分子機(jī)理了解。如OsmiR156k-OsSPL18-OsDEP1、OsmiR396-GRFGIF調(diào)控網(wǎng)絡(luò)等[87,92]。這些信號(hào)調(diào)控網(wǎng)絡(luò)之間的相互影響和調(diào)控關(guān)系需要在未來投入更多的研究,包括多組學(xué)聯(lián)合分析等以便能更加全面構(gòu)筑水稻粒重調(diào)控網(wǎng)絡(luò),為未來實(shí)現(xiàn)真正意義上分子模塊設(shè)計(jì)育種打下堅(jiān)實(shí)理論基礎(chǔ)。
基因編輯技術(shù)經(jīng)過過去十多年的蓬勃發(fā)展,目前已經(jīng)開發(fā)出TALEN 系統(tǒng)、Cas9 系統(tǒng)、Cas12系統(tǒng)以及單堿基編輯器ABE 等[95]。值得注意的是,目前利用啟動(dòng)子編輯微調(diào)基因表達(dá)產(chǎn)生多種不同性狀已有課題組出現(xiàn)相關(guān)報(bào)道。早在2017 年,美國(guó)冷泉港Zachary B.Lippman 課題組就提出利用多個(gè)不同基因家族成員的自然或者人工改良等位基因進(jìn)行花序的改良,達(dá)到從野生番茄向人工番茄快速馴化的目的[96]。揚(yáng)州大學(xué)劉巧泉課題組和華南農(nóng)業(yè)大學(xué)劉耀光課題組分別利用CRISPRCas9技術(shù)對(duì)稻米品質(zhì)基因Waxy基因進(jìn)行啟動(dòng)子、5’-UTR 及內(nèi)含子區(qū)進(jìn)行基因編輯,獲得不同的新等位Waxy基因,改良水稻稻米品質(zhì)[97-98]。最近,李錢鋒課題組等對(duì)水稻Glucan,Water-Dikinase 1(GWD1)基因進(jìn)行啟動(dòng)子編輯獲得其弱突變的遺傳改良材料,能夠?qū)崿F(xiàn)在不改變水稻主要農(nóng)藝性狀的同時(shí)對(duì)水稻稻米透明度和種子萌發(fā)狀態(tài)的改良[99]。除了水稻稻米品質(zhì)改良,對(duì)水稻細(xì)菌性條紋病抗病基因Xa13啟動(dòng)子編輯獲得提高水稻細(xì)條病抗性但是并沒有降低花粉的育種改良材料在以后水稻高產(chǎn)抗病育種過程的應(yīng)用也是一個(gè)很好的例子[100]。這些都預(yù)示著對(duì)水稻粒重相關(guān)基因的啟動(dòng)子編輯具有重要的生物學(xué)和生產(chǎn)實(shí)踐意義。
隨著水稻基因組變異組學(xué)的發(fā)展,更多的不同水稻品種材料在單堿基SNP 差異、序列變異(SV)差異為水稻育種和分子設(shè)計(jì)育種聚合不同優(yōu)良性狀改良提供新的思路[101]。這些在不同品種的水稻序列變異不僅挖掘更多新的有效等位基因,在育種生產(chǎn)上應(yīng)用;另外也可能解決過去QTL 定位出現(xiàn)的問題,新的變異可能隱藏著的新的功能性基因在水稻“四性”的作用值得重視。除了經(jīng)典遺傳學(xué)在水稻育種方面的應(yīng)用,發(fā)展智慧農(nóng)業(yè),物聯(lián)網(wǎng)和農(nóng)村5G 建設(shè)也是推動(dòng)我國(guó)農(nóng)業(yè)高質(zhì)量發(fā)展,鄉(xiāng)村振興的重要舉措。目前,華南地區(qū)以廣東省農(nóng)業(yè)科學(xué)院和地市政府聯(lián)手打造的產(chǎn)學(xué)研結(jié)合基地,農(nóng)村產(chǎn)業(yè)園、大田規(guī)模化種植基地、設(shè)施園藝標(biāo)準(zhǔn)示范基地等也在逐步建設(shè),這將引領(lǐng)農(nóng)業(yè)農(nóng)村現(xiàn)代化在2025 年、2035 年不同時(shí)間取得階段性進(jìn)展。與之相配套的技術(shù)也在不斷開發(fā)。比如,中國(guó)農(nóng)業(yè)科學(xué)院都市農(nóng)業(yè)研究所最近利用6 種矮稈品種結(jié)合定制光譜LED 光源為水稻不同生育期提供最佳光環(huán)境同時(shí)精確調(diào)控各種環(huán)境因素,實(shí)現(xiàn)對(duì)大田環(huán)境120 d 生育期水稻壓縮至60 d,并且實(shí)現(xiàn)相當(dāng)于單產(chǎn)652 kg/667m2巨大應(yīng)用潛力。2007 年研發(fā)出水稻“三控”施肥技術(shù),該技術(shù)是以控肥、控苗、控病蟲為主要內(nèi)容的高效施肥及配套技術(shù)體系,與傳統(tǒng)施肥方法相比,一般減少氮肥20%,水稻增產(chǎn)10%左右,氮肥利用率提高10%以上,有效分蘗增多,無效分蘗減少,病蟲害和倒伏大幅減輕,多年來的成功應(yīng)用使得該技術(shù)已成為廣東省和農(nóng)業(yè)部主推技術(shù)[102-103]。除此之外,利用農(nóng)機(jī)自動(dòng)導(dǎo)航作業(yè)與無人旋耕機(jī)、播種機(jī)、插秧機(jī)、噴霧機(jī)和收獲機(jī)的有機(jī)結(jié)合,華南農(nóng)業(yè)大學(xué)羅錫文院士打造的“無人農(nóng)場(chǎng)”是國(guó)家“智慧農(nóng)業(yè)”示范的典型例子,爭(zhēng)取“無人農(nóng)場(chǎng)”5 年后進(jìn)入推廣階段、10 年后加快推廣速度,完成技術(shù)轉(zhuǎn)化。這些技術(shù)的配套實(shí)施將極大有助于我們國(guó)家水稻生物育種、打造智慧農(nóng)業(yè),打贏種業(yè)翻身仗。

