甲胎蛋白AFP的原核表達、純化及鑒定
王桂玲,冉 皚,吳勝昔,谷志鵬,黃 蕾,龔呂鴻
(重慶理工大學 藥學與生物工程學院, 重慶 400054)
肝細胞癌(hepatocellular carcinoma,HCC)又稱“癌中之王”,是一種常見且致死率極高的惡性腫瘤,在全球惡性腫瘤死亡率中高居第三,嚴重威脅人類的健康和生命[1]。我國每年約39萬人罹患肝癌死亡,數量超過全球肝癌死亡人數的一半。肝癌侵襲力強,經手術切除、肝移植后,患者5年的生存率僅為70%,加上肝癌的預后較差,復發風險較高,因此HCC的早期診斷意義重大[2]。
人甲胎蛋白(alpha-Fetoprotein,AFP)是1個分子量約為70 kDa的糖蛋白,含有591個氨基酸,屬白蛋白家族,源于胚胎內胚層組織細胞,主要由胎兒肝細胞及卵黃囊合成[3]。當胎兒發育至12~16周時,可在胎兒的血液循環中檢測到高達3 g/L的AFP,妊娠30周達到最高峰,之后逐漸下降。胎兒出生2~3月后,隨著干細胞表達下降,體內的AFP轉變為白蛋白且在血清中只能檢測到微量的AFP蛋白,出生后的第二年接近成人水平,正常人血清中AFP的含量會維持在1個較低水平(<20 μg/L)[4-6]。1964年,前蘇聯專家Wong等[7]在肝癌患者血清中首次發現AFP,截至目前,AFP被認為是肝癌診斷的最佳生物標志物。肝癌患者表現出臨床癥狀的前8個月時,血清中AFP的含量已經顯著升高,因此AFP在臨床上廣泛用于原發性肝癌的診斷及療效監測。AFP具有很多重要的生理功能,如運輸功能、免疫抑制、T淋巴細胞誘導凋亡、作為生長調節因子的雙向調節功能等[8]。血清中AFP濃度的異常增高與多種惡性疾病的發展有密切關系,血清中AFP>400 μg/L并持續一個月以上則提示肝癌高風險。AFP可用于評估肝癌的預后性,濃度升高則提示預后不良。此外,AFP還可用于肝癌高危人群的篩查[9],乙型肝炎性或丙型肝炎性、肝硬化患者每6個月進行一次血清AFP的跟蹤隨訪和腹部超聲。目前,肝癌血清標志物AFP的檢測方法主要以抗原抗體發生免疫結合反應為基礎,然而國內生產的AFP檢測試劑的質量不一,國外進口價格昂貴。因此,制備純度高、特異性強、成本較低的AFP蛋白可為肝癌的早期快速檢測提供有效試劑。
1 材料與方法
1.1 菌株與質粒
BL21(DE3)感受態細胞購于上海唯地生物科技有限公司;pET28a(+)質粒載體由重慶理工大學基因工程實驗室贈予;pET28a(+)-AFP質粒、pET28a(+)-AFP/DH5α甘油菌是由蘇州金唯智生物科技有限公司構建。
1.2 主要試劑及儀器
DNA Marker、QuickCut NdeI、QuickCut XholI限制性內切酶購自TaKaRa;小型質粒提取試劑盒購自北京博邁德基因技術有限公司;6×Loading Buffer購自北京金克隆生物技術有限公司;蛋白質分子質量標準購自安諾倫(北京)生物科技有限公司;卡那霉素和IPTG分別購自賽國生物科技有限責任公司和美國Genview公司;5×SDS-PAGE蛋白上樣緩沖液購自biosharp公司;HRP-羊抗小鼠IgG購自美國Proteintech公司;BCA蛋白定量測定試劑盒購自北京鼎國昌盛生物技術有限責任公司;NGC蛋白純化系統購自美國伯樂生命醫學(上海)分公司;Nano-300微量核酸蛋白檢測儀購自上海嘉鵬科技有限公司;Amersham Imager 600超靈敏多功能成像儀購自美國GE公司。
1.3 序列分析與合成
根據GenBank上發布的AFP全基因序列(GenBank登錄號:NM_001134.2),對AFP基因序列分析及大腸桿菌密碼子偏好性優化,在AFP全長基因序列的C-端及N-端各加一組6×His-Tag,以pET28a(+)作為原核表達載體。交由蘇州金唯智公司進行基因構建與合成。
1.4 pET28a(+)-AFP重組質粒的酶切與鑒定
用接種環蘸取少量pET28a(+)-AFP/DH5α甘油菌,劃線接種于LB固體培養基(含有50 μg/mL卡拉霉素),37 ℃培養30 min后倒置培養過夜。次日,挑取單菌落并接種于5 mL的LB液體培養基試管(含50 μg/mL卡拉霉素),37 ℃,180 rpm,振蕩培養12 h,測量菌液的OD600值達0.6~0.8時,利用質粒小量提取試劑盒進行重組質粒的提取。測定pET28a(+)-AFP重組質粒的濃度,確保在下述酶切反應體系中質粒數量可達500~1 000 ng。利用快切酶NdeI、XholI進行雙酶切鑒定,反應體系如表1所示,37 ℃酶切反應30 min。對雙酶切產物進行0.7%瓊脂糖凝膠電泳鑒定,100 V,80 mA,電泳30 min。
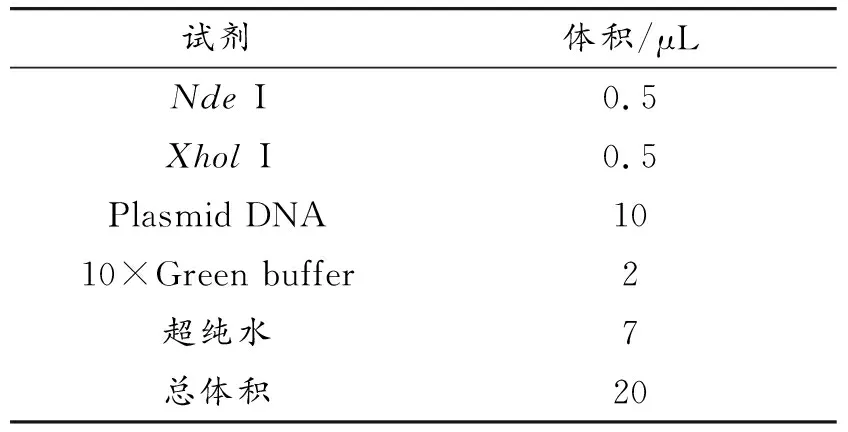
表1 pET28a(+)-AFP的雙酶切體系
1.5 重組質粒的轉化及重組菌的保存
將重組質粒以熱激法轉入大腸桿菌感受態細胞,具體操作參照文獻[10-11]。將轉化成功后的pET28a(+)-AFP/BL21(DE3)進行菌種保存,具體操作步驟如下:挑取平板上大而飽滿的單菌落,接種到5 mL的LB液體培養基,37 ℃,180 r/min恒溫振蕩培養過夜,次日,將試管中的菌液同30%甘油溶液(經高壓滅菌)按1∶1的比例混勻,長期保存于-80 ℃。
1.6 pET28a(+)-AFP/BL21(DE3)重組蛋白的表達與鑒定
按上述步驟對pET28a(+)-AFP/BL21(DE3)重組工程菌進行單菌落培養并接種至5 mL LB液體培養基,待菌液培養至指數生長期,加入適量濃度的IPTG,150 r/min,誘導擴增8 h。對誘導表達的菌液進行超聲破碎,10 000 r/min離心2 min,棄上清,將菌體沉淀用適量的滅菌水重懸,取20 μL沉淀懸液與5 μL 5×SDS上樣緩沖液混勻,100 ℃煮沸變性10 min,進行SDS-PAGE電泳鑒定。空載體按照相同條件處理。
1.7 pET28a(+)-AFP重組蛋白誘導表達條件篩選
pET28a(+)-AFP/BL21(DE3)重組工程菌劃線接種并培養至5 mL試管,37 ℃振蕩培養至菌液的OD600值達0.6~0.8時,將各試管按誘導溫度梯度(16、25、30、37 ℃)、IPTG濃度梯度(0.1、0.3、0.5、0.75、1 mmol/L)及時間梯度(2、4、6、8、10、12 h)進行誘導條件篩選。利用SDS-PAGE電泳對樣品進行鑒定,從而得到AFP重組蛋白大量表達的最佳誘導表條件。
1.8 pET28a(+)-AFP/BL21(DE3)重組工程菌的擴大培養
按照上述步驟擴大培養AFP重組基因工程菌后,根據篩得的最佳誘導條件使菌液大量表達AFP重組蛋白。
1.9 重組蛋白pET28a(+)-AFP包涵體的處理及純化AFP重組蛋白
1.9.1包涵體處理
按上述步驟對pET28a(+)-AFP/BL21(DE3)工程菌進行二次活化,以最佳誘導條件大量表達AFP重組蛋白,10 000 rpm,4 ℃離心10 min后棄上清,向沉淀中加入PBS(1∶30)。10 000 rpm,4 ℃離心10 min后棄上清,向沉淀中加入裂解液(1∶20)和PMSF(1∶100),超聲破菌,14 000 rpm,4 ℃低溫離心15 min后棄上清并收集包涵體沉淀。向沉淀中加入裂解液(1∶30),渦旋至沉淀溶解。14 000 rpm,4 ℃離心15 min后棄上清。向沉淀中加入8M尿素(1∶30),4 ℃低速攪拌15 h。將溶解的產物離心(14 000 rpm,4 ℃離心10 min)并收集上清(包涵體粗提液)。
1.9.2親和層析鎳柱純化AFP重組蛋白
利用NGCTMChromatography System對pET28a(+)-AFP重組蛋白包涵體進行親和層析純化,具體操作步驟見文獻[12]。
1.10 AFP重組蛋白的Western blot鑒定
取20 μL純化后的蛋白樣品與5 μL 5×SDS上樣緩沖液,渦旋儀混勻后置沸水中變性10 min,然后進行SDS-PAGR電泳鑒定。按照Western blot步驟[13]對純化后的蛋白樣品進行特異性鑒定。
1.11 AFP重組蛋白樣品的濃度測定
按照北京鼎國昌盛BCA蛋白濃度測定試劑盒的步驟測定AFP重組蛋白樣品的濃度,具體操作如下:
1) 配制BSA蛋白標準品溶液:用滅菌的雙蒸水稀釋蛋白標準品至0、0.1、0.2、0.4、0.6、0.8、1 mg/mL;
2)稀釋后的蛋白標準品按照10 μL/孔逐次加到96孔板中,加入10 μL待測蛋白樣品,每個樣品做3個平行組;
3) 將試劑盒中A液和B液按照50∶1的比例配制工作液,200 μL/孔,將96孔板置37 ℃恒溫培養箱中孵育30 min;
4) 提前預熱MULTISKAN GO分光光度儀,在562 nm下測得該樣品的OD562值,繪制標準曲線以測定AFP重組蛋白的濃度。
2 實驗結果
2.1 酶切鑒定結果
用限制性核酸內切酶Nde I和Xhol I對重組質粒pET28a(+)-AFP進行雙酶切鑒定,結果如圖1所示,在1 875 bp(目的基因)及5 369 bp(空載體pET28a(+))處均出現了核酸電泳條帶,此結果與預期相符合,證明pET28a(+)-AFP重組質粒構建成功。測序結果表明該克隆序列各連接位點及閱讀框架正確,與預期相符合。
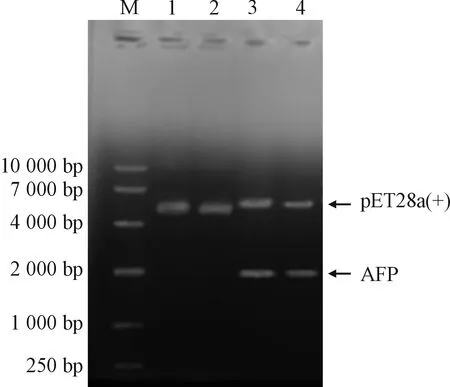
M:DNA分子質量標準;1-2:未酶切質粒;3-4:重組質粒經Nde I、Xhol I雙酶切圖1 重組質粒pET28a(+)-AFP的酶切鑒定
2.2 重組蛋白pET28a(+)-AFP的誘導表達鑒定
挑取5個pET28a(+)-AFP/BL21(DE3)單菌落,以pET28a(+)/BL21(DE3)菌株作對照,在相同條件下(37 ℃,IPTG濃度為1 mmol/L,150 rpm誘導8 h)誘導表達,誘導后的菌液經超聲破碎和離心,用適量的滅菌水對菌體沉淀重懸,SDS-PAGE電泳鑒定結果如圖2所示,5個AFP重組單菌落在經過相同條件誘導后,在75 kDa處均出現誘導表達的蛋白條帶,pET-28a(+)/BL21(DE3)菌株在此處沒有出現相應的蛋白條帶,未誘導對照組只是少量表達,此結果與預期計算的分子量大小一致,說明該重組菌可成功表達AFP重組蛋白。
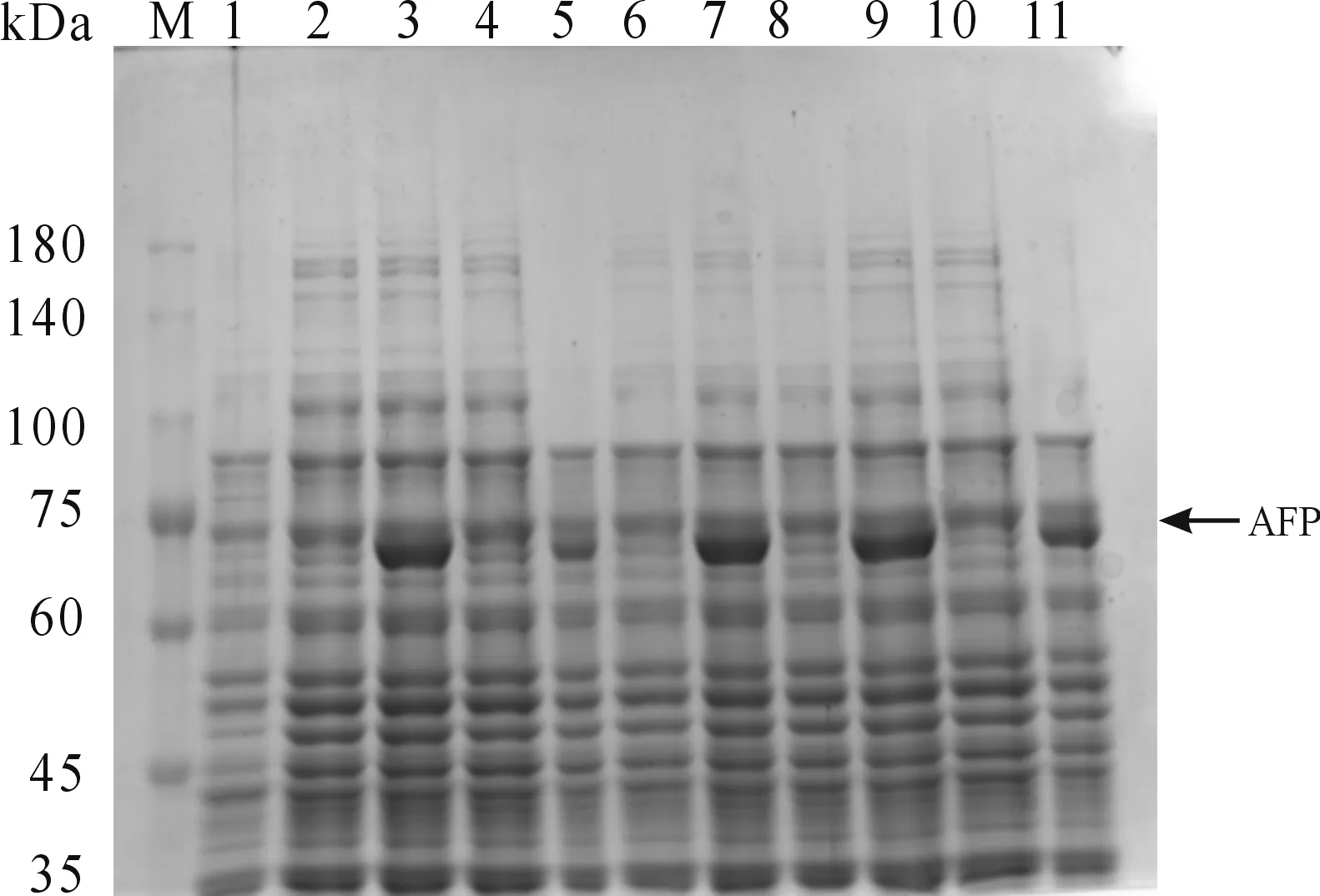
M: 蛋白質分子質量標準;1:pET-28a(+)/BL21(DE3)空白組;2:1號菌誘導前;3:1號菌誘導后4: 2號菌誘導前;5:2號菌誘導后;6:3號菌誘導前;7:3號菌誘導后;8:4號菌誘導前;9:4號菌誘導后;10: 5號菌誘導前;11:5號菌誘導后圖2 AFP重組蛋白的鑒定
2.3 pET28a(+)-AFP重組蛋白的最佳誘導條件的篩選
通過對誘導溫度,誘導劑IPTG濃度,誘導時間的篩選,獲得AFP重組蛋白大量表達的最佳誘導條件:30 ℃,0.1 mM IPTG,誘導8 h。
1) 設定IPTG濃度為1 mmol/L,在4個溫度條件(16、25、30、37 ℃)中,150 r/min振蕩誘導6 h。結果如圖3所示,當誘導溫度為30 ℃,AFP重組蛋白的表達量更高,故選擇30 ℃為AFP重組蛋白的最佳誘導溫度。

M: 蛋白質分子質量標準;1: pET-28a(+)/BL21(DE3)空白組;2: 未誘導對照;3:16 ℃誘導上清;4: 16 ℃誘導沉淀;5: 25 ℃誘導上清;6: 25 ℃誘導沉淀;7: 30 ℃誘導上清;8: 30 ℃誘導沉淀;9: 37 ℃誘導上清;10: 37 ℃誘導沉淀圖3 重組蛋白AFP的最佳誘導溫度篩選結果
2) 當誘導溫度為30℃,設定5個IPTG濃度(0.1、0.3、0.5、0.75、1 mmol/L),150 r/min振蕩誘導6 h。結果如圖4所示,當IPTG濃度為0.1 mmol/L,AFP重組蛋白的表達量更高,故選擇0.1 mmol/L的IPTG為最佳誘導劑濃度。
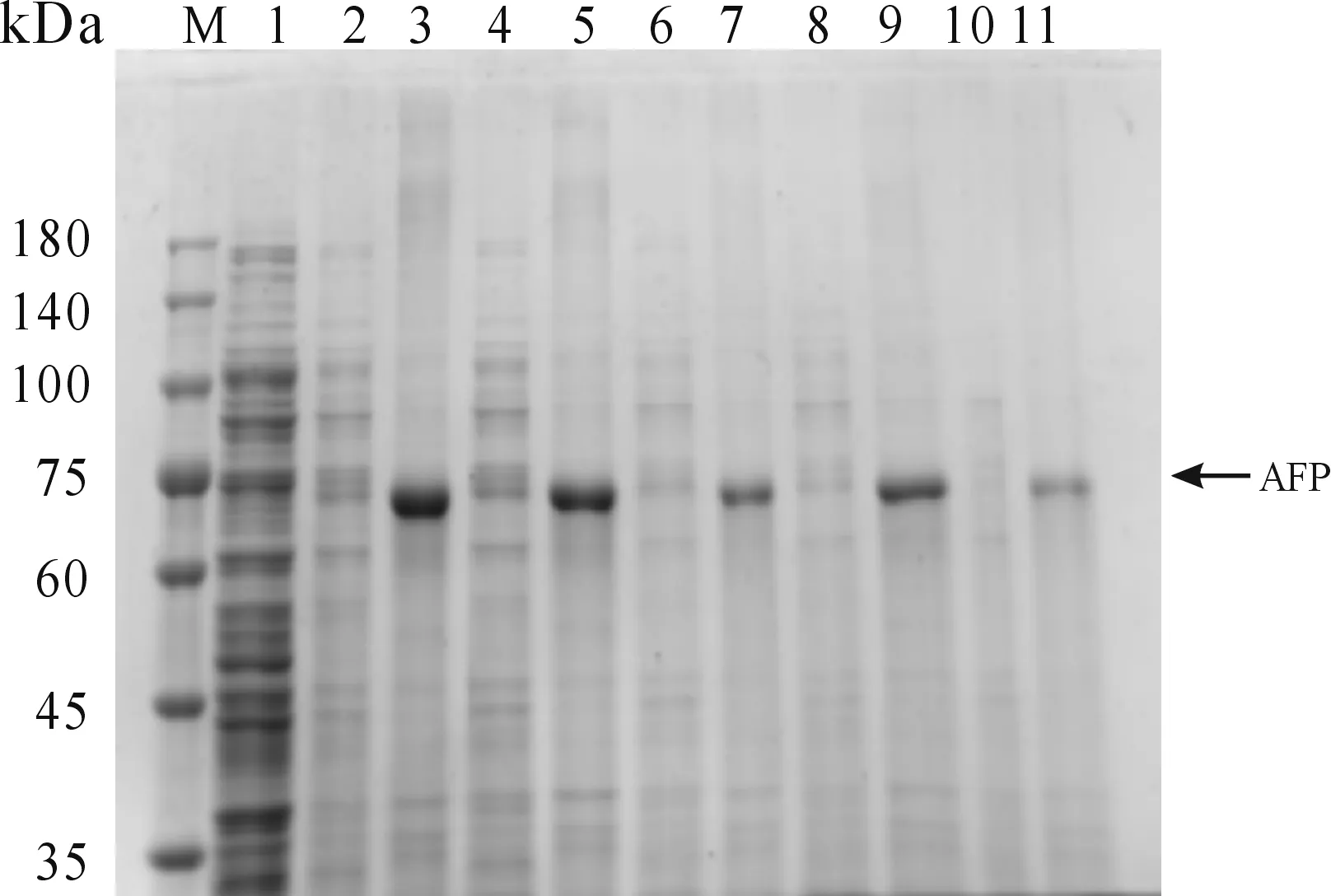
M:蛋白質分子質量標準;1:未誘導對照;2:0.1 mmoL/L誘導上清;3:0.1 mmoL/L誘導沉淀;4:0.3 mmoL/L誘導上清;5: 0.3 mmoL/L誘導沉淀;6:0.5 mmoL/L誘導上清;7:0.5 mmoL/L誘導沉淀;8:0.75 mmoL/L誘導沉淀.9:0.75 mmoL/L誘導沉淀;10:1 mmoL/L誘導上清;11:1 mmoL/L誘導沉淀圖4 重組蛋白AFP最佳誘導劑濃度篩選結果
3) 當誘導溫度為30 ℃,IPTG濃度為0.1 mmol/L時,150 r/min振蕩誘導2、4、6、8、10、12 h。結果如圖5所示,當誘導時間為8 h或10 h時,AFP重組蛋白的表達量較高,綜合確定最佳誘導時間為8 h。
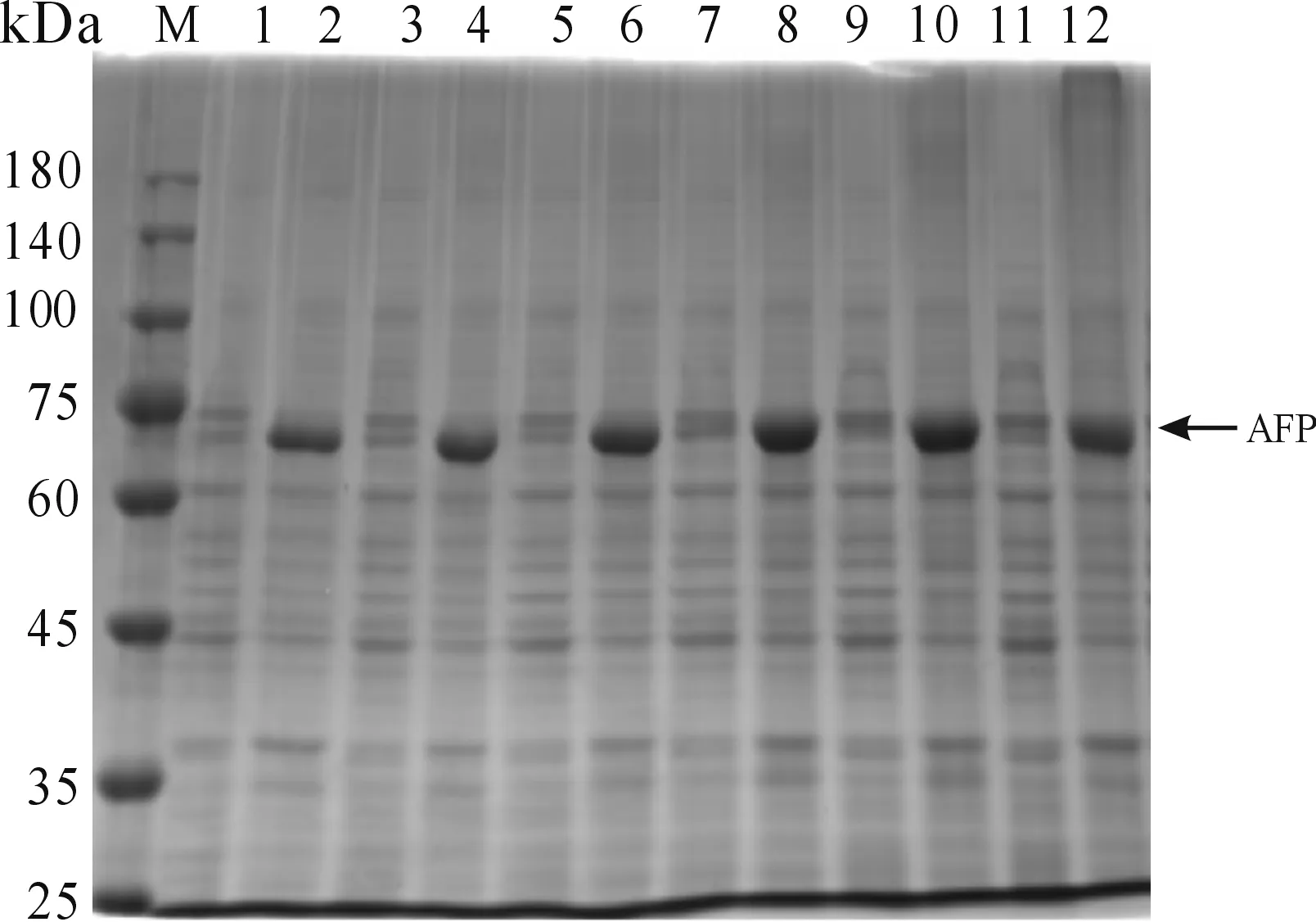
M:蛋白質分子質量標準;1:2h誘導上清;2:2 h誘導沉淀;3:4 h誘導上清;4:4h誘導沉淀;5:6 h誘導上清;6:6 h誘導沉淀;7:8 h誘導上清;8:8 h誘導沉淀9:10 h誘導上清;10:10 h誘導沉淀;11:12 h誘導上清12:12 h誘導沉淀圖5 重組蛋白AFP最佳誘導時間篩選結果
2.4 AFP重組蛋白的純化
按照最佳誘導條件獲得大量表達的AFP重組蛋白后,通過洗滌包涵體、溶解變性、純化及蛋白復性,獲得AFP重組蛋白。如圖6所示,300 mM的咪唑可將AFP目的蛋白完全洗脫。收集280 nm紫外吸收峰下的AFP重組蛋白樣品并進行SDS-PAGE電泳純度鑒定,結果如圖7所示,純化后的AFP重組蛋白分子量與預期相符且純度較高。
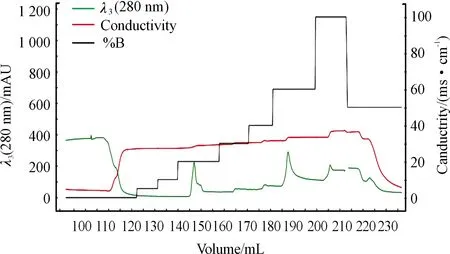
圖6 NGCTM親和層析系統純化AFP重組蛋白圖譜
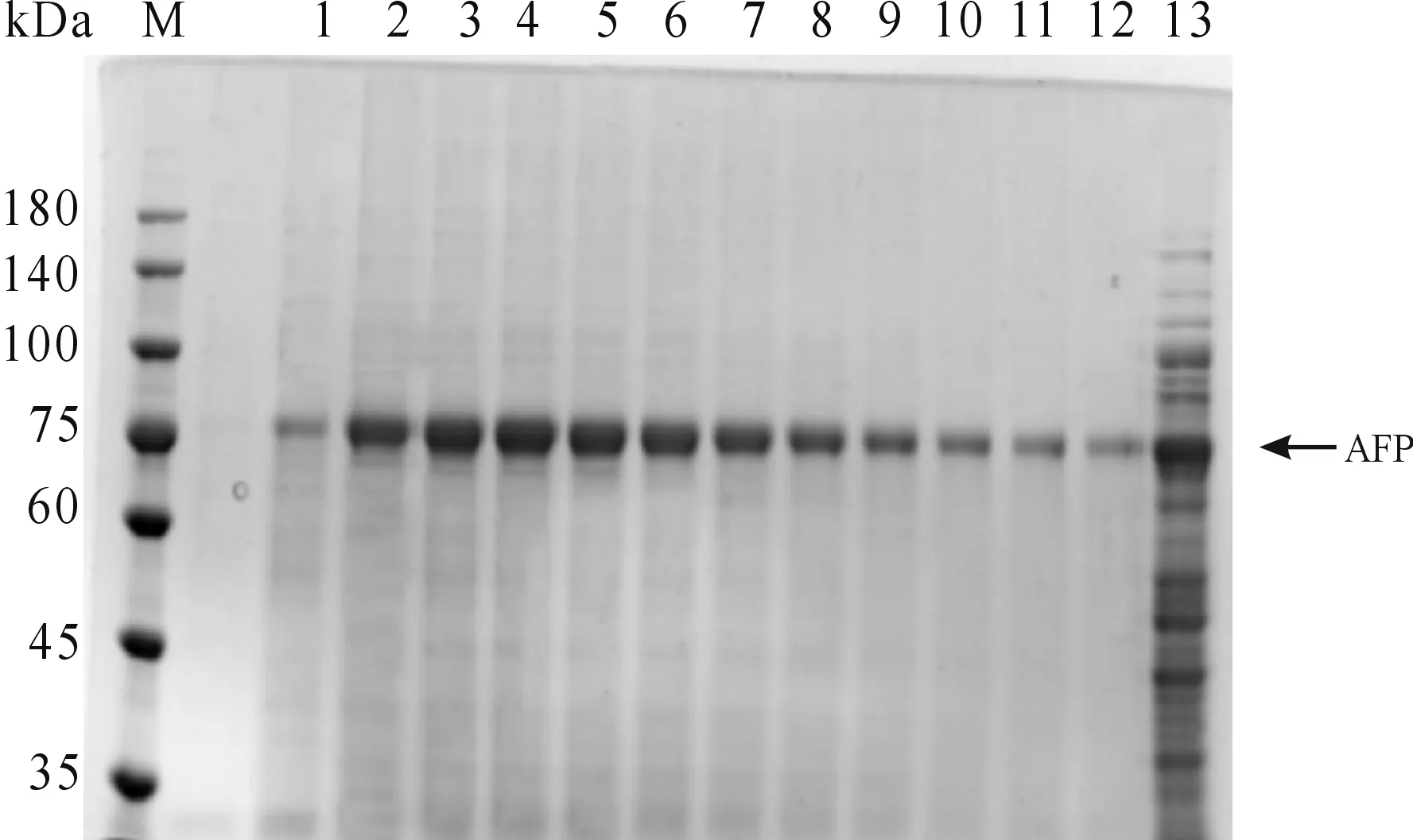
M:蛋白質分子質量標準;1-12:純化后的重組蛋白AFP;13:純化前的樣品圖7 pET28a(+)-AFP重組蛋白純化鑒定
2.5 重組蛋白pET28a(+)-AFP的Western blot鑒定
Western blot結果顯示:實驗組(1-2)在75KD處有明顯的蛋白印跡出現(見圖8),pET28a(+)/BL21(DE3)對照組(3-4)無條帶,表明經Ni柱純化后制得的AFP重組蛋白特異性良好。
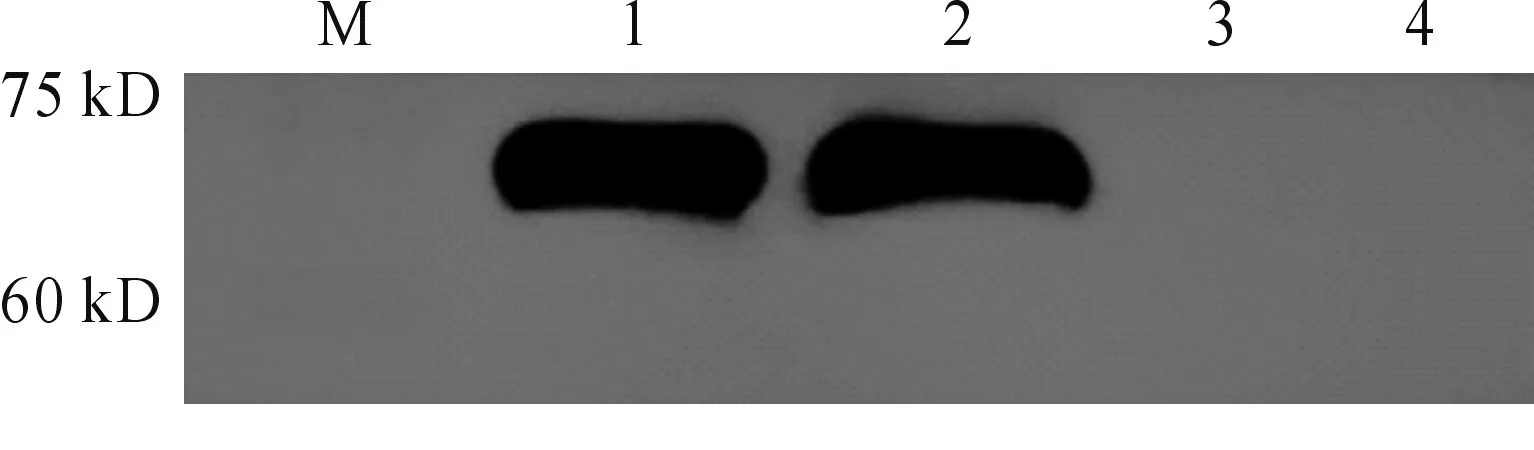
1-2:重組蛋白AFP;3-4:pET-28a(+)/BL21(DE3)空白組圖8 重組蛋白AFP Western blot 鑒定
2.6 重組蛋白AFP的濃度測定
用BCA法測定AFP重組蛋白的濃度,結果如表2所示。標準曲線如圖9所示,其中,回歸方程式:y=1.852 6x-0.238 7,R2=0.999 1,線性關系良好。
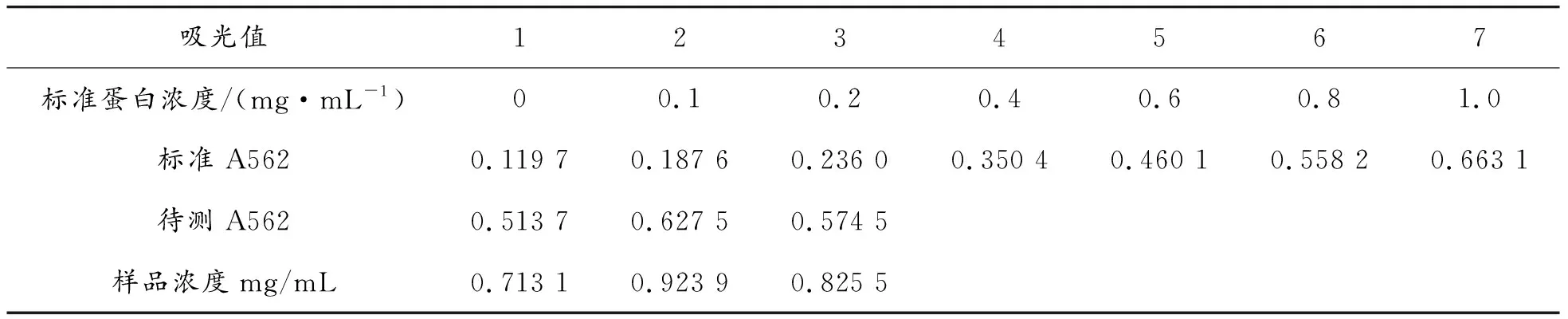
表2 pET28a(+)-AFP濃度測定
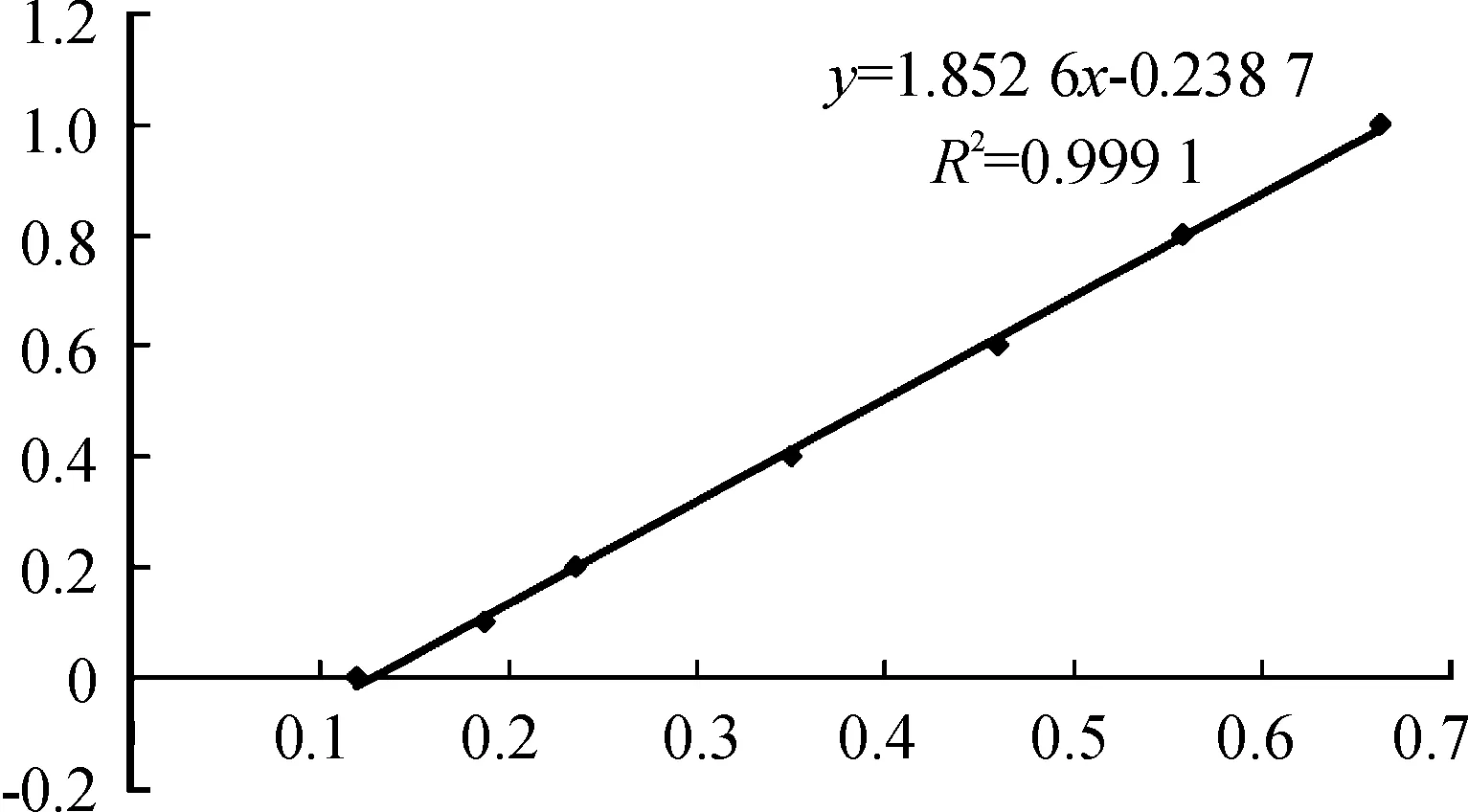
圖9 重組蛋白AFP濃度測定標準曲線
3 結論
1) 大腸桿菌表達系統分子遺傳結構清楚、操作簡單,生長迅速、適于大規模發酵經濟,利用該系統制備AFP重組蛋白具有操作簡單、經濟實用的優勢。
2) 本研究選擇pET28a(+)作為原核表達載體,可使AFP目的基因高效表達。AFP全長基因序列兩端各加的一組6×His-Tag有助于AFP重組蛋白與Ni柱上的金屬離子螯合,從而實現雜蛋白的有效分離。
3) 通過優化AFP重組蛋白的誘導溫度、誘導時間以及誘導劑IPTG濃度,最終確定在30 ℃,0.1 mM的IPTG,誘導8 h的條件下,AFP重組蛋白可大量表達。
4) Ni柱純化的實驗結果證明:目的基因兩端的2組6×His-Tag不僅提高了Ni柱純化的效率,且不會影響AFP蛋白的免疫原性。
5) AFP重組蛋白的Western blot鑒定結果表明:原核表達的AFP重組蛋白與市售AFP單抗可發生強烈的特異性結合。
6) 本研究制得具有良好生物活性且純度較高、特異性強的AFP重組蛋白,為后續制備AFP單克隆抗體以及AFP抗原檢測方法的研究提供了有效試劑。

