通過定向進化技術提高角蛋白酶的熱穩定性研究
傅 巖 張鐵鷹* 孫英霞 李松育
(1.中國農業科學院北京畜牧獸醫研究所,動物營養學國家重點實驗室,北京 100193;2.山西農業大學動物科學學院,太原 030801)
角蛋白結構穩定、疏水性極強[1-2],動物內源蛋白酶難以將其有效降解[3]。家禽屠宰副產物羽毛中粗蛋白質含量在90%以上,若能高效利用可有助于緩解我國蛋白質飼料資源供需矛盾。傳統物理、化學方法處理角蛋白存在諸多不足,產品氨基酸營養品質差,且易產生環境污染[4-5]。目前,已經發掘出多種角蛋白降解菌,包括細菌[6-9]、真菌[10-12]、放線菌等[13-14],這些菌株均可分泌能特異性降解角蛋白的蛋白酶——角蛋白酶。角蛋白酶可水解不溶性角蛋白[15-16],是處理羽毛等角蛋白資源的較優的生物制品[5,17],可用于處理羽毛,提高其營養價值[18-19],或直接用作飼料添加劑[20]。
角蛋白熱穩定性強,可耐受飼料制粒溫度,在高溫條件下可提高其酶促反應速率。本實驗室前期研究發現,地衣芽孢桿菌CP-16角蛋白酶的熱穩定性不佳[15]。因此,改善角蛋白酶熱穩定性,對提高其酶解羽毛角蛋白效率和在畜禽飼糧中應用具有重要意義。目前有關角蛋白酶結構與功能的研究報道較少,大多設計均參考同源性較高的其他類型蛋白酶[21]。易錯PCR無需了解蛋白酶結構功能關系,可快速建立突變體文庫,實現角蛋白酶分子改良[22-23]。因此,本研究擬通過易錯PCR構建角蛋白酶突變體文庫,以期獲得活力高、耐溫性好的角蛋白酶突變體,提高其在飼料工業中的適用性。
1 材料與方法
1.1 主要試劑、質粒和培養基

篩選培養基:脫脂奶粉20 g/L,瓊脂粉15 g/L,高壓滅菌15 min后,加入卡那霉素至終濃度50 μg/mL,制作平板,冷卻備用。
發酵培養基:LB液體培養基(50 μg/mL卡那霉素)。
1.2 角蛋白酶突變文庫的構建
以含角蛋白酶基因的重組質粒pWB980-K-His為模板,使用特異基因的上游、下游引物對角蛋白酶基因進行易錯PCR擴增,使用引物對載體pWB980-K-His進行線性化擴增。

表1 引物序列
參考Zhang等[24]的方法,將純化后的線性化載體和角蛋白酶基因片段進行延長重疊延伸PCR(POE-PCR),以實現質粒多聚化。PCR產物轉入枯草芽孢桿菌(Bacillussubtilis)SCK6感受態細胞,稀釋涂布于牛奶篩選平板。
1.3 突變體初篩與復篩
為同時獲得活性高、熱穩定性好的突變體,挑選水解圈與菌落直徑比值大于野生型的陽性轉化子,搖瓶發酵,檢測粗酶液角蛋白酶活性和熱穩定性,進行復篩。以100目脫脂羽毛粉(0.5%)為底物,測定經70 ℃熱處理5 min后的粗酶液殘留酶活性(以未經處理的粗酶液酶活性為100%)。角蛋白酶活性測定參考王德山[15]的方法。
1.4 野生型和突變型角蛋白酶的純化
以復篩后的正向突變菌株為出發菌,制備粗酶液,經超濾濃縮、鎳柱純化獲得目的蛋白,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)驗證純化后酶蛋白純度及分子質量。
1.5 野生型和突變型角蛋白酶的酶學性質研究
真實底物羽毛粉為不溶底物,為保證數據的精準性,酶學性質測定均使用可溶性蛋白-酪蛋白為底物[15],所有處理均設置3個重復。
分別于不同pH(7.0、8.0、8.5、9.0、9.5、10.0、11.0、12.0、13.0)緩沖液體系,55 ℃,測定野生型和突變型角蛋白酶活性,確定適宜pH。以最高酶活性為100%,繪制酶活性隨pH變化曲線。所用緩沖體系:Tris-HCL緩沖體系(200 mmol/L,pH 7.0~9.0),硼砂-氫氧化鈉緩沖體系(100 mmol/L,pH 9.5~12.0),氯化鉀-氫氧化鈉緩沖體系(pH 13.0)。
在適宜pH和不同反應溫度(40、45、50、55、60、65、70、75 ℃)條件下,測定野生型和突變型角蛋白酶活性,確定適宜反應溫度,最高的酶活性定義為100%,繪制相對酶活性隨反應溫度變化曲線。
純酶液分別在55、65、75、85 ℃下熱處理5 min,適宜條件下測定酶活性,以未經處理的酶活性為100%,計算不同溫度處理后的酶活性殘留率。
配制不同濃度(0.5、0.8、1.0、1.3、1.5、2.0、2.5、5.0、8.0、10.0、12.0 mg/mL)酪蛋白底物溶液,適宜條件下反應10 min,測定酶活性。利用雙倒數法作圖,計算動力學參數。
1.6 野生型和突變型角蛋白酶晶體結構模型構建與分析
運用SWISS-MODEL[24]和Discovery Studio Visualizer 4.0對野生型和突變型角蛋白酶晶體進行同源建模及三維結構分析。
2 結 果
2.1 突變型角蛋白酶初篩與復篩
經易錯PCR成功構建出角蛋白酶突變體文庫(圖1),在牛奶平板挑選水解圈與菌落直徑比值不小于野生型的轉化子共564株進行搖瓶發酵,測定角蛋白酶的熱處理后殘留酶活性,獲得3株正向突變體。由表2可知,角蛋白酶突變體A307V/S346T、R70G、N245K熱處理后殘留酶活性分別為72.12%、86.12%、74.82%,均高于野生型角蛋白酶(50.32%)。
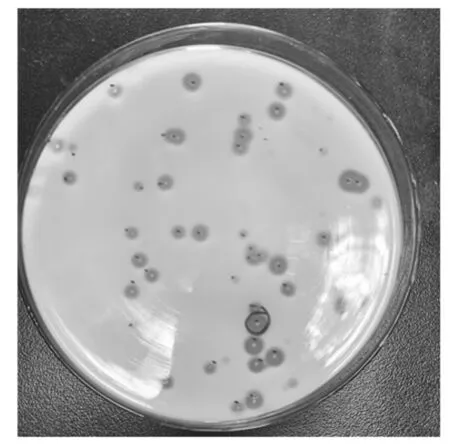
圖1 陽性轉化子在牛奶平板上產生的水解圈
2.2 野生型和突變型角蛋白酶純化后酶蛋白SDS-PAGE分析
野生型和突變型角蛋白酶純化后酶蛋白的SDS-PAGE分析結果見圖2,目的蛋白條帶分子質量與預期一致,單一、無雜帶,可用于下一步分析。
2.3 野生型和突變型角蛋白酶酶學性質分析
經不同pH條件下蛋白酶活性測定分析,野生型角蛋白酶和角蛋白酶突變體A307V/S346T適宜pH為10,角蛋白酶突變體R70G、N245K適宜pH為11(圖3)。這說明突變位點影響了其適宜pH。
不同溫度條件下,角蛋白酶突變體A307V/S346T、R70G、N245K適宜反應溫度相較野生型發生偏移(圖4);同時,角蛋白酶突變體A307V/S346T、R70G、N245K的熱穩定性也相應提升(表3)。這說明突變位點均影響了其適宜反應溫度和熱穩定性。

表2 野生型與突變型角蛋白酶發酵液酶活性及熱處理后殘留酶活性
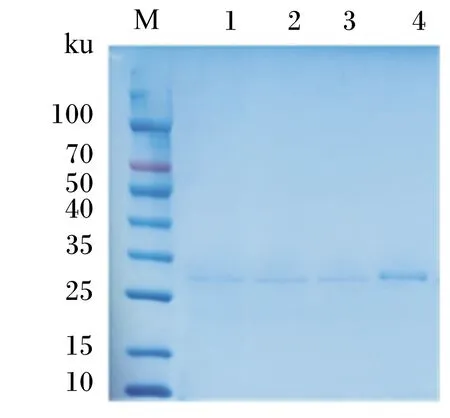
M:中分子質量蛋白 marker;1:野生型 wild-type;2:突變體A307V/S346T mutant A307V/S346T;3:突變體R70G mutant R70G;4:突變體N245K mutant N245K。
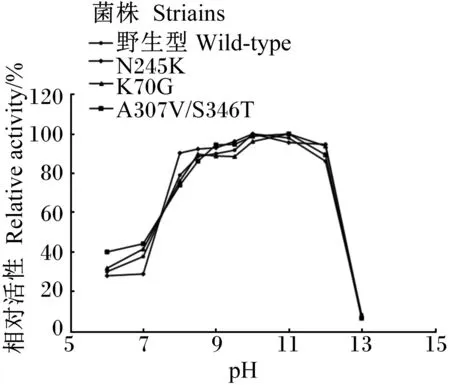
圖3 野生型與突變型角蛋白酶適宜pH
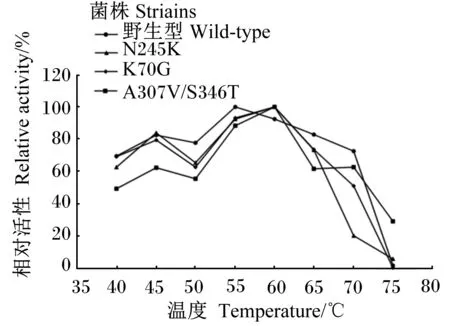
圖4 野生型與突變型角蛋白酶適宜反應溫度
2.4 野生型和突變型角蛋白酶動力學參數
采用雙倒數法作圖計算角蛋白酶動力學參數,與野生型角蛋白酶相比,角蛋白酶突變體A307V/S346T、R70G、N245K對底物的親和力與催化效率均有所提升(表4)。
2.5 野生型和突變型角蛋白酶晶體結構模型構建及分析
角蛋白酶突變體A307V/S346T、N245K的突變位點位于成熟肽區域,直接以成熟肽氨基酸序列建模,以地衣芽孢桿菌的枯草菌溶素(PDB蛋白質數據庫ID:3unxA)為模板得到野生型角蛋白酶和角蛋白酶突變體A307V/S346T、N245K晶體的三維結構模型圖(圖5)。角蛋白酶突變體R70G的突變位點位于前導肽區域,用前導肽與成熟肽氨基酸序列建模,以枯草蛋白酶E(PDB蛋白質數據庫 ID:3whi.1.A)為模板進行同源建模得到野生型角蛋白酶和角蛋白酶突變型R70G前導肽的三維結構模型圖(圖6)。角蛋白酶突變體A307V/S346T、N245K、R70G突變位點分析如圖7所示。據結構模型顯示,3種突變型角蛋白酶突變前后的蛋白質結構均無明顯變化。
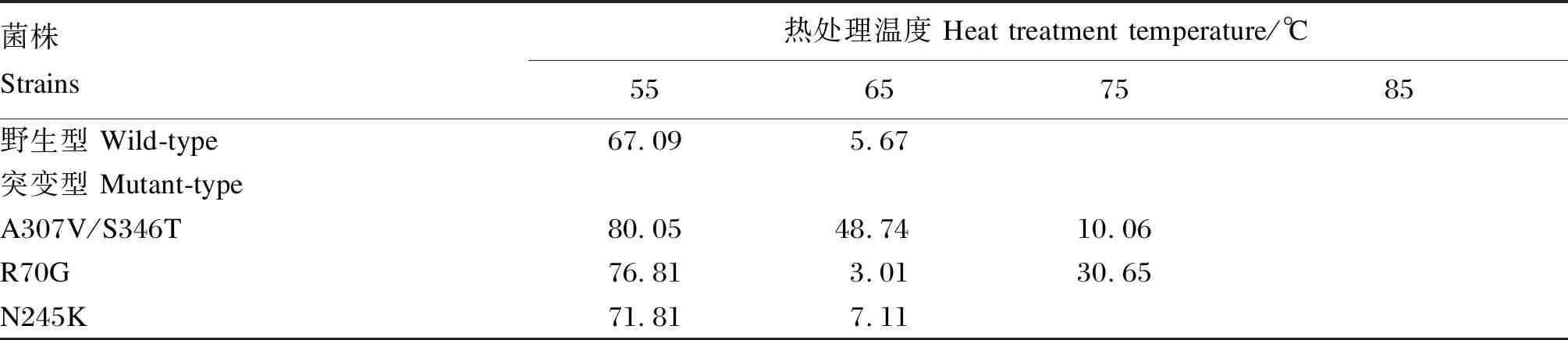
表3 野生型與突變型角蛋白酶5 min熱處理后殘留酶活性
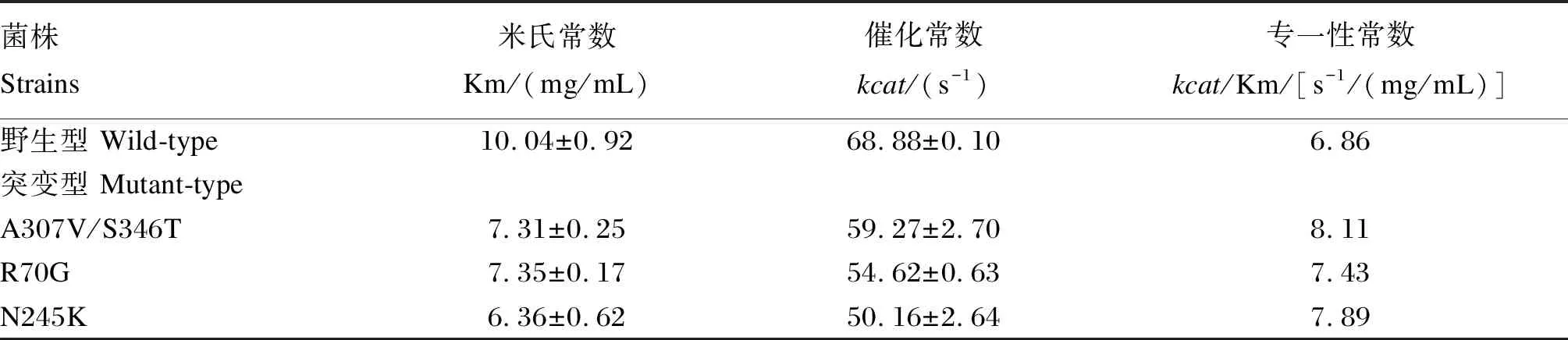
表4 野生型與突變型角蛋白酶動力學參數
3 討 論
本試驗利用易錯PCR方法,對角蛋白酶進行定向進化,獲得了3株耐溫性較好的角蛋白酶突變體A307V/S346T,R70G、N245K,反映出易錯PCR在酶分子改造方面具有較好的便捷性。初篩所選轉化子水解圈均不小于野生型,但角蛋白酶突變體A307V/S346T、R70G的粗酶液角蛋白酶活性為野生型角蛋白酶的89%左右,僅角蛋白酶突變體N245K的發酵液酶活性相對野生型角蛋白酶提升了19.43%,這說明水解圈與發酵酶活性水平間存在不一致性,復篩十分必要。
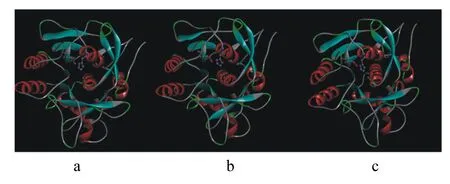
圖5 野生型角蛋白酶(a)和角蛋白酶突變體A307V/S346T(b)、N245K(c)晶體的三維結構模擬示意圖
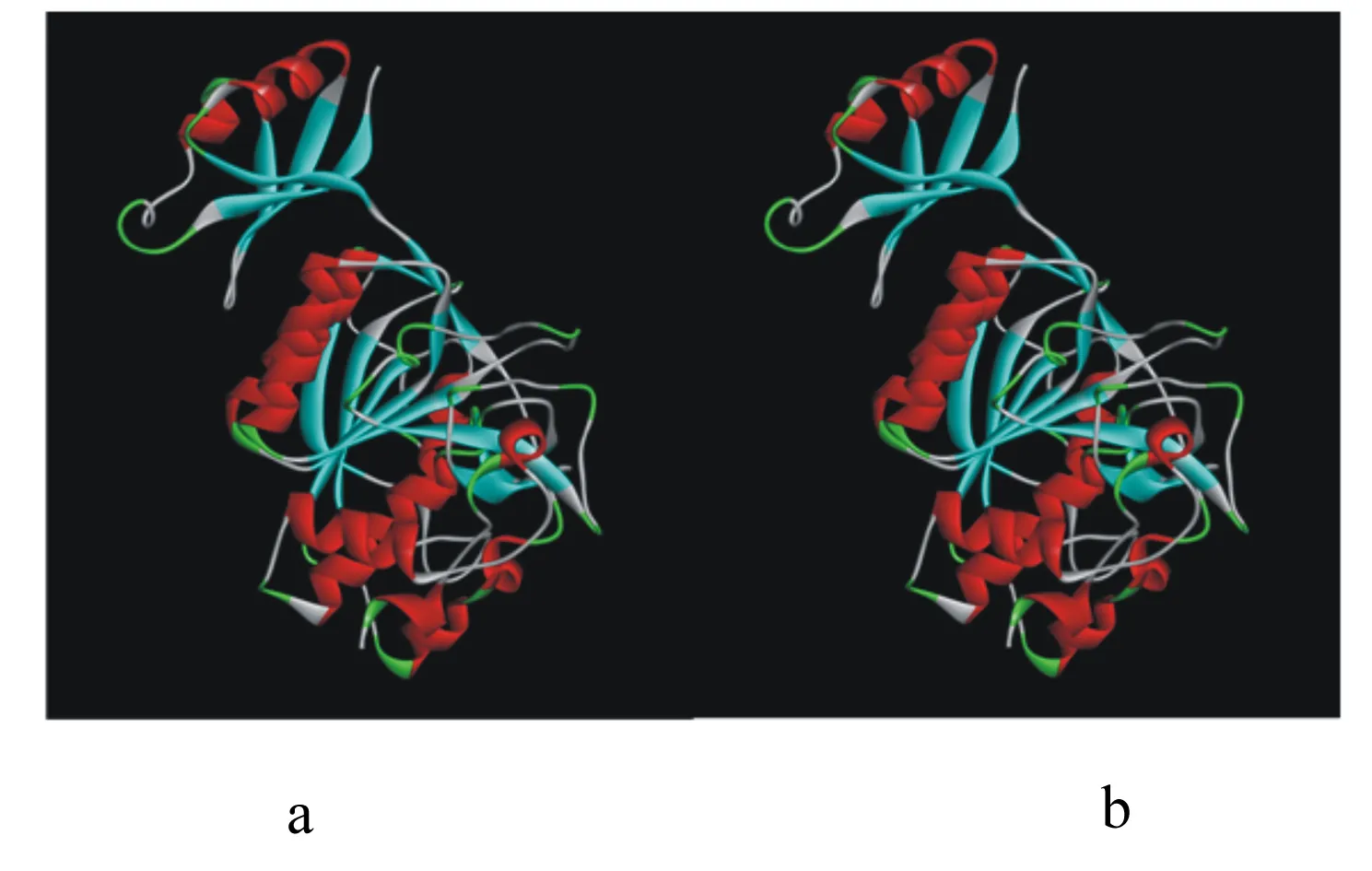
圖6 野生型角蛋白酶(a)和角蛋白酶突變體R70G(b)前導肽的三級結構模擬示意圖
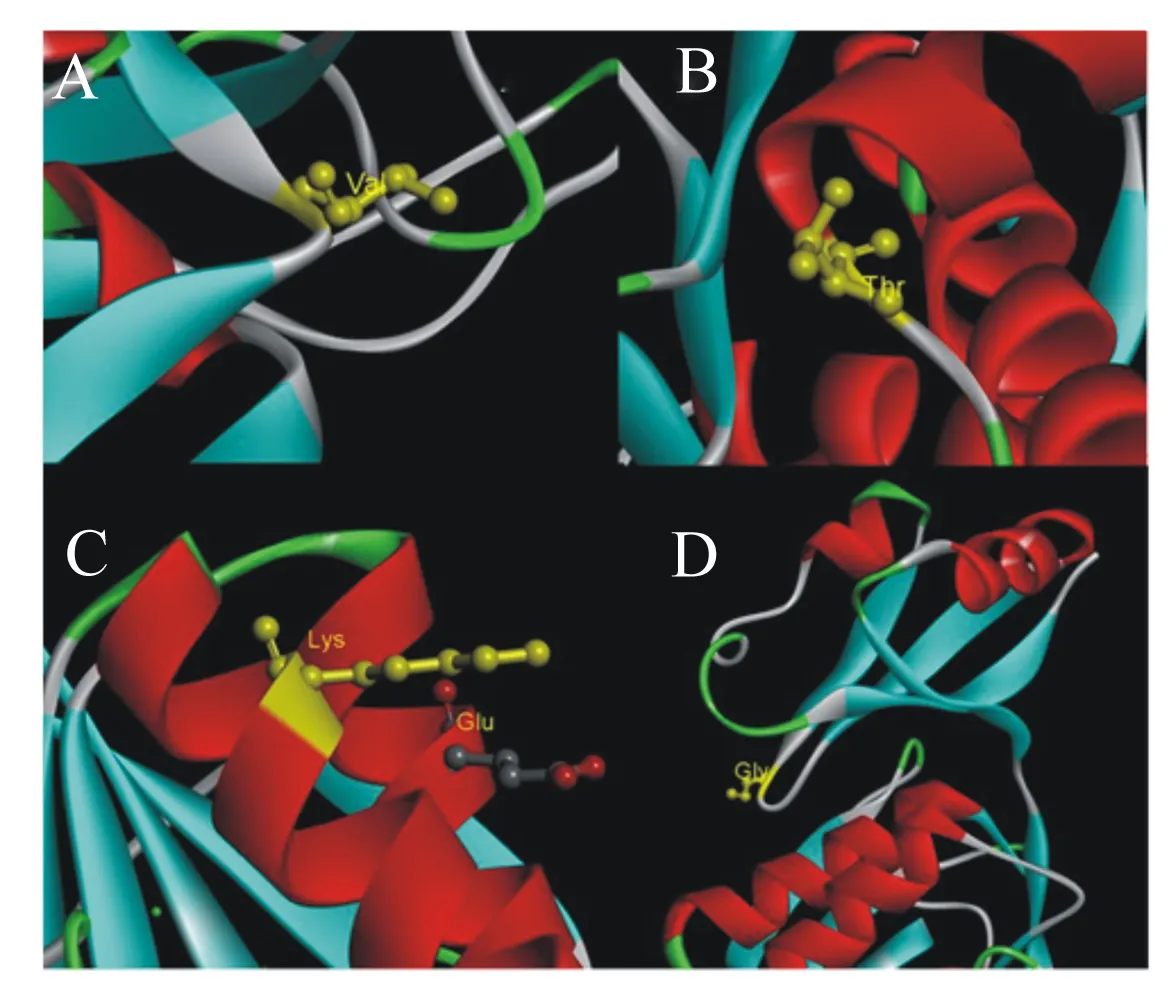
Val:纈氨酸 valine;Thr:蘇氨酸 threonine;Lys:賴氨酸 lysine;Glu:谷氨酸 glutamate;Gly:甘氨酸 glycine。
野生型角蛋白酶與3個突變型角蛋白酶在pH 8~12的緩沖體系中酶活性變化趨勢平穩。角蛋白酶突變體R70G、N245K的適宜pH后移至11,在pH 12表現出比野生型更高的相對活性,在堿性pH寬泛性增加,利于在堿性條件下快速處理羽毛角蛋白,在洗滌與紡織業也有較好利用前景。但在畜禽小腸pH(6.0~7.0)條件下,野生型和突變型角蛋白酶活性均大幅降低,影響其作用發揮,后續研究需進一步通過定向進化、C端截短、結構域重組等分子改造手段提高其pH穩定性[21-22]。
根據純化酶蛋白熱處理后酶活性殘留情況可見,部分突變型角蛋白酶出現75 ℃組活性高于65 ℃組的現象,這可能與在特定條件下出現蛋白酶自溶現象有關[25-26]。與此同時還發現,純酶熱穩定性明顯低于粗酶液,可能是粗酶液中細菌代謝產生的蛋白與角蛋白酶結合暫時形成酶-底物復合物[27],構象相對穩定。以上現象產生的原因與機制尚需進一步深入研究。
本研究共獲得4個角蛋白酶突變位點。角蛋白酶突變體A307V/S346T的307位的丙氨酸(Ala)位于2個β折疊之間的loop區域,Ala的構象不穩定,被替換為纈氨酸(Val)后,構象的穩定性和氨基酸的疏水性均有所增強。疏水作用是蛋白質折疊主要驅動力[28-29],有利于蛋白質三級結構穩定。Val疏水性增強有助于反應區疏水環境的形成,降低結合狀態的自由能,有利于底物與酶的結合,促進催化反應進行,這可能是角蛋白酶突變體A307V/S346T在適宜反應溫度與熱穩定性提升的同時,還保留了較高活性的主要原因。而346位氨基酸絲氨酸(Ser)與蘇氨酸(Thr)的結構功能均較為接近,可能不是影響酶學性質改變的主要突變因素。角蛋白酶突變體N245K的245位氨基酸天冬酰胺(Asn)位于α螺旋,Asn在高溫下易發生脫酰胺作用,不利于蛋白質的熱穩定性,嗜熱蛋白中一般含有較少的Asn和谷氨酰胺[30-32]。同時,已有研究揭示增加蛋白質表面負電荷氨基酸可提高酶穩定性[33],Asn被替換為賴氨酸(Lys)后可能更有利于α螺旋的穩定。Lys在蛋白表面引入負電荷可能通過靜電作用力,形成離子鍵,穩定了蛋白質結構。角蛋白酶突變體R70G的70位氨基酸位于酶前導肽2個β折疊間的loop上,由精氨酸(Arg)變為結構最為簡單的甘氨酸(Gly),側鏈僅有1個氫原子,空間位阻小。空間位阻的改變可能對前導肽結構起優化作用,并進一步影響成熟肽空間結構,從而提升了突變體的熱穩定性。已有研究探明前導肽與脂肪酶的熱穩定性相關[34],但在角蛋白酶的研究中多將前導肽與酶活性進行關聯分析,前導肽與蛋白酶穩定性間的關系尚無相關報道,該研究結果或許可為今后耐熱蛋白酶理性設計提供新的思路。
4 結 論
本試驗通過易錯PCR成功對地衣芽胞桿菌CP-16來源的角蛋白酶進行了定向進化,篩選到熱穩定性提升的角蛋白酶突變體,拓展了角蛋白酶的適用性,并分析了其熱穩性提高的分子基礎,為耐熱蛋白酶理性設計提供新思路。

