致病性大腸桿菌感染小鼠腸炎模型的建立及其分子機制研究
吳 悅 王怡夢 王萌萌 周江濤 劉雪姣 李海花* 喬家運
(1.天津農學院動物科學與動物醫學學院,天津市農業動物繁育與健康養殖重點實驗室,天津 300384;2.天津師范大學生命科學學院,天津市動物多樣性保護與利用重點實驗室,天津 300387)
當前,我國已經實施飼料端全面禁抗,綠色飼料添加劑的研發有利于我國畜禽業的健康可持續發展,然而在評價這些飼料添加劑的功效時,卻面臨著試驗動物疾病模型的缺乏以及疾病模型的不穩定性等問題,因此,建立一個高效的動物疾病模型有著重要深遠的意義。小鼠基因組與人類基因組具有較高的同源性,其生理生化指標及其調控機制與人類和其他哺乳動物相似,亦能通過對比研究獲取人類或其他動物疾病方面的研究成果[1]。腸道是機體最大的免疫器官,對維持機體健康具有極其重要的地位[2]。產腸毒素型大腸桿菌(enterotoxigenicEscherichiacoli,ETEC)是生產中常見的引起畜禽(尤其是幼齡動物)腸炎腹瀉的主要病原菌[3],通過其黏附素黏附于宿主的小腸上皮細胞,在腸內繁殖時釋放腸毒素,對腸上皮細胞產生毒性作用[4],最終引起動物腸炎、腹瀉、脫水甚至死亡[5]。然而,目前關于ETEC引致動物腸炎的分子機制尚不十分清楚,因此,本研究在ETEC感染小鼠腸炎模型成功建立的基礎上,進一步探討該炎癥反應發生的分子機制,能夠為利用此模型評價抗炎飼料添加劑的功效提供可借鑒的檢測指標。
目前,有關ETEC定植后對腸道功能的改變已被廣泛研究。有多項研究表明,ETEC感染小鼠出現炎癥反應,伴有血清中促炎性細胞因子白細胞介素-6(interleukin-6,IL-6)和腫瘤壞死因子-α(tumour necrosis factor-α,TNF-α)含量升高[6-7],且顯著提高腸道內上述關鍵促炎癥反應因子基因的表達水平[8-9],Finamore等[10]報道ETEC通過增加Toll-樣受體4(Toll-like receptor 4,TLR4)和髓樣分化因子88(myeloid differentiation factor88,MyD88)mRNA的相對表達量激活TLR4/核因子-κB(NF-κB)信號通路,然而,也有報道發現ETEC可通過分泌一種熱穩定的蛋白性因子,阻斷正常由腫瘤壞死因子(TNF)、白細胞介素-1β(interleukin-1β,IL-1β)和鞭毛蛋白誘導的NF-κB信號通路[11]。因此,關于ETEC引致炎癥反應的分子機制仍有爭議,還需進一步探索。
Toll樣受體(TLR)是一大類模式識別受體,其中TLR4在識別ETEC感染中具有重要作用[12],與ETEC表面的脂多糖結合后能進一步激活NF-κB,從而調控促炎性細胞因子和C反應蛋白(C-reactive protein,CRP)的生成[13-14]。鑒于目前關于TLR4/NF-κB信號通路在ETEC引發小鼠腸炎中的分子機制尚不十分清楚,以及高效試驗動物腸炎模型的缺乏,因此,本研究利用生產中常見病原菌ETEC來建立小鼠腸炎模型,通過檢測模型小鼠血液炎性指標(如急性反應蛋白、促炎性細胞因子等)的表達,以及小鼠臨床表現、體重和病理組織學的變化等判定腸道炎癥模型構建成功與否,并通過檢測TLR4/NF-κB信號通路上關鍵蛋白的變化規律來深入研究ETEC引致腸炎的分子機制,具有重要的理論意義和實踐意義。
1 材料與方法
1.1 菌株和試驗動物
ETEC菌株由天津農學院動物科學與動物醫學學院實驗室保存;6~8周齡雄性昆明小鼠購買自中國食品藥品檢定研究院。
1.2 主要試劑
小鼠CRP、TNF-α和白細胞介素-8(interleukin-8,IL-8)酶聯免疫吸附測定(ELISA)檢測試劑盒均購自美國BD公司;RNA提取試劑盒、反轉錄試劑盒和實時熒光定量PCR試劑盒均購自美國GeneCpoeia公司。
1.3 試驗設計
將120只SPF級昆明小鼠隨機分為4個組,即對照組、低劑量組、中劑量組和高劑量組,每組30只,每組5個重復,每個重復6只。攻毒前3天,觀察小鼠臨床表現,待小鼠正常后開始進行正式試驗,試驗期為5 d。參照本課題組試驗方法制備攻毒用大腸桿菌菌液[12]。攻毒前,將制備的菌液用生理鹽水稀釋成合適的濃度。分別對低劑量組、中劑量組和高劑量組小鼠經口腔灌服ETEC稀釋液1×105、1×106和1×107CFU/只,對照組口腔灌服等體積的生理鹽水,各組注射劑量均為0.2 mL。
1.4 小鼠臨床觀察和體重稱量
攻毒后,每天觀察小鼠精神、毛色、眼分泌物等,在感染后24、48、72、96和120 h分別稱量每只小鼠體重。
1.5 樣品采集與保存
在小鼠體重稱量后,隨機從各組中選取6只小鼠進行眶下靜脈采血并分離血清,-80 ℃保存備用。解剖小鼠,觀察其腸道、肝臟和脾臟變化,同時采集腸道、肝臟和脾臟樣品,一部分置于-80 ℃保存,用于分析組織中目的蛋白的表達情況,另一部分固定在4%甲醛溶液中,用于分析其組織病理變化。
1.6 血清急性反應蛋白和促炎性細胞因子含量的檢測
采用ELISA方法,嚴格按照廠家產品說明書進行操作,檢測小鼠血清中CRP、TNF-α和IL-8的含量。
1.7 小鼠組織切片觀察
參考文獻[15]方法進行小鼠組織病理學分析,將空腸、肝臟和脾臟樣品進行切片蘇木精-伊紅(HE)染色后,顯微鏡下觀察炎癥細胞浸潤和腸絨毛完整性等病理變化。
1.8 實時熒光定量PCR檢測TLR4/NF-κB信號通路關鍵mRNA相對表達量
根據NCBI數據庫中小鼠TLR4、NF-κBp65、MyD88、B細胞淋巴瘤因子3(recombinant B-cell,BCl3)和內參基因甘油醛-3-磷酸脫氫酶(GAPDH)的mRNA序列,利用Primer Premier 5.0軟件設計引物(表1),并委托生工生物工程(上海)股份有限公司合成。
按照Taco公司的核酸提取試劑盒說明書對小鼠腸道組織進行RNA提取。根據反轉錄試劑盒說明書對RNA進行反轉錄。以反轉錄產物cDNA為模板進行定量分析。按照SYBR Premix Ex TaqTM熒光定量試劑盒操作說明進行實時熒光定量PCR反應體系的配制:上、下游引物各1 μL,all-in-one qPCR Mix(2×)10 μL,cDNA 3 μL,補加焦碳酸二乙酯(DEPC)處理的滅菌水至20 μL。實時熒光定量PCR反應條件:95 ℃預變性10 min;95 ℃變性20 s,56 ℃退火20 s,72 ℃延伸15 s,40個循環;熔解曲線條件為65 ℃ 0.05 s、+0.5 ℃(溫度每升高0.5 ℃檢測1次信號)和95 ℃ 5 s。每個樣品均設置未經逆轉錄的模板作為陰性對照,同時每個樣品均設置相應的內參作為對照,得到各自的熒光閾值循環數(Ct值),采用相對定量法2-ΔΔCt進行計算。

表1 引物序列
1.9 數據統計分析
使用Excel 2016對數據進行初步處理,使用SPSS 26.0軟件進行過多因素方差分析與單因子方差分析(one-way ANOVA)和組間差異顯著性檢驗,以P<0.05為差異顯著,P<0.01為差異極顯著,P>0.05為無顯著差異。另使用GraphPad Prism 5軟件進行圖像制作。
2 結果與分析
2.1 小鼠臨床表現及體重變化
在攻毒48 h后,試驗組小鼠均出現精神沉郁、反應遲鈍、進食量減少等現象,至攻毒后72 h,部分小鼠眼睛出現黃色分泌物、被毛雜亂無光,隨著攻毒時間的延長,至96 h以后,小鼠的精神狀態、行為活動和食欲等逐步恢復正常,且攻毒劑量越高,上述臨床表現變化越明顯。在整個試驗期間,對照組小鼠則被毛光滑、體態活潑、食欲正常。
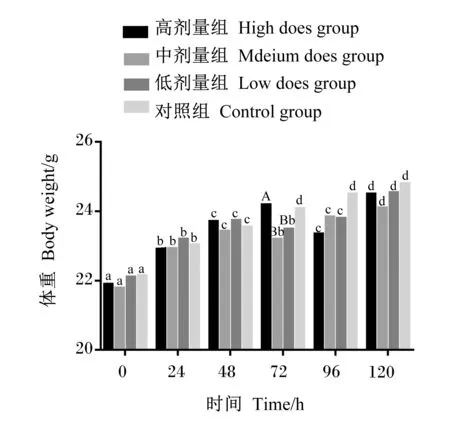
由圖1可知,在ETEC感染后0、24、48、120 h時,各組之間體重無顯著差異(P>0.05);在感染后96 h,高劑量組體重為(23.34±1.18) g,顯著低于對照組(P<0.05);在感染后72 h,中劑量組體重為(23.20±1.02) g,顯著低于對照組(P<0.05)和高劑量組(P<0.01),隨后體重逐步回升至正常水平;低劑量組體重變化與中劑量組基本相似。結果表明,高、中、低3個劑量的ETEC感染小鼠后,均能夠影響小鼠正常生理機能,降低小鼠體重
2.2 血清中急性反應蛋白含量的變化
由圖2可知,與對照組相比,在攻毒后24和120 h,各試驗組血清CRP含量均差異不顯著(P>0.05),在攻毒后48 h,3個試驗組血清CRP含量均極顯著升高(P<0.01),在攻毒后72 h,中劑量組和高劑量組血清CRP含量極顯著升高(P<0.01),攻毒后96 h,高劑量組血清CRP含量極顯著升高(P<0.01)。結果表明,高、中、低3個劑量的ETEC均能引起小鼠產生炎癥反應,且炎癥反應強度與劑量呈正相關,從攻毒后48 h時小鼠開始出現明顯的炎癥反應,到攻毒后96 h時所有試驗組小鼠均炎癥消失。
數據柱標注相同字母表示差異不顯著(P>0.05),不同小寫字母表示差異顯著(P<0.05),不同大寫字母表示差異極顯著(P<0.01)。下圖同。

圖2 血清CRP含量的變化
2.3 血清中促炎性細胞因子含量的變化
由2.2結果可知,3個劑量組均能出現明顯的炎癥反應,且中劑量組炎癥反應較為典型,因而本研究選用中劑量組為研究對象,進一步分析了血清促炎性細胞因子TNF-α和IL-8含量的變化規律。由圖3可知,與對照組相比,在攻毒后24、48和72 h,試驗組血清TNF-α含量極顯著升高(P<0.01),在攻毒后48和72 h,試驗組血清IL-8含量極顯著升高(P<0.01),且在攻毒后48 h試驗組血清TNF-α和IL-8含量最高,攻毒后96 h此2種細胞因子含量恢復至正常水平。結果表明,ETEC感染小鼠血清中促炎性細胞因子TNF-α和IL-8含量從攻毒后24 h開始出現明顯增高,48 h達到高峰,96 h回歸正常水平。
2.4 組織切片觀察
小鼠肝臟、脾臟、空腸病理變化如圖4所示。在攻毒后24 h,試驗組小鼠肝臟(圖4-A)、空腸(圖4-F)中均伴隨淋巴細胞,脾臟(圖4-K)白髓中部分淋巴細胞溶解;在攻毒后48 h,肝臟(圖4-B)出現片狀壞死且肝周隙淋巴細胞大量浸潤,脾臟(圖4-G)部分白髓結構消失,空腸(圖4-L)部分腸隱窩丟失,絨毛間隙不清,固有層潰瘍,病理變化明顯;在攻毒后72、96和120 h,炎癥逐步開始好轉,肝周隙(圖4-C至圖4-E)淋巴細胞減少,脾臟(圖4-H至圖4-J)紅髓、白髓結構清晰、易于分辨,空腸(圖4-M至圖4-O)絨毛受損情況逐漸減輕。其中,以攻毒后48 h的肝臟、脾臟和空腸炎癥反應最為明顯。結果表明,ETEC感染能夠使小鼠肝臟、脾臟和腸道出現炎癥反應,且出現不同程度的病理損傷。
2.5 ETEC對小鼠腸道中TLR4/NF-kB信號通路關鍵因子mRNA相對表達量的影響
由圖5可知,與對照組相比,在ETEC攻毒后48、72、96 h,試驗組腸道TLR4(圖5-A)和NF-κBp65(圖5-D)mRNA相對表達量均極顯著升高(P<0.01),且試驗組攻毒后48 h時的腸道TLR4和NF-κBp65 mRNA相對表達量均顯著高于攻毒后其他時間點(P<0.05);在ETEC攻毒后24、48、72、96和120 h試驗組腸道MyD88(圖5-B)mRNA相對表達量均極顯著升高(P<0.01),且試驗組攻毒后48和72 h的腸道MyD88 mRNA相對表達量均極顯著高于攻毒后其他時間點(P<0.01);在ETEC攻毒后24和120 h試驗組腸道BCl3(圖5-C)mRNA相對表達量分別極顯著或顯著升高(P<0.01或P<0.05),且攻毒后24 h的腸道BCl3 mRNA相對表達量顯著高于攻毒后120 h(P<0.05),攻毒后72h的腸道BCl3mRNA相對表達量極顯著下降(P<0.01)。結果表明,在ETEC誘導的小鼠腸道炎癥反應中,TLR4/NF-κB信號通路很可能發揮著一定的調節作用。

圖3 血清中促炎性細胞因子含量的變化

圖4 組織病理切片觀察

圖5 ETEC對小鼠空腸組織中關鍵因子mRNA相對表達量的影響
3 討 論
CRP是機體應急時產生的一種急性相蛋白,主要在肝細胞中合成,也可通過平滑肌細胞、巨噬細胞、脂肪細胞等合成[16],在防御入侵病原體和炎癥中發揮重要作用,因此臨床上常用CRP的含量作為炎癥性疾病活動性指標[17]。CRP是機體非特異性免疫機制的一部分,它結合C-多糖,在Ca2+存在時可結合細胞膜上磷酸膽堿,可激活補體的經典途徑,增強白細胞的吞噬作用,調節淋巴細胞或單核/巨噬系統功能,促進巨噬細胞組織因子的生成,還可與染色體結合,消除壞死組織里的細胞DNA[18]。本研究發現,血清中CRP含量的變化與小鼠炎癥反應的嚴重程度呈正相關,且炎癥反應最明顯時,小鼠體重也呈明顯下降。這說明小鼠受到感染應激后,其免疫系統被激活,機體內的養分流向和分配可能發生了改變,用于小鼠正常生長的養分被轉而用于支持抵抗ETEC的相關生理過程和生物活性物質(如CRP等)的合成,導致小鼠生長下降,也有可能是疾病小鼠采食下降,養分吸收受限導致其體重下降。在炎癥性腸病(IBD)小鼠中也出現類似的情況,表現為小鼠血清CRP含量顯著增高時體重下降也最為明顯[19]。
促炎性細胞因子是一系列可以促進炎癥的細胞因子的總稱,常見的包括TNF-α、IL-8等。TNF-α可作用于多種細胞,從而激發一系列炎癥反應,使機體釋放大量的IL-6與IL-8[20-21],主要是在感染部位通過促進血管內皮細胞的表達,刺激白細胞介素和趨化因子,誘導白細胞在炎癥部位大量聚集,促使對炎癥部位細菌的清除[22],是治療炎性疾病的藥物作用靶點[13]。馮其麟等[23]研究顯示,抗炎組小鼠血清中TNF-α、IL-6含量顯著低于重癥腹腔感染小鼠,提示炎癥反應減弱。IL-8又稱嗜中性粒細胞因子,是炎癥性疾病的重要介質,在抗感染、免疫反應調節及抗腫瘤方面具有重要作用[24],在代謝性炎癥中有著關鍵的地位[25],研究表明IL-8可有效刺激中性粒細胞向炎癥部位遷移[26],還可促進巨噬細胞浸潤脂肪組織[27],引起局部和全身炎癥。本研究發現,ETEC引致小鼠產生炎癥,且血清中TNF-α、IL-8含量極顯著增多,說明小鼠的先天性免疫系統被ETEC激活,導致促炎性細胞因子過量產生,從而加劇了小鼠的炎性反應。
TLR是參與非特異性免疫的一類重要蛋白質分子,主要激活機體TLR信號通路,引起機體炎癥反應[28]。TLR4是模式識別受體家族成員,在先天免疫中起關鍵作用,可激活促炎癥信號通路,脂多糖作為大腸桿菌的致病因子之一,能夠與細胞膜表面的TLR4結合,可以激活2種不同的細胞內信號通路,包括MyD88依賴通路和MyD88非依賴通路。其中MyD88的激活觸發下游信號級聯反應,導致NF-κβ和絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的激活[13],還可激活上皮細胞釋放大量的細胞因子和炎性介質,加劇炎癥反應和局部組織的炎性損傷[29]。在核因子kappa-B抑制蛋白α(inhibitor of nuclear factor kappa-B kinase α,IκBα)磷酸化后,NF-κB激活并轉位到細胞核,與DNA調控元件如IL-6、IL-8、MCP-1和TNF-α結合激活靶基因,促進炎性細胞因子包括TNF-α、IL-1β、IL-6的轉錄,進一步促進NF-κB的活化,形成局部炎癥擴大的級聯效應[26]。NF-κB是一種與細胞周期調節和炎癥相關的一個轉錄因子家族[30],廣泛存在于各種細胞中,被廣泛認為是通過協調控制炎癥、組織損傷和免疫應答的多種基因的表達來觸發炎癥的產生和消退[31-33],可被多種刺激因子如脂多糖、TNF、IL-1β等激活,誘導促炎性細胞因子(IL-1、IL-6、TNF-α)的大量表達[29]。本試驗檢測了產腸毒素型大腸桿菌感染小鼠后TLR4、NF-κBp65、MyD88 mRNA相對表達量的變化,均隨著炎癥反應劇烈程度的加深而增高,且三者的相對增長幅度極為一致,與CRP、TNF-α、IL-8的含量變化也基本吻合,顯示ETEC感染小鼠后可能是通過TLR4/NF-κB信號通路誘導促炎性細胞因子生成,引起小鼠炎癥反應。
BCl3是IκB家族成員之一,位于細胞核中,能夠與NF-κB作用調節其轉錄功能[12],在近10年的研究中,BCl3被廣泛認為是一種抗炎蛋白[34],在接觸性皮炎[35]、急性炎性肺損傷[36]、急性腎損傷[37]等相關研究中,均發現BCl3蛋白具有抗炎作用。且有大腸桿菌K88致仔豬腸炎的研究發現,BCl3在炎癥反應中發揮著與TLRs信號通路重要負調控因子Tollip相似的負調控作用[12]。盡管也有一些研究表明,BCl3與人類某些炎性疾病的形成相關,在炎癥中的作用可能不是單方面的,到底是抗炎蛋白還是促炎蛋白尚未闡明,但不論是上調或下調BCl3蛋白表達,都會對免疫功能的部分作用產生負面影響[30]。因此,本試驗還檢測了ETEC攻毒小鼠腸道組織中BCl3 mRNA相對表達量,以期能進一步探索BCl3在炎癥反應中發揮的作用。研究發現其表達量隨著炎癥反應程度的加深而降低,且與TLR4、NF-κBp65、MyD88的mRNA相對表達量呈負相關,推測在ETEC誘導的小鼠腸炎中BCl3蛋白可能發揮著抗炎作用。
綜上所述,產腸毒素型大腸桿菌灌服小鼠后,血清中CRP、TNF-α、IL-8的含量升高,且CRP含量隨著灌服菌液濃度的升高而增多,NF-κBp65、TLR4及其信號通路接頭蛋白MyD88 mRNA相對表達量增多,抗炎蛋白BCl3 mRNA相對表達量降低,經感觀、血液學和病理學分析,成功建立了ETEC感染小鼠腸炎模型,并初步證實了該炎癥反應可能與TLR4/NF-κB信號通路有關,并且受到該信號通路關鍵蛋白MyD88的正向調控和BCl3的負向調控。
4 結 論
本研究通過灌服產腸毒素型大腸桿菌成功建立小鼠腸炎模型,同時發現,ETEC感染小鼠后,通過促進TLR4、MyD88和NF-κBp65的mRNA相對表達量,抑制抗炎蛋白BCl3的mRNA相對表達量,從而促進促炎性細胞因子TNF-α和IL-8以及CRP的生成增多,導致小鼠出現腸道炎癥反應。證實了ETEC引致小鼠腸炎與TLR4/NF-κB信號通路的活化相關。

