數字化三維重建技術聯合術中B 超導航在兒童解剖性肝切除手術中的應用研究
劉金橋 陳文娟 尹 強 彭宇明張 杰 彭穎慧 袁文芳
解剖性肝切除手術是目前治療兒童肝臟腫瘤的主要手段,由于兒童肝組織表面光滑,肝段或肝葉之間沒有明顯的解剖學標記,因此手術過程中難以精準定位肝靜脈走向,手術平面難以掌控。 術前不明確腫瘤結構和脈管毗鄰關系,將嚴重影響手術實施,盲目鉗夾、切除可能導致腫瘤殘留、平面偏離以及門靜脈、膽管或肝靜脈的損傷,最終導致嚴重并發癥或腫瘤早期復發[1]。 本研究旨在評價在兒童肝腫瘤治療中,采用術前薄層增強CT 掃描進行數字化三維重建,根據構建的三維圖像結合B 超導航實施解剖性肝切除手術的臨床療效。
材料與方法
一、臨床資料
采用回顧性病例對照研究方法,將湖南省兒童醫院普外科2005 年6 月至2019 年12 月收治的63例肝臟腫瘤患者作為研究對象。 其中聯合數字化三維重建技術行兒童解剖性肝切除手術的41 例患者為觀察組,其中男23 例,女性18 例;年齡3 ~120個月;其余22 例行傳統肝切除手術的患者作為對照組,其中男9 例,女13 例;年齡5 ~48 個月。
病例納入標準: ①無肝臟手術史,無腹部外傷史; ②術前肝功能檢查結果正常; ③為肝內單發病灶、可行手術切除者,或多發病灶集中在某一側三個肝葉、可行手術切除者; ④肝功能Child-Pugh A級,成功行手術治療。 排除標準: ①有嚴重心、腦、肺、腎等器官疾病; ②全肝多發病灶或者有肝外轉移,無法行一期手術治療者; ③腫瘤占據左右三個肝葉,殘余肝葉肝功能無法代償,無法行一期手術治療者。 本研究經湖南省兒童醫院倫理委員會(HCHLL-2020-99)同意,并與患者家屬簽訂知情同意書。
二、研究方法
(一)觀察組手術操作
手術前行肝臟增強CT 薄層掃描,導入數據進行數字三維重建。 CT 掃描范圍從膈頂至髂嵴水平。平掃結束后分別于動脈期、門脈期及平衡期進行掃描,各期掃描延遲時間(從注射開始至掃描的時間)分別為:肝動脈23 ~25 s,門脈期55 ~60 s,平衡期約180 s。 掃描參數:螺距0.6,矩陣512 ×512,重建層厚0. 75 mm,層距0. 5 mm。 掃描條件:管電壓120 kV,管電流240 ~260 mAs。 將掃描圖像傳至計算機工作站,進行數字三維重建,重建部位包括肝動脈、門靜脈和肝靜脈,了解肝臟各血管的走行以及可能存在的變異,評估腫瘤的位置、大小、血供及其與肝臟主要血管的關系;同時設計手術方案,測算剩余肝臟的體積和功能,進行可切除性評估(圖1)。 手術前行經外周靜脈穿刺中心靜脈置管并進行靜脈管道維護,將肝靜脈、門靜脈、肝臟切除方案打印貼于手術室閱片板上。
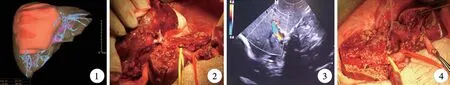
圖1 肝臟三維CT 重建圖像 圖2 顯露右肝前葉肝蒂 圖3 術中B 超監測殘存肝臟血流 圖4 肝中葉切除術后肝斷面Fig.1 3D CT reconstruction image of the liver Fig.2 The exposed Glissonean pedicles of the right hepatic anterior lobe Fig.3 Intraoperative B-ultrasound monitoring of residual hepatic blood flow Fig.4 Liver section after middle lobe hepatectomy
1. 手術切口:手術取右肋緣下弧形切口,體型瘦長者將切口正中心延長至劍突。
2. 術野顯露:結扎切斷肝圓韌帶,離斷鐮狀韌帶,將左右三角韌帶游離,鉗夾肝圓韌帶,以便向兩側或頭側牽拉。
3. 游離膽囊:于膽囊底部將膽囊游離,膽囊三角區域結扎膽囊動脈,顯露膽囊管,辨清膽囊管匯入膽總管位置。
4. Glisson 蒂懸吊:將文氏孔套通后進行套帶懸吊,將肝十二指腸韌帶血管吊帶懸吊,將肝門板下移,利用鞘外分離技術連通左右肝蒂,向左、向右分別置入血管吊帶;沿門靜脈右支水平線顯露右前葉肝蒂Glisson 鞘,顯露困難情況下可利用超聲刀切開部分肝實質,置入右前肝蒂阻斷帶。 將右肝前葉Glisson 鞘套帶后,反向進行右肝后葉Glisson 鞘的套通和懸吊。
5. B 超導航:采用B 超監測門靜脈左支、右支和三支肝靜脈直徑及血流,于肝臟表面標記左右肝靜脈走行,詳細評估肝靜脈屬支走行與數字三維重建圖像的吻合情況。
6. 標記肝實質缺血線:門靜脈矢狀部右側分離結扎Ⅳa、Ⅳb 段Glisson 蒂,結扎右前肝蒂阻斷帶,顯示肝右后葉、右前葉、左外葉和左內葉的兩側缺血線后并標記,術中采用超聲再次評估腫瘤的邊界、左右肝靜脈走行及是否與缺血線吻合。
7. 肝中葉切除:首先處理左側肝切除平面,結扎左肝內葉Glisson 蒂后,沿電刀標記線離斷肝實質,采用(15 +5)min 模式阻斷法,采用超聲刀切開肝表面1 cm 肝組織,肝斷面使用雙極電凝進行止血,小靜脈屬支則直接凝斷,稍大靜脈采用4-0 四線結扎。 于第二肝門處再次通過B 超導航確認肝左靜脈匯入下腔靜脈位置,確認安全后夾閉離斷肝中靜脈主干,5-0 Prolene 線縫合關閉。 處理右側肝斷面:松開左肝蒂阻斷帶,阻斷右前葉肝蒂,尋找肝右靜脈主干,B 超監測肝右靜脈位置保證其不偏離切除平面,尋找到肝右靜脈后,緊貼其左側向頭側推進,用夾肝鉗小口咬合,夾碎肝組織,顯露肝內結構。 于第二肝門處通過B 超導航確認肝右靜脈位置后,于第一肝門處離斷右前葉肝蒂,斷端使用4-0 prolene 線縫扎,移除肝中葉標本(圖2)。
8. B 超監測肝血流:B 超監測門靜脈左右支、肝右靜脈和肝左靜脈的血流及直徑情況(圖3)。
9. 膽漏監測:經膽囊置入自制膽道測試鈍性針頭,絲線固定后用輸液器緩慢滴注稀釋美藍,結合干紗布檢測兩側肝斷面是否有藍色液體溢出,主膽管溢出處用6-0 Prolene 線修補縫合,斷面膽管溢出處用5-0 Prolene 線修補縫合(圖4)。
(二)對照組手術操作
兒童肝臟切除手術前行增強CT 和B 超檢查,根據影像學檢查估計剩余肝臟體積大小,結合肝功能Child-Pugh 分級,決定能否行手術切除。 手術時直接行肝腫瘤切除,肉眼下于距離腫瘤邊緣超過1 cm 處切除肝臟病變,斷面用可吸收線縫扎。
三、統計學分析
詳細記錄肝門阻斷時間、手術時間、術中出血量。 術后第1 天、第3 天、第7 天監測肝功能和凝血功能。 記錄患者術后并發癥和住院時間。 術后定期復診、隨訪。 所有資料采用Excel 軟件建立數據庫后,應用Graphpad prism 7. 0 進行統計學分析。計量資料采用均數加減標準差(±s)表示,組間比較采用兩獨立樣本t 檢驗,計量資料采用卡方檢驗,P <0.05 為差異有統計學意義。
結 果
一、兩組圍手術期情況對比
觀察組41 例患者完成術前數字三維重建圖像、肝臟儲備功能檢測。 術前采用數字三維重建技術聯合術中B 超導航,行解剖性右半肝切除13 例,左半肝切除9 例,左肝外葉+左肝內葉+右肝前葉切除4 例,左肝三葉切除3 例,左肝外葉切除4 例,肝中葉切除2 例,肝Ⅶ段切除2 例,保留肝右后下靜脈的肝Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅶ、Ⅷ段切除1 例,肝Ⅶ+Ⅷ段切除1 例,肝Ⅳ段切除1 例,肝Ⅱ段切除1 例。 對照組22 例中,肝左外葉切除6 例,腫瘤局部肝切除14例,左半肝切除2 例。
與對照組相比,觀察組出血量顯著減少(t =2.207,P =0. 0311),術后肝臟功能恢復快(t =2.347,P =0. 024),住院時間短(t =2. 483,P =0.0158),并發癥發生率低(χ2=7.178,P =0.0074),手術時間相對延長(t =3.781,P =0.004)。 見表1。
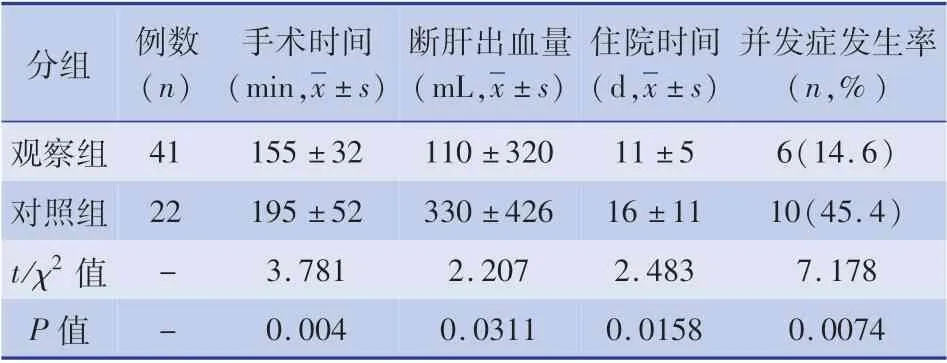
表1 兩組手術時間、術中出血量、住院時間及并發癥比較Table 1 Comparison of operation time,intraoperative blood loss,hospital stay,and complications between the two groups
二、兩組肝功能及凝血功能比較
兩組患者手術后谷草轉氨酶(aspartate aminotransferase,AST)、總蛋白(Total Protein,TP)、白蛋白(albumin,ALB)和活化部分凝血活酶時間( activated partial thromboplastin time,APTT)指標均有明顯變化,然后迅速恢復正常。 觀察組術后第1、3、7天AST 降低明顯快于對照組,術后第1、3、7 天APTT 時間延長明顯少于對照組。 見表2。
表2 兩組術前,術后1、3、7 天TBIL、AST、APTT、ALB 比較(±s)Table 2 Comparison of TBIL,AST,APTT and ALB between the two groups before surgery and 1,3 and 7 days after surgery(±s)
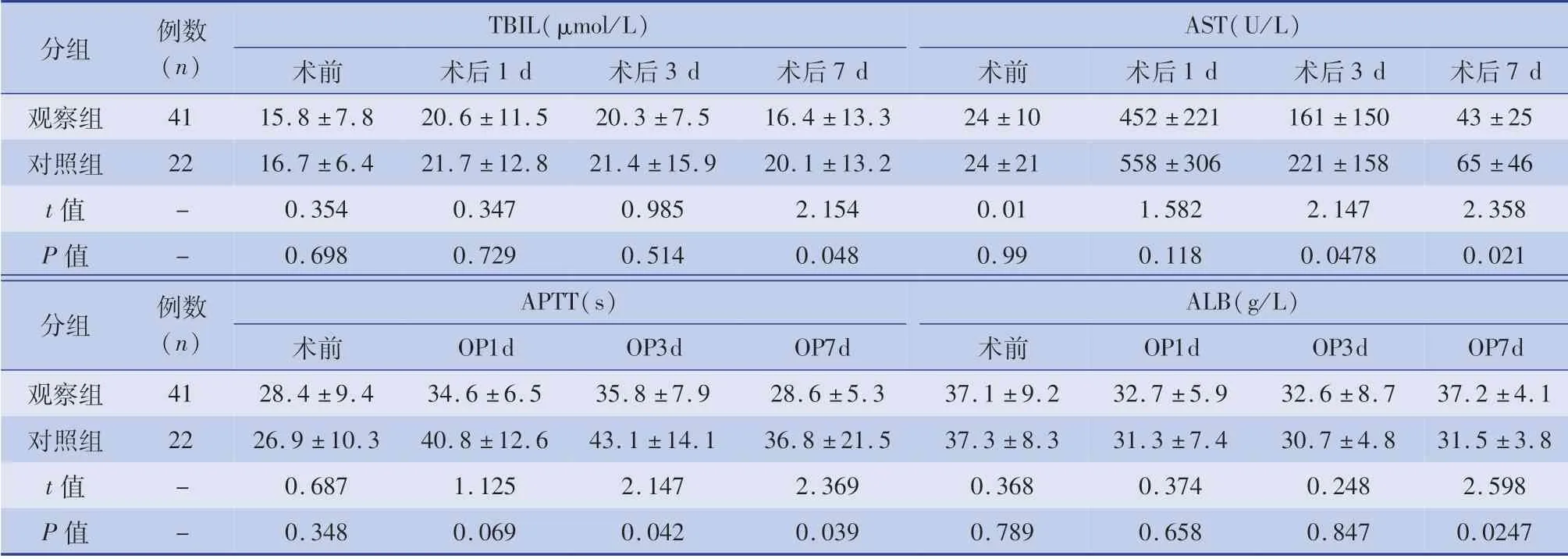
表2 兩組術前,術后1、3、7 天TBIL、AST、APTT、ALB 比較(±s)Table 2 Comparison of TBIL,AST,APTT and ALB between the two groups before surgery and 1,3 and 7 days after surgery(±s)
分組例數(n)TBIL(μmol/L)AST(U/L)術前術后1 d 術后3 d 術后7 d 術前術后1 d 術后3 d 術后7 d觀察組41 15.8 ±7.8 20.6 ±11.5 20.3 ±7.5 16.4 ±13.3 24 ±10 452 ±221 161 ±150 43 ±25對照組22 16.7 ±6.4 21.7 ±12.8 21.4 ±15.9 20.1 ±13.2 24 ±21 558 ±306 221 ±158 65 ±46 t 值-0.354 0.347 0.985 2.154 0.01 1.582 2.147 2.358 P 值-0.698 0.729 0.514 0.048 0.99 0.118 0.0478 0.021分組例數(n)APTT(s)ALB(g/L)術前OP1d OP3d OP7d 術前OP1d OP3d OP7d觀察組41 28.4 ±9.4 34.6 ±6.5 35.8 ±7.9 28.6 ±5.3 37.1 ±9.2 32.7 ±5.9 32.6 ±8.7 37.2 ±4.1對照組22 26.9 ±10.3 40.8 ±12.6 43.1 ±14.1 36.8 ±21.5 37.3 ±8.3 31.3 ±7.4 30.7 ±4.8 31.5 ±3.8 t 值-0.687 1.125 2.147 2.369 0.368 0.374 0.248 2.598 P 值-0.348 0.069 0.042 0.039 0.789 0.658 0.847 0.0247
三、隨訪
觀察組獲隨訪38 例,復發3 例;對照組獲隨訪15 例,復發6 例。 兩組復發率差異有統計學意義(χ2=7.863,P =0.005)。
討 論
肝臟血管和膽道的解剖結構復雜,重要血管包括肝靜脈、門靜脈、肝動脈,可通過B 超、CT 及MRI觀察其內部結構。 當腫瘤位于某些聯合肝段之間時,血管往往被推擠或侵犯,手術中對其辨認和定位存在一定困難[2]。 在肝臟手術中,能否很好控制中心靜脈壓直接影響到手術能否成功,切除肝臟后剩余肝臟充足而暢通的血液回流對患者預后非常重要。 肝動脈的變異并不罕見,常見的易變異動脈包括從腸系膜上動脈發出肝右動脈,以及從胃左動脈發出左肝動脈[3]。 隨著計算機3D 數字化三維重建技術、B 超引導技術以及兒童肝切除手術技術的快速發展,兒童肝切除手術逐漸由傳統經驗外科模式向精準肝切除模式轉變,即以患者的最佳預后為目標,最大化去除病灶,最大限度減少全身性創傷和術中出血,確保剩余肝臟解剖結構和功能的完整,使患者最大程度受益[4]。 在薄層CT 掃描數據的基礎上建立的三維圖像重建,能夠動態顯示肝臟血管、膽管系統走行以及病灶分布[5,6]。
通過術前三維圖像中肝內脈管走行,結合腫瘤與血管的空間位置關系,手術前選擇切除范圍,設計手術入路,選擇合理、安全的手術方式,術中利用超聲引導肝靜脈的走形平面,構建術者腦海中Glisson 鞘的三維結構,個體化指導手術,這一方式在徹底清除目標病灶的同時,可最大限度地實現解剖性肝切除,保證剩余肝臟的血管和膽道解剖結構完整,同時保證殘肝功能體積最大化,最大限度減少出血[7]。 肝臟的術前三維圖像為肝臟手術提供了很好的指引作用,但肝臟是人體最大的實質性器官,具有豐富的血管系統和復雜的生理生化功能。在肝臟內部,各肝葉段之間缺乏明確的解剖界線,管道走行變異較大,如果沒有B 超的實時指引平面,在肝組織離斷過程中容易產生偏離,引起殘留或誤切肝靜脈,導致目標病灶切除不徹底或周圍肝組織過多切除,影響殘肝回流[8-12]。
利用薄層CT 掃描數據三維重建后生成的3D圖像,能夠準確測算標準肝臟體積和剩余肝臟體積,結合肝功能評估肝臟儲備功能,選擇治療方式,有效預防肝功能失代償甚至肝功能衰竭等并發癥的發生[13];三維圖像可以讓術者從不同角度多方位觀察肝臟解剖結構,了解肝臟內血管和膽道的走向和變異、Glisson 鞘的空間構象及擬切除肝段的血管分布情況,評估手術切除的可能性,設計手術入路和方案,保證在完整切除肝臟病灶的同時,剩余肝臟血管結構完整。 術中超聲的即時監測,能夠提供肝靜脈的體表投影和Glisson 鞘的走行,與術前的三維圖像相結合,可以使術者精確把握解剖性肝切除的平面。 術中超聲還可測量第一肝門和主肝靜脈、下腔靜脈之間的距離,避免在術中損傷重要血管[14]。
本研究結果證實,數字化三維重建技術聯合術中B 超導航技術對于兒童肝腫瘤,可實現準確的術前評估、3D 打印肝臟模型指導手術、設計最優化的手術方案,可以準確定位術中微小腫瘤及脈管,使嬰幼兒復雜肝腫瘤解剖性肝切除手術更加安全、精準、有效。

