香蕉果實MaNPC1基因原核表達及多克隆抗體制備
帥良 殷菲朧 廖玲燕 劉云芬 段振華 李麗
摘要:【目的】對香蕉果實非特異性磷脂酶C基因(MaNPC1)開放閱讀框(ORF)進行原核表達,并制備其多克隆抗體,為深入探究MaNPC1在香蕉果實抵御炭疽病中的作用機制提供理論依據。【方法】克隆MaNPC1基因ORF序列,對其進行生物信息學分析及抗原性預測,并通過雙酶切法構建其原核表達載體,利用熱激法轉入大腸桿菌Rosetta 2(DE3)感受態細胞中進行誘導表達,重組蛋白經Ni-NTA樹脂層析柱純化后免疫新西蘭兔,以制備多克隆抗體。同時,運用Western blotting和實時熒光定量PCR分別檢測香蕉果實貯藏過程中在炭疽病侵染脅迫下MaNPC1蛋白表達水平及MaNPC1基因相對表達量。【結果】重組質粒pGEX-6p-3-MaNPC1經雙酶切后得到1650 bp的特異性條帶,說明原核表達載體構建成功,將其轉入大腸桿菌Rosetta 2(DE3)感受態細胞后成功表達。MaNPC1蛋白分子式為C2747H4249N769O793S10,分子量為61.06 kD,理論等電點(pI)為8.96;丙氨酸、纈氨酸、亮氨酸和絲氨酸含量較高,分別占氨基酸總數的8.7%、8.2%、7.8%和7.7%;不穩定指數為47.14,表明其為不穩定蛋白;蛋白抗原區段豐富且親水性氨基酸數目明顯高于疏水性氨基酸,有利于后續抗體的制備。制備的多克隆抗體效價較高,為1∶2048000。Western blotting檢測發現,香蕉果實貯藏過程中MaNPC1蛋白表達水平呈上升—下降—上升的變化趨勢;炭疽病侵染組MaNPC1蛋白除貯藏15 d時的表達水平比對照組低外,其他貯藏時間均略高于對照組。實時熒光定量PCR檢測結果表明,MaNPC1基因相對表達量在香蕉果實貯藏過程中呈逐漸上升趨勢;貯藏3~15 d,炭疽病侵染組MaNPC1基因相對表達量均顯著高于對照組(P<0.05)。【結論】炭疽病侵染能提高MaNPC1蛋白表達水平,故推測MaNPC1蛋白參與香蕉果實抵抗炭疽病侵染。
關鍵詞: 香蕉;MaNPC1基因;原核表達;多克隆抗體;炭疽病;貯藏
中圖分類號: S668.103.6? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2021)07-1753-09
Prokaryotic expression of banana MaNPC1 gene and preparation of its polyclonal antibody
SHUAI Liang1,2, YIN Fei-long1, LIAO Ling-yan1, LIU Yun-fen1, DUAN Zhen-hua1,
LI Li2, HE Xue-mei2, LI Chang-bao2, SUN Jian2*
(1School of Food and Biological Engineering,Hezhou University/Institute of Food Science and Engineering Technology,Hezhou, Guangxi? 542899, China; 2Institute of Agro-products Processing Science and Technology, Guangxi Academy of Agricultural Sciences/Guangxi Key Open Laboratory of Crop Genetic Improvement Biotechnology/Guangxi Key Experiment of Storage and Processing New Technology for Fruits and Vegetables Laboratory
Cultivation Base, Nanning? 530007, China)
Abstract:【Objective】Prokaryotic expression of the open reading frame(ORF) of banana fruit non-specific phospholipase C gene(MaNPC1) and preparation of its polyclonal antibody were conducted, to provide theoretical basis for in-depth exploration of the mechanism of MaNPC1 in banana fruit resistance to anthracnose. 【Method】The ORF sequence of MaNPC1 gene was cloned, bioinformatics analysis and antigenicity prediction were carried out, and its prokaryotic expression vector was constructed by double enzyme digestion method, and the heat shock method was used to transfer it into Escherichia coli Rosetta 2(DE3) competent cell for induction expression, and the recombinant protein was purified by Ni-NTA resin chromatography column to immunize New Zealand rabbits to prepare polyclonal antibodies. At the same time, Western blotting and real-time fluorescent quantitative PCR were used to detect the MaNPC1 protein expression level and the relative expression level of MaNPC1 gene under the stress of anthracnose infection during banana fruit sto-rage. 【Result】The pGEX-6p-3-MaNPC1 recombinant plasmid was double-enzyme digested to obtain a specific band of 1650 bp, indicating that the prokaryotic expression vector was successfully constructed and transferred to E. coli Rosetta 2 (DE3) competent cell for successful expression. The molecular formula of MaNPC1 protein was C2747H4249N769O793S10, the molecular weight was 61.06 kD, and the theoretical isoelectric point(pI) was 8.96; the contents of alanine, valine, leucine and serine were high, accounting for 8.7%, 8.2%, 7.8% and 7.7% of the total number of amino acids, respectively; the instability index was 47.14, indicating that it was an unstable protein. The protein antigen segment was rich and the number of hydrophilic amino acids was? higher than that of hydrophobic amino acids, which was easy for subsequent antibody preparation. The prepared polyclonal antibody had a higher titer of 1:2048000. Western blotting analysis showed that the MaNPC1 protein expression level of banana fruits showed an upward-decreasing-increasing trend during storage. The MaNPC1 protein expression level of the anthracnose infection group was lower than that of the control group when stored for 15 d, and the other storage time was slightly higher than the control group. Real-time fluorescent quantitative PCR detection showed that the relative expression of MaNPC1 gene showed a gradual upward trend during storage of banana fruits; after storage for 3 to 15 d, the relative expression of MaNPC1 gene in the anthracnose infection group was significantly higher than that in the control group(P<0.05). 【Conclusion】Anthracnose infection can increase the expression level of MaNPC1 protein, indicating that MaNPC1 protein participates in banana fruit resistance to anthracnose infection.
Key words: banana; MaNPC1 gene; prokaryotic expression; polyclonal antibodies; anthracnose; storage
Foundation item:National Natural Science Foundation of China(31660589); Guangxi Natural Science Foundation (2018GXNSFBA281118,2019GXNSFAA185027); The Basic Ability Enhancement Project for Young and Middle-aged Teachers of Guangxi(2020KY18020)
0 引言
【研究意義】香蕉為芭蕉科(Musaceae)芭蕉屬(Musa)單子葉植物,是生長于熱帶亞熱帶地區的一種重要經濟作物和糧食作物,也是全球鮮銷量最大的水果(Huang et al.,2014;王芳等,2016)。自2011年起我國香蕉產量躍居世界第二,并呈逐年增長趨勢,香蕉產業已成為我國熱帶地區的重要支柱產業之一(王芳等,2016)。香蕉為典型的呼吸躍變型水果,同時又是冷敏性水果,在采收和運輸過程中,冷害、病害及機械傷害等造成的損失相當嚴重(Huang et al.,2012;Ketsa et al.,2013;王海波等,2018)。我國的香蕉采后損耗率高達50%左右,遠高于果蔬采后的平均損耗率25%(謝建華和龐杰,2010)。非特異性磷脂酶C(Non-specific PLC,NPC)能水解磷脂酸膽堿和磷脂酰乙醇胺生成二酰基甘油(DAG),在采后果蔬貯藏過程中發揮重要作用,尤其是在植物逆境脅迫及脫落酸、油菜素內酯等激素信號傳導途徑中發揮重要的調節作用(帥良等,2019)。因此,原核表達香蕉NPC1基因(MaNPC1),并制備其多克隆抗體,運用Western blotting探究香蕉果實貯藏過程中MaNPC1基因表達量變化,對探究香蕉果實中NPC的生物學功能及作用機制具有重要意義。【前人研究進展】至今,已從水稻(Chrastil and Parrish,1987)、擬南芥(Peters et al.,2010)、谷子(胡利芹等,2015)、陸地棉(Song et al.,2017)等植物中克隆出NPC基因。早期研究并未發現植物NPC為植物磷脂酶家族成員,后期經過多序列比對和結構域預測才得以證實(Nakamura and Awai,2005)。NPC分泌蛋白具有典型的磷脂酶活性,且具有磷脂酶特有的磷酸酯酶結構域,但不含其他植物脂質信號轉導蛋白特有的XY和PX等結構域,一般由510~540個氨基酸殘基組成。多數植物的NPC分泌蛋白N端具有一個信號肽,信號肽后面有一段高度保守序列和一個短的可變區域,其中,高度保守序列位于磷酸酯酶域前方(帥良等,2019)。Krcková等(2015)在大腸桿菌重組表達擬南芥NPC,并進行體外活性檢測,結果發現NPC1、NPC2、NPC3、NPC4和NPC5均具有磷脂酶活性,但NPC6不具有磷脂酶活性。與植物中的其他脂質信號轉導蛋白不同,NPC活性不受Ca2+的影響,但易受Triton X-100、EGTA、NP-40和Al3+等的影響,其中,NP-40作為表面活性抑制劑,能抑制NPC活性,且抑制程度與其濃度在一定范圍成正比(Reddy et al.,2010);Al3+則通過阻礙NPC與細胞膜的結合進而抑制NPC活性(Pejchar and Martinec,2015)。大量研究結果顯示,在長期經受生物脅迫(Albrecht and Bowman,2008)、非生物脅迫(Peters et al.,2014)和激素處理(Rinukshi et al.,2010)下,植物的NPC活性及其基因表達均會發生改變,表明NPC參與植物對環境和生物刺激的各種代謝反應。此外,NPC參與了生物脅迫特別是病原菌造成的病害脅迫響應。如在甜橙感染黃龍病后,與擬南芥AtNPC5基因同源的甜橙CsNPC基因表達量較對照(無黃龍病脅迫)增加了5倍(Albrecht and Bowman,2008);使用來自細菌的激發子flgg22和Hprz處理擬南芥,結果發現擬南芥中AtNPC1和AtNPC4基因表達量有所改變(帥良等,2019)。【本研究的切入點】目前,已有大量應用各種載體在不同表達系統成功表達重組蛋白,并以其免疫動物制備抗體的研究報道,但未見針對香蕉NPC的相關研究報道。【擬解決的關鍵問題】克隆MaNPC1基因開放閱讀框(ORF),對其進行生物信息學分析及抗原性預測,并通過雙酶切法構建其原核表達載體,利用熱激法轉入大腸桿菌Rosetta 2(DE3)感受態細胞中進行誘導表達,重組蛋白經Ni-NTA樹脂層析柱純化后免疫兔子,以制備多克隆抗體;同時運用Western blotting和實時熒光定量PCR分別檢測香蕉果實貯藏過程中MaNPC1蛋白表達水平及MaNPC1基因相對表達量,為揭示MaNPC1在香蕉果實抵御炭疽病中的作用機制提供理論依據。
1 材料與方法
1. 1 試驗材料
供試香蕉品種寶島蕉(M. acuminata L. AAA Cavendish‘Formosana)由廣西農業良種海南南繁育種基地提供,采收成熟度為七八成熟,挑選果形端正、無機械傷和病蟲害的香蕉為試材,落梳后立即運回實驗室,適當降溫后,清水清洗晾干,選擇大小相近、成熟度相同,且未受感染和生理損傷的香蕉果實,隨機分成試驗組和對照組。香蕉炭疽病菌分生孢子懸液(106個孢子/mL)由廣西農業科學院微生物研究所提供;質粒DNA提取試劑盒和PCR產物純化試劑盒均購自愛思進(Axygen)生物技術有限公司;引物合成及測序委托生工生物工程 (上海) 股份有限公司完成。
1. 2 試驗方法
1. 2. 1 樣品處理 對剛采摘的果實進行人工噴霧接種香蕉炭疽病菌分生孢子懸液(106個孢子/mL),以噴霧蒸餾水作對照組。處理后用0.03 mm厚聚乙烯薄膜袋包裝,置于20 ℃下貯藏,觀察炭疽病發生情況。接種前取一次果實用于MaNPC1基因克隆。接種后每3 d取樣一次,每次從6個果實上取樣,設3次重復,樣品經液氮速凍后置于-80 ℃超低溫冰箱凍藏,用于檢測香蕉果實貯藏過程中MaNPC1蛋白表達水平及MaNPC1基因相對表達量。
1. 2. 2 MaNPC1基因ORF克隆 基于課題組前期克隆的香蕉MaNPC1基因全長序列2090 bp(GenBank登錄號LOC103995036),利用ORF Pinder查找其ORF,通過Prime Premier 5.0設計ORF特異性擴增引物(MaNPC1-F1:5'-GAACCCGGGTGATGGATT CGGGGGTCCAG-3',劃線處為SmaⅠ酶切位點;Ma-NPC1-R1:5'-CTTCGCGGCCGCTTATCAAATGCTT TGGACGGA-3',劃線處為Not Ⅰ酶切位點)。以cDNA為模板進行PCR擴增,反應體系25.0 μL:cDNA模板2.0 μL,2×PCR Buffer for KOD FX 12.5 μL,上、下游引物各1.0 μL,RNase-free H2O補足至25.0 μL。擴增程序:95 ℃預變性3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,進行30個循環;72 ℃延伸5 min,4 ℃終止。
1. 2. 3 生物信息學分析及抗原性預測 參考帥良等(2020)的方法進行MaNPC1蛋白結構分析及抗原性預測。采用ExPASy中的ProtScale進行蛋白親/疏水性預測;采用TMHMM server v.2.0進行跨膜區預測;使用SignalP 5.0預測蛋白信號肽;通過在線網站(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/);使用PredictProtein對蛋白二級結構進行預測;使用Protean中的Jameson-Wolf方法對香蕉MaNPC1蛋白抗原指數進行預測分析。
1. 2. 4 原核表達載體構建 參考劉云芬(2016)的方法構建原核表達載體。具體步驟:以Sma Ⅰ和Not Ⅰ雙酶切pGEX-6p-3-GST質粒載體和MaNPC1基因ORF,通過T4 DNA連接酶將二者連接后獲得重組質粒pGEX-6p-3-GST-MaNPC1,利用熱激法將其轉入大腸桿菌Rosetta 2(DE3)感受態細胞中,篩選出陽性重組菌株,經PCR擴增及電泳檢測驗證后送至生工生物工程(上海)股份有限公司測序。將測序結果與參考序列進行比對分析。
1. 2. 5 蛋白表達及可溶性分析 參考陳偉等(2019)的方法進行MaNPC1蛋白表達及可溶性分析。具體步驟:重組菌株振蕩培養約2.5 h(OD600達0.6~0.8)后加入終濃度為0.5 mmol/L的IPTG,分別誘導表達3和6 h,以未加入IPTG為對照組;離心收集菌體后進行超聲波破碎,使用1 mL裂解緩沖液懸浮離心后,分別取上清液和沉淀液各50.0 μL進行SDS-PAGE電泳檢測。
1. 2. 6 包涵體蛋白純化 參考胡平各等(2020)的方法進行MaNPC1蛋白純化。具體步驟:將收集的沉淀加入Ni-NTA樹脂層析柱中,流速控制在0.5 mL/min,收集穿柱液體。以10倍柱床體積的NTA-0、NTA-20、NTA-60、NTA-200和NTA-500 Buffer進行洗脫,收集各洗脫峰,取少量洗脫液進行SDS-PAGE電泳檢測,其余洗脫液置于透析袋中,4 ℃下以1×PBS透析,并超濾濃縮透析產物。
1. 2. 7 多克隆抗體制備及免疫效價檢測 參考張永德等(2018)的方法進行多克隆抗體制備及免疫效價檢測。具體步驟:以純化的重組蛋白免疫注新西蘭兔,每次注射的重組蛋白用量為200 μg,每間隔7 d對2只兔子進行1次加強免疫,每只兔子免疫4~5次,并采用間接ELISA法測定血清抗體效價,當(陽性血清OD450-空白孔OD450)/(陰性血清OD450-空白孔OD450)>2.1時,陽性血清最大稀釋倍數即為血清抗體效價。待抗體表達恒定后,采集血樣并分離血清,置于-20 ℃冰箱保存備用。
1. 2. 8 香蕉組織蛋白提取及定量分析 參考劉云芬(2016)的方法提取MaNPC1蛋白。具體步驟:稱取5 g香蕉果皮組織,液氮下研磨成粉,加入20 mL蛋白提取液(含0.1 mmol/L Tris-HCL、1% β-巰基乙醇、0.1% Triton-X100、1 mmol/L PMSF和10% PVP,pH 9.0),4 ℃下15000 r/min離心20 min,收集上清液。MaNPC1蛋白定量采用Bradford法。參考程彥偉等(2008)的方法進行SDS-PAGE電泳,上樣量為7 μg。
1. 2. 9 Western blotting檢測 Western blotting檢測參考張慶嬡等(2020)的方法。具體步驟:待蛋白定量后,取相應蛋白與上樣緩沖液混合,經沸水浴5 min使蛋白變性,取出后10000 r/min離心1 min,吸取20.0 μL蛋白樣品上樣。參考考馬斯亮藍染色結果,記錄目的蛋白的位置,以指導轉膜時切膠的位置。采用干法轉膜,20 V轉膜15 min,用二抗—辣根酶標記羊抗兔IgG-HRP。
1. 2. 10 實時熒光定量PCR檢測 RNA提取和反轉錄合成cDNA均參考帥良等(2020)的方法,采用實時熒光定量PCR檢測MaNPC1基因相對表達量。以MaCAC為內參基因,配制10.0 μL反應體系置于Roche Lightcycler? 480實時熒光定量PCR儀上進行檢測,MaNPC1基因相對表達量采用2-△△Ct法計算。所用的實時熒光定量PCR擴增引物如表1所示。
1. 3 統計分析
使用Excel 2013進行數據處理和分析,使用Origin 8.5作圖。
2 結果與分析
2. 1 MaNPC1基因ORF克隆結果
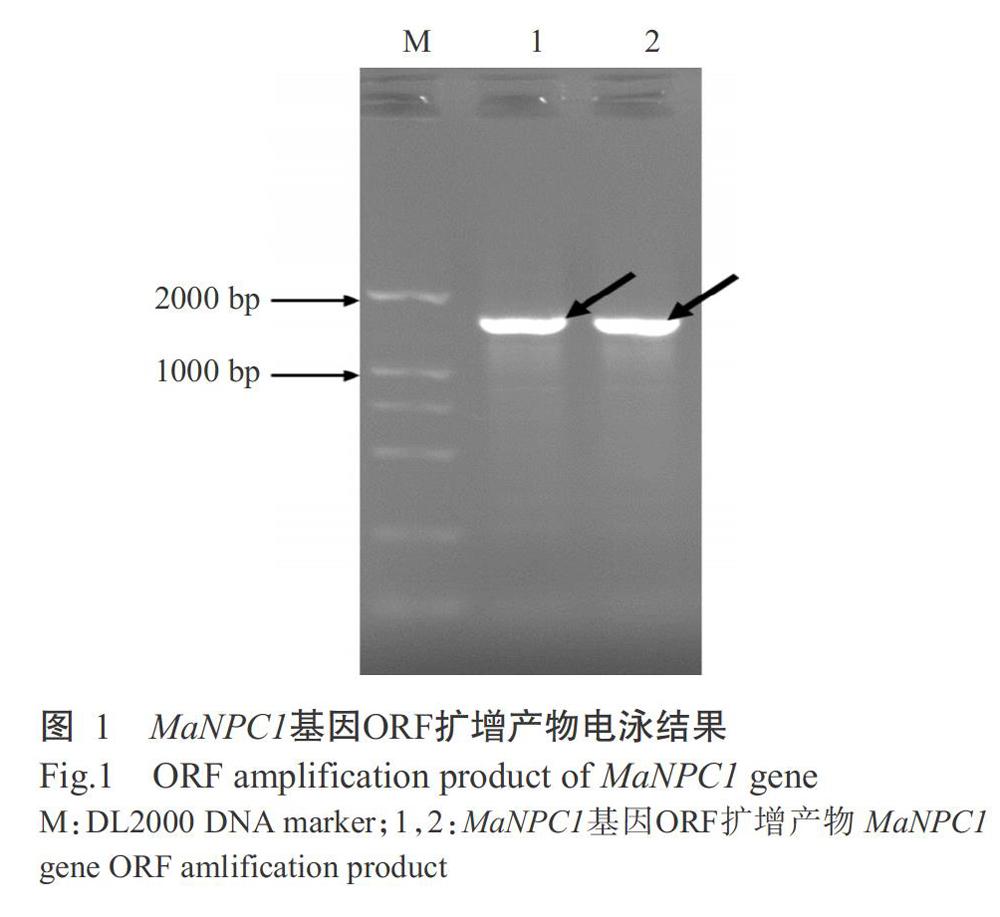
以香蕉果皮cDNA為模板、MaNPC1-F1和Ma-NPC1-R1為引物進行PCR擴增,結果獲得約1600 bp的條帶(圖1)。經測序比對分析,發現該片段為MaNPC1基因ORF序列,長度為1650 bp,共編碼549個氨基酸殘基。該片段可用于后續原核表達載體的構建。
2. 2 MaNPC1蛋白生物信息學分析結果
2. 2. 1 同源比對分析結果 通過DNAMAN 6.0對3個香蕉NPC蛋白(MaNPC1、MaNPC2和MaNPC6)進行氨基酸序列比對分析,結果顯示這3個蛋白的氨基酸序列相似性較高,尤其是中間序列相似性較高,N端和C端相似性較低(圖2),表明中間序列可能存在NPC蛋白的核心序列。
2. 2. 2 理化性質預測結果 MaNPC1蛋白分子式為C2747H4249N769O793S10,分子量為61.06 kD,理論等電點(pI)為8.96,丙氨酸、纈氨酸、亮氨酸和絲氨酸含量較高,分別占氨基酸總數的8.7%、8.2%、7.8%和7.7%,不含吡咯賴氨酸和硒半胱氨酸,不穩定指數為47.14,表明其為不穩定蛋白。
2. 2. 3 親/疏水性分析結果 MaNPC1蛋白親/疏水性預測結果(圖3)顯示,MaNPC1蛋白的最大親水性指數為-1.578、最大疏水性指數為2.079,平均為 -0.348,親水性氨基酸數目明顯高于疏水性氨基酸,表明為親水蛋白。因此,利用MaNPC1蛋白制備多克隆抗體具有較強的可行性。
2. 2. 4 跨膜結構預測結果 MaNPC1蛋白跨膜結構預測結果如圖4所示。MaNPC1蛋白存在一個跨膜結構,其跨膜螺旋(TMhelix)位于第13~32位氨基酸,推測MaNPC1為分泌性蛋白,有利于后續Wes-tern blotting檢測時組織蛋白的提取。同時,其余氨基酸無明顯的跨膜結構,降低了跨膜區疏水性氨基酸對蛋白折疊的影響,易于表達和純化。
2. 2. 5 信號肽預測結果 MaNPC1蛋白信號肽預測結果(圖5)顯示,該蛋白存在信號肽的可能性為0.5386(>0.5000),即存在信號肽。最有可能的剪切位點位于第31~32位氨基酸間,AHC-LD可能性為0.2918,與TMHMM預測獲得的跨膜結構一致。進一步說明MaNPC1蛋白為分泌性蛋白,有利于后續Western blotting檢測時組織蛋白的提取。
2. 2. 6 亞細胞定位及結構預測結果 對MaNPC1蛋白氨基酸序列進行亞細胞定位,結果顯示,Ma-NPC1可能定位于細胞壁或葉綠體。使用PredictProtein對蛋白二級結構進行預測,結果顯示,Ma-NPC1蛋白二級結構中α-螺旋占14.57%、延伸鏈占7.1%、無規則卷曲占78.32%。以SWISS-MODEL預測MaNPC1蛋白三級結構,結果(圖6)顯示,MaNPC1蛋白有數個由N端構成的小突出結構域和由中間序列及C端組成的大結構域組成,與二級結構預測結果相符,證明三級結構預測結果準確。Pfam對結構域的預測結果如圖7所示。MaNPC1蛋白含1個典型的磷酸酯酶域(PF04185),具有酯酶活性。
2. 2. 7 抗原指數分析結果 由圖8可看出,Ma-NPC1蛋白抗原指數較高的區段為第8~15、28~54、60~67、72~78、110~118、126~135、186~198、225~231、265~278、287~304、330~337、363~370、386~401、414~422、434~465、476~484和485~493位氨基酸。這些位點除抗原指數較高外,多數還具備較強的親水性,因此,采用MaNPC1蛋白制備多克隆抗體具有較強的可行性。
2. 3 MaNPC1基因表達載體構建及鑒定結果
由圖9可知,重組質粒pGEX-6p-3-MaNPC1經雙酶切后得到1650 bp的特異性條帶,說明原核表達載體構建成功。
2. 4 重組蛋白表達及鑒定結果
由圖10可知,含重組質粒pGEX-6p-3-MaNPC1的大腸桿菌Rosetta2(DE3)經IPTG誘導表達3和6 h后,沉淀中均產生大量分子量約60 kD(含GST)的目的表達產物,與預期結果相符,而在上清液中未出現大量表達產物,說明重組蛋白主要以不溶性的包涵體形式存在。
2. 5 多克隆抗體效價測定結果
利用直接ELISA對最后一次免疫獲得的動物血清樣品進行抗體效價測定,結果圖11所示。隨著稀釋倍數的增加,抗體效價逐漸下降,當稀釋倍數為1∶2048000時1號兔子抗體的OD450與空白孔的OD450比值為2.19,2號兔子抗體的OD450與空白孔的OD450比值為2.12,因此稀釋倍數1∶2048000為該多克隆抗體的效價,說明重組蛋白MaNPC1可誘導新西蘭兔產生良好的免疫反應,抗體效價較高。
2. 6 Western blotting檢測結果
由圖12可知,200、100和10 ng重組蛋白的泳道(約60 kD位置)上均出現1條清晰且與陽性血清反應的蛋白條帶,其中200 ng重組蛋白條帶最清晰,表明MaNPC1抗血清具有特異的反應特性。
2. 7 MaNPC1蛋白表達水平的檢測結果
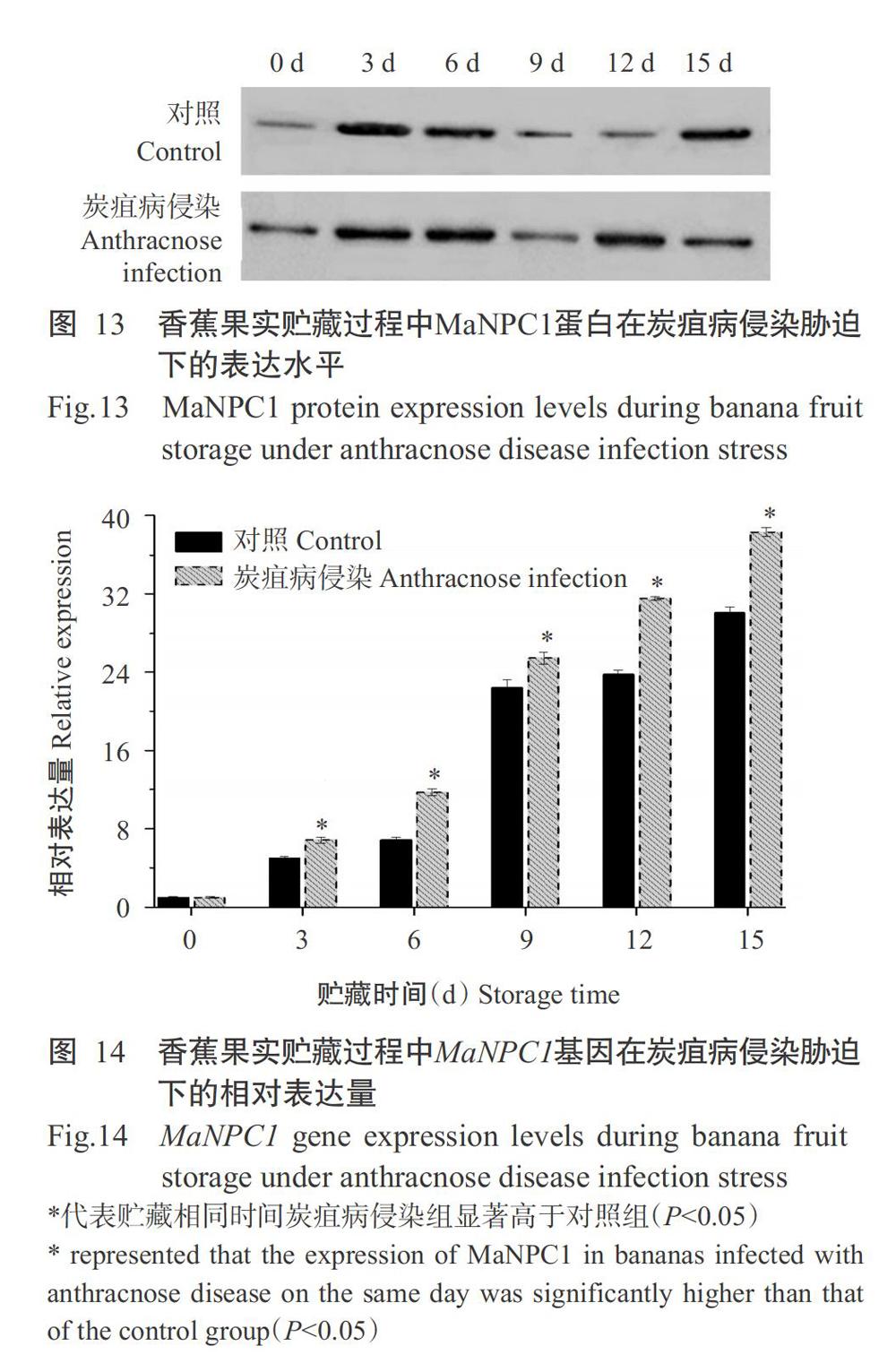
由圖13可知,香蕉果實貯藏過程中MaNPC1蛋白表達水平呈上升—下降—上升的變化趨勢;炭疽病侵染組MaNPC1蛋白除貯藏15 d時的表達水平較對照組低外,其他時間均略高于對照組。由此可知,炭疽病侵染能提高MaNPC1蛋白表達水平,故推測MaNPC1蛋白參與香蕉果實抵抗炭疽病侵染。
2. 8 MaNPC1基因相對表達量的檢測結果
由圖14可知,MaNPC1基因的相對表達量在香蕉果實貯藏過程中呈逐漸上升趨勢;貯藏3~15 d,炭疽病侵染組MaNPC1基因的相對表達量均顯著高于對照組(P<0.05)。這與香蕉果實貯藏過程中炭疽病侵染能提高MaNPC1蛋白表達水平的結論一致,進一步證明MaNPC1基因參與調控果實對炭疽病侵染脅迫的響應,其表達產物MaNPC1可提高香蕉果實抵抗炭疽病侵染的能力。
3 討論
目前,以原核表達的重組蛋白免疫不同動物(兔子和鼠等)制備多克隆抗體已成為一種行之有效且常用的方法(程彥偉等,2008)。此外,通過原核表達可獲得大量的抗原蛋白,可用于蛋白性質和功能、蛋白間相互作用及多種生化功能研究(王增等,2009)。現已研究證實,磷脂酶在植物的防御反應中發揮重要作用(Laxalt and Munnik,2002;Canonne et al,2011),尤其是NPC在植物防御病原菌脅迫反應中發揮重要作用(Scherer et al,2002)。因此,研究香蕉NPC在抵御病原菌脅迫中的作用尤為必要。炭疽病病原菌在果實生長階段(青果期)就可侵染果實,以附著孢侵入并以休眠狀態潛伏于青果上,待果實成熟采收后才表現癥狀,所以果實成熟度越高,病害發生越嚴重,給香蕉采后的貯藏和運輸帶來極大挑戰。本研究通過原核表達MaNPC1基因并制備多克隆抗體,對其進行抗血清效價測定,并運用Western blotting和實時熒光定量PCR檢測在炭疽病侵染脅迫下MaNPC1蛋白的表達水平及MaNPC1基因的相對表達量,結果發現炭疽病侵染組MaNPC1蛋白表達水平和MaNPC1基因相對表達量均高于對照組,表明MaNPC1基因參與調控果實對炭疽病侵染脅迫的響應,其表達產物MaNPC1可提高香蕉果實抵抗炭疽病侵染的能力。Albrecht等(2008)研究也發現,甜橙在黃龍病脅迫下,與擬南芥AtNPC5基因同源的甜橙CsNPC基因表達量較對照(無黃龍病脅迫)增加了5倍,說明甜橙植株中CsNPC基因參與抵御黃龍病脅迫;Peters等(2010)通過擬南芥DNA微陣列數據分析發現,在接種病菌的植株中,AtNPC3和AtNPC4基因的表達量顯著上升,證明擬南芥植株中NPC參與抵御病菌脅迫。
雖然本研究對MaNPC1基因進行生物信息學分析,包括亞細胞定位及跨膜結構預測等,其結果僅參考,后續還須通過擬南芥原生質體制備、PEG轉化及激光共聚焦顯微鏡觀察進行亞細胞定位。此外,本研究僅探究了MaNPC1基因,對于香蕉磷脂酶C基因家族的功能研究還遠不夠,后續應對整個香蕉磷脂酶C家族基因進行克隆及表達,進一步解析炭疽菌與香蕉磷脂酶C的關系。
4 結論
炭疽病侵染能提高MaNPC1蛋白表達水平,故推測MaNPC1蛋白參與香蕉果實抵抗炭疽病侵染。
參考文獻:
陳偉,李玉娟,洪敏晶,林月霞,施靜雯,羅利瓊,覃富健. 2019. 棉鈴蟲Hsp70的多克隆抗體制備及鑒定[J]. 環境昆蟲學報,41(2):352-357. doi:10.3969/j.issn.1674-0858.2019. 02.17. [Chen W,Li Y J,Hong M J,Lin Y X,Shi J W,Luo L Q,Qin F J. 2019. Preparation and identification of polyclonal antibody of Hsp70 from Helicoverpa armigera[J]. Acta Entomologica Sinica,41(2):352-357.]
程彥偉,李亮,沈嶸,齊耀程,劉曉宇,王寧,張煒. 2008. 水稻LRR型類受體蛋白激酶胞外區的原核表達及多克隆抗體制備[J]. 生物化學與生物物理進展,35(9):1077-1083. doi:10.3321/j.issn:1000-3282.2008.09.016. [Cheng Y W,Li L,Shen R,Qi Y C,Liu X Y,Wang N,Zhang W. 2008. Prokaryotic expression and polyclonal antibody preparation of the extracellular domain about rice LRR receptor-like protein kinase[J]. Advances in Biochemistry and Biophysics,35(9):1077-1083.]
胡利芹,薛飛洋,李微微,王二輝,徐兆師,李連城,周永斌,賈冠清,刁現民,馬有志,陳明. 2015. 谷子非特異性磷脂酶C基因SiNPC4的克隆及功能分析[J]. 作物學報,41(7):1017-1026. doi:10.3724/SP.J.1006.2015.01017. [Hu L Q,Xue F Y,Li W W,Wang E H,Xu Z S,Li L C,Zhou Y B,Jia G Q,Diao X M,Ma Y Z,Chen M. 2015. Cloning and functional analysis of nonspecific phospholipase C gene SiNPC4 in foxtail millet(Setaria italic)[J]. Acta Agronomica Sinica,41(7):1017-1026.]
胡平各,鄒芝英,祝璟琳,喻杰,肖煒,李大宇,楊弘,馬銀花,陳炳霖. 2020. 尼羅羅非魚p38MAPK多克隆抗體的制備及鑒定[J]. 農業生物技術學報,28(3):553-561. doi:10. 3969/j.issn.1674-7968.2020.03.017. [Hu P G,Zou Z Y,Zhu J L,Yu J,Xiao W,Li D Y,Yang H,Ma Y H,Chen B L. 2020. Preparation and identification of polyclonal antibody against the p38MAPK of Nile tilapia(Oreochromis niloticus)[J]. Journal of Agricultural Biotechnology,28(3):553-561.]
劉云芬. 2016. MeJA和NO誘導冷藏黃瓜抗冷性與抗氧化防御系統的關系[D]. 廣州:華南農業大學. [Liu Y F. 2016. The relationship between MeJA and NO inducing cold resistance and antioxidant defense system of cold storage cucumber[D]. Guangzhou:South China Agricultural University.]
帥良,孫健,段振華,李麗,何雪梅,李昌寶,廖玲燕. 2019. 植物非特異性磷脂酶C的研究進展[J]. 江蘇農業科學,47(18):30-37.doi:10.15889/j.issn.1002-1302.2019.18.005. [Shuai L,Sun J,Duan Z H,Li L,He X M,Li C B,Liao L Y. 2019. Research progress of structure and function of plant non-specific phospholipase C[J]. Jiangsu Agricultural Sciences,47(18):30-37.]
帥良,殷菲朧,廖玲燕,劉云芬,段振華,宋慕波. 2020. 龍眼SPS基因克隆及其表達分析[J]. 南方農業學報,51(7):1529-1536. doi:10.3969/j.issn.2095-1191.2020.07.003. [Shuai L,Yin F L,Liao L Y,Liu Y F,Duan Z H,Song M B. 2020. Cloning and expression analysis of SPS gene in Longan[J]. Southern Agricultural Journal,51(7):1529-1536.]
王芳,郇青鶴,柯佑鵬,過建春,劉秋冬. 2016. 中國香蕉產業的全要素生產率、技術進步與效率變化[J]. 廣東農業科學,43(12):168-175. doi:10.16768/j.issn.1003-874x.2016. 12.027. [Wang F,Huan Q H,Ke Y P,Guo J C,Liu Q D. 2016. Changes of total factor productivity,technological progress and efficiency in Chinese banana industry[J]. Guangdong Agricultural Sciences,43(12):168-175.]
王海波,李璐,蘇新國,張昭其. 2018. EGTA結合熱處理對香蕉果實CBF冷應答途徑相關基因表達的影響[J]. 南方農業學報,49(11):2136-2140. doi:10.3969/j.issn.2095-1191. 2018.11.03. [Wang H B,Li L,Su X G,Zhang Z Q. 2018. Effects of EGTA combined with heat treatment on expression of CBF cold response pathway related genes in banana fruit[J]. Journal of Southern Agriculture,49(11):2136-2140.]
王增,代茹,張江巍,陳尚武,張文,馬會勤. 2009. 擬南芥WUSCHEL蛋白的原核表達、親和純化和多克隆抗體制備[J]. 生物工程學報,25(9):1409-1416. doi:10.3321/j.issn:1000-3061.2009.09.019. [Wang Z,Dai R,Zhang J W,Chen S W,Zhang W,Ma H Q. 2009. Induced expre-ssion of Arabidopsis thaliana WUSCHEL in Escherichia coli,affinity protein purificatio and polyclonal antibody preparation[J]. Journal of Bioengineering,25(9):1409-1416.]
謝建華,龐杰. 2010. 香蕉采后生理與保鮮技術研究進展[J]. 保鮮與加工,10(6):37-41.doi:10.3969/j.issn.1009-6221. 2010.06.011. [Xie J H,Pang J. 2010. Research progress of banana post-harvest physiology and fresh-keeping technology[J]. Fresh-keeping and Processing,10(6):37-41.]
張慶媛,朱進順,王路得,汪琪,朱珊麗,陳韶,張麗芳,蔣朋飛. 2020. HPV16型E6重組蛋白的表達及其兔多克隆抗體的制備[J]. 細胞與分子免疫學雜志,36(3):264-270. doi:10.13423/j.cnki.cjcmi.008975. [Zhang Q Y,Zhu J S,Wang L D,Wang Q,Zhu S L,Chen S,Zhang L F,Jiang P F. 2020. Expression of HPV16 E6 recombinant protein and preparation of its rabbit polyclonal antibody[J]. Journal of Cellular and Molecular Immunology,36(3):264-270.]
張永德,林勇,馮鵬霏,陳忠,杜雪松,黃姻,潘傳燕,羅洪林. 2018. 尼羅羅非魚Lck多克隆抗體的制備及鑒定[J]. 南方農業學報,49(11):2304-2310. doi:10.3969/j.issn.2095-1191.2018.11.27. [Zhang Y D,Lin Y,Feng P F,Chen Z,Du X S,Huang Y,Pan C Y,Luo H L. 2018. Preparation and identification of Lck polyclonal antibody in Nile tilapia[J]. Journal of Southern Agriculture,49(11):2304-2310.]
Albrecht U,Bowman K D. 2008. Gene expression in Citrus sinensis(L). Osbeck following infection with the bacte-rial pathogen Candidatus Liberibacter asiaticus causing Huanglongbing in Florida[J]. Plant Science,175(3):291-306. doi:10.1016/j.plantsci.2008.05.001.
Canonne J,Froidurenicolas S,Rivas S. 2011. Phospholipases in action during plant defense signaling[J]. Plant Signa-ling Behavior,6(1):13-18. doi:10.4161/psb.6.1.14037.
Chrastil J,Parrish F W. 1987. Phospholipases C and D in rice grains[J]. Journal of Agricultural Food Chemistry,35(4):624-627. doi:10.1021/jf00076a045.
Huang G T,Ma S L,Bai L P,Zhang L,Ma H,Jia,P,Liu J,Zhong M,Guo Z F. 2012. Signal transduction during cold,salt,and drought stresses in plants[J]. Molecular Bio-logy Reports,39(2):969-987. doi:10.1007/s11033-011-0823-1.
Huang H,Jing G M,Wang H,Duan X M,Qu H X,Jiang Y M. 2014. The combined effects of phenylurea and gibbere-llins on quality maintenance and shelf life extension of banana fruit during storage[J]. Scientia Horticulture,167:36-42. doi:10. 1016/j.scienta.2013.12.028.
Ketsa S,Wisutiamonkul A,Doorn W. 2013. Apparent synergism between the positive effects of 1-MCP and modified atmosphere on storage life of banana fruit[J]. Postharvest Biology & Technology,85(4):173-178. doi:10. 1016/j.postharvbio.2013.05.009.
Krcková Z,Brouzdová J,Daněk M,Kocourková D,Rainteau D,Ruelland E,Valentová O,Pejchar P,Martinec J. 2015. Arabidopsis non-specific phospholipase C1:Characterization and its involvement in response to heat stress[J]. Frontiers in Plant Science,6:928. doi:10.3389/fpls.2015.00928.
Laxalt A M,Munnik T. 2002. Phospholipid signalling in plant defence[J]. Current Opinion in Plant Biology,5(4):332-338. doi:10.1016/S1369-5266(02)00268-6.
Luz Irina A,Calderon-Villalobos,Kuhnle C,Li H b,Rosso M,Weisshaar B,Schwechheimer C. 2006. LucTrap vectors are tools to generate luciferase fusions for the quantification of transcript and protein abundance in Vivo1[J]. Breakthrough Technologies,141(1):3-14. doi:10.1104/pp.106. 078097.
Nakamura Y,Awai K T. 2005. A novel phosphatidylcholine-hydrolyzing phospholipase C induced by phosphate starvation in Arabidopsis[J]. Joumal of Biological Chemistry,280(9):7469-7476. doi:10.1074/jbc.M408799200.
Pejchar P,Martinec J. 2015. Aluminum ions alter the function of non-specific phospholipase C through the changes in plasma membrane physical properties[J]. Plant Signaling & Behavior,10(6):e1031938. doi:org/10.1080/15592324. 2015.1031938.
Peters C,Kim S C,Devaiah S. 2014. Non-specific phospholipase C5 and diacylglycerol promote lateral root development under mild salt stress in Arabidopsis[J]. Plant Cell and Environment,37(9):2002-2013. doi:10.1111/pce.12 334.
Peters C,Li M,Narasimhan R,Roth M,Welti R,Wang X M. 2010. Nonspecific phospholipase C NPC4 promotes responses to abscisic acid and tolerance to hyperosmotic stress in Arabidopsis[J]. The Plant Cell,22(8):2642-2659. doi:doi:10.1105/tpc.109.071720.
Reddy V S,Rao D K V,Rajasekharan R. 2010. Functional characterization of lysophosphatidic acid phosphatase from Arabidopsis thaliana[J]. Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,1801(4):455-461. doi:10.1016/j.bbalip.2009.12.005.
Rinukshi W,P?emysl P,André H,Jan M,Günther F E. 2010. Scherer. plant phosphatidylcholine-hydrolyzing phospholipases C NPC3 and NPC4 with roles in root development and brassinolide signaling in Arabidopsis thaliana[J]. Molecular Plant,3(3):610-625. doi:10.1093/mp/ssq005.
Scherer G F E,Paul R U,Holk A,Jan M. 2002. Down regulation by elicitors of phosphatidylcholine hydrolyzing phospholipase C and up-regulation of phospholipase A in plant cells[J]. Biochemical and Biophysical Research Communications,293(2):766-770. doi:10.1016/S0006-291X(02) 00292-9.
Song J L,Zhou Y H,Zhang J R. 2017. Structural,expression and evolutionary analysis of the non-specific phospholipase C gene family in Gossypium hirsutum[J]. BMC Genomics,18(1):979-987. doi:10.1186/s12864-017-4370-6.
(責任編輯 陳 燕)

