GSTA1基因多態性與白消安為基礎預處理方案致急性肝損傷的相關性研究
余慧玲 林升祿 吳雪梅
(1 福建省老年醫院藥劑科,福建 福州 350001;2 福建醫科大學附屬協和醫院藥學部,福建 福州 350001)
白消安(Busulfan)聯合環磷酰胺、氟達拉濱等以白消安為基礎的預處理方案廣泛應用于造血干細胞移植(haematopoietic stem cell transplantation,HSCT)前的預處理過程。白消安作為細胞周期非特異性的雙功能烷化劑,治療窗窄,對體內正常細胞損傷也很大,容易發生急慢性肝損傷等不良反應,更嚴重的如肝靜脈閉塞癥(hepatic veno-occlusive disease,HVOD)則可能致命[1]。白消安主要在肝臟內經谷胱甘肽硫轉移酶(glutathiones transferases,GSTs)催化與谷胱甘肽結合后代謝[2]。而GSTA1是肝臟GST酶家族中含量最多的一種,常依據其啟動子區3個連鎖位點的堿基突變(-52位G→A、-69位C→T、-567位T→G),分為GSTA1*A和*B等位基因,GSTA1*B等位基因因突變致啟動子轉錄活性降低,致GSTA1酶蛋白表達水平下降,表現為GSTs對相應底物的解毒能力及其保護組織細胞抵御損傷的能力降低[3],提示其可能與預處理過程常見的肝損傷并發癥的發生有關。已有研究表明抗結核藥所致肝損傷與該位點的多態性密切相關[4]。故本研究收集了115例以白消安為基礎預處理的HSCT患者為對象,考察該人群中二者的相關性。
1 資料與方法
1.1 研究對象 2014年3月至2018年5月收治于福建醫科大學附屬協和醫院血液科,接受Ara-c/Flu/Bu/Cy、Ara-c/Bu/Cy、Flu/Bu等以白消安為基礎的方案進行預處理的漢族HSCT患者115例;其中白消安的給藥劑量基于患者調整后的理想體質量計算:0.8 mg/kg,q6h×4 d,微注泵推注2 h;所有患者預處理前肝腎功能均基本正常,并于預處理期間常規使用谷胱甘肽聯合小分子肝素預防HVOD,使用環孢素和甲氨喋呤預防移植物抗宿主病的發生。該方案經醫院倫理委員會審批同意;患者或家屬知情并同意后方可執行。
1.2 儀器和試劑 Veriti DX Thermal Cycler PCR擴增儀(美國應用生物系統公司),OSE470藍光切膠儀(天根生化科技公司),PS100電泳儀(上海天能公司),EasyPrue Blood Genomic DNA Kit、瓊脂糖Agorose、染料Gelstain、6xDNA Loading Buffer、EasyTaq DNAPolymerrase、dNTPs、MgSO4、10x EasyTaq Buffer(北京全式金生物公司),FD EarⅠ、FD Buffer(賽默飛公司)。
1.3 DNA提取 采集患者靜脈血2 mL,EDTA抗凝,嚴格按基因組提取試劑盒說明書操作。
1.4 GSTA1基因型測定 PCR反應體系參考課題組前期研究結果(20 μL)[5]:上游引物序列為5'-GCATCAGCTTGCCCTTCA-3',下游序列為5'-AAACGCTGTCACCGTCCTG-3',該引物對委托上海生工生物工程技術服務有限公司合成并檢測;設計總反應體系為20 μL,其中含4U DNA聚合酶、9 ng模板DNA、2.5 mmol/L MgSO4、0.1 mmol/L dNTPs、0.4 μmol/L上下游引物,余量用去離子水補足。擴增程序設為:先94 ℃預變性7 min;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸30 s,共往復循環35次;最后一次循環結束后再72 ℃延伸7 min,后4 ℃保存;酶切反應體系(30 μL):PCR純化產物12 μL,FD EarⅠ 5U 1 μL,Buffer 2 μL,余量用去離子水補足,在37 ℃水浴鍋中酶切30 min;瓊脂糖凝膠電泳:膠染法制備2%瓊脂糖凝膠,取5 μL酶消化產物和1 μL 6×Loading Buffer 混勻后上樣,電泳條件均為電壓5 V/cm,電泳時間20 min,用藍光切膠儀觀察;結果判定:只有1條401bp片段的判定為野生型,同時有401bp、308bp、93bp 3條片段的判定為雜合型,同時有308bp、93bp 2條片段的判定為純突變型。
1.5 GSTA1基因型測定驗證 隨機抽取部分樣本采用基質輔助激光解吸電離飛行時間質譜法(MALDI-TOF-MS)對上述測定結果進行驗證,上游引物序列為5'-ACGTTGGATGCTTAGAATCCAGT AGGTGGC-3',下游引物序列為5'-GCTTTTCCCTAACTTGAC-3',延伸引物序列為5'-ACGTTGGATGCCTCTCAATAGTTCTCTC CC-3'[6],委托上海生工生物工程技術服務有限公司合成,具體檢測委托森廣生物科技(北京)有限公司完成。圖1為2條等位基因該位點堿基序列均為C即基因型為野生型的質譜峰圖,圖2為2條等位基因該位點堿基序列分別為C和T即基因型為雜合型的質譜峰圖。
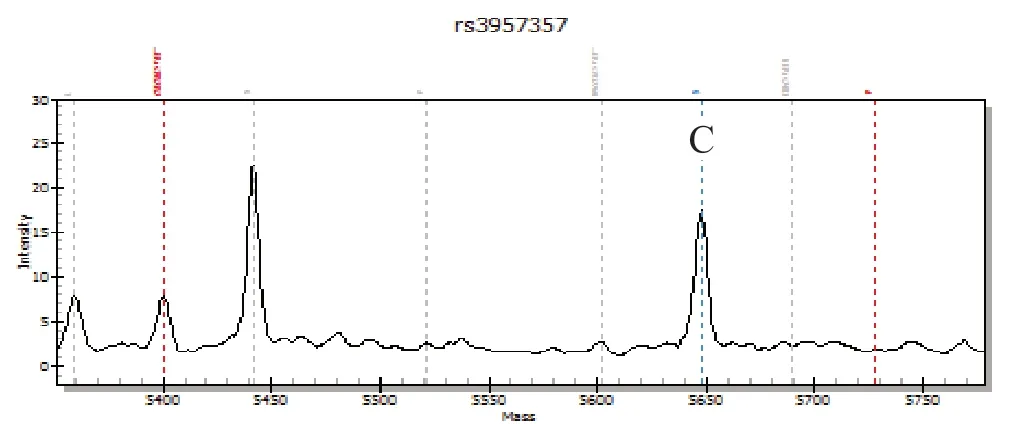
圖1 GSTA1基因為野生型時的質譜峰圖
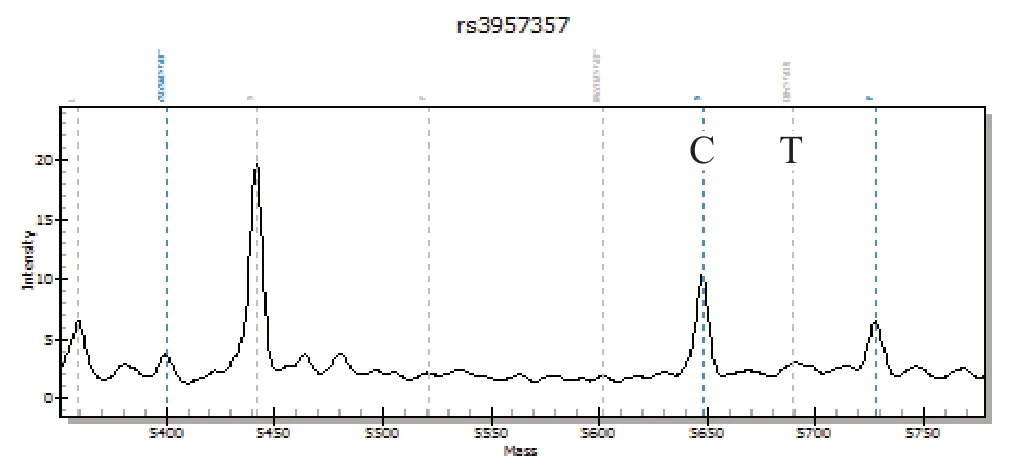
圖2 GSTA1基因為雜合突變型時的質譜峰圖
1.6 急性肝損傷判定 參照《急性藥物性肝損傷診治建議(草案)》,觀察患者在預處理及行造血干細胞移植住院期間,至少發生有一次以上ALT或DBIL值達正常值上限2倍以上或者AST、ALP、TBIL同時上升且至少1項達正常值上限2倍以上的,判斷為急性肝損傷。
1.7 統計分析方法 采用SPSS 22.0軟件對數據進行處理,計量資料以(±s)表示,計數資料以百分比表示,并采用χ2檢驗,基因多態性對急性肝損傷發生的影響以相對危險度(RR)、95%置信區間(CI)表示,P<0.05為差異有統計學意義。
2 結果
2.1 一般情況 最終共有115例HSCT患者納入本次研究:男性71例(61.7%),女性44例(38.3%);年齡(28.20±15.61)歲;急性髓性白血病(AML)57例(49.6%),急性淋巴細胞白血病(ALL)31例(33.0%),慢性粒細胞白血病(CML)6例(5.2%),再生障礙性貧血(AA)7例(6.1%),骨髓增生異常綜合征(MDS)5例(4.3%),多發性骨髓瘤(MM)2例(1.7%);肝功正常93例(80.9%),出現急性肝損傷22例(19.1%)。
2.2 GSTA1基因分布情況及Hardy-Weinberg平衡檢驗 本研究人群的GSTA1基因分布情況見表1,Hardy-Weinberg平衡檢驗結果P>0.05說明本研究人群具有群體代表性。

表1 GSTA1 C-69T(rs3957357)位點Hardy-Weinberg平衡檢驗[n(%)]
2.3 GSTA1 基因多態性與急性肝損傷的相關性 攜帶GSTA1*A/*B(雜合型)的患者急性肝損傷的發生率顯著高于攜帶GSTA1*A/*A(野生型)的患者(P<0.05)。見表2。

表2 GSTA1基因型與急性肝損傷發生的相關性
3 討論
谷胱甘肽硫轉移酶(GSTs)是體內重要的Ⅱ相代謝酶,其功能主要是催化內源性或外源性親電性有害物與谷胱甘肽結合,增加疏水性以便穿透細胞膜后排出體外或進入Ⅲ相反應,發揮解毒功效[7];同時部分GSTs具有過氧化物酶和異構酶活性,可分解脂質過氧化物,在細胞中發揮抗氧化、抗損傷作用[8]。人類的GSTs主要以可溶性的二聚體的形式分布于各組織細胞液中,且主要在肝臟,由分布于多條染色體的一個超基因家族編碼,少部分以膜結合蛋白的形式分布微粒體膜,由另一個超級因基因家族編碼。依據亞基結構、氨基酸序列底物特異性、免疫原性等特點,胞液中的GSTs可分7大類:Alpha(α)、Mu(μ)、Pi(π)、Theta(Θ)、Sigma(σ)、Omega(ω)、Zeta(ξ),另有只存在于線粒體中的Kappa(K)類GSTs[9]。其中Alpha類(GSTA)在肝臟中含量最多(約75%)的GSTs,而GSTA1又在Alpha類中占比最高(約45%),可見GSTA1是肝臟內含量最高的GST同工酶,故其基因的表達水平可能顯著影響肝臟GST酶的總體活性,進而影響肝臟整體二相代謝及抗損傷的能力。
目前研究已發現GSTA1基因啟動子區域存在多個單核苷酸多態性(SNP)位點,可引起啟動子活性的改變進而影響GSTA1基因的表達水平。其中-52、-69位點的突變可引起轉錄因子Sp1與啟動子的選擇性結合水平的降低下調GSTA1的表達,對GSTA1表達的影響最大,而連鎖突變的-567位點的突變則引起轉錄因子GATA1與啟動子結合水平的降低協同前二位點的下調表達作用[10]。因此基于這3個連鎖位點的GSTA1基因的多態性(分為*A和*B等位基因)對Alpha類GSTs酶以至肝臟整體GSTs酶活性水平的影響最大。已有研究表明GSTA1*A/*B的GST酶活性顯著低于GSTA1*A/*A,顯著高于GSTA1*B/*B,而GSTM1缺失與否對GST酶活性無顯著影響[11]。目前關于白消安的藥物基因組學研究多數認為攜帶GSTA 1*B等位基因會導致白消安清除率顯著下降[12],提示GSTA1基因對白消安的代謝影響較大。
藥物所致肝損傷的發生主要由藥物和肝臟相應Ⅰ相、Ⅱ相、Ⅲ相代謝酶的種類、活性水平、肝細胞的脂質過氧化損傷水平、個體對藥物及代謝物的免疫應激水平的匹配失衡所致,這些又與藥物的劑量及個體的相關代謝酶或信號分子的基因多態性緊密相關[13]。白消安主要在肝臟經GSTs代謝,而預處理所使用白消安的劑量較大,短期在肝臟的蓄積量極有可能超出肝臟GSTs酶的Ⅱ相代謝能力和對脂質過氧化物的代謝能力,從而導致肝損傷。
本研究結果顯示GSTA1*A/*B患者發生急性藥物肝損傷的風險是GSTA1*A/*A患者的2.416倍(95%CI:1.160-5.032,P=0.022),考慮到上述GSTA1基因-52、-69、-567位點的多態性與GSTs的整體活性相關性,上述分析能較好的解釋該結果。Ansari等[14]研究發現GSTs低代謝表型患者(主要為GSTA1*B等位基因攜帶者)肝竇阻塞綜合征(SOS)的發生風險大為增加;Terakura等[15]研究發現GSTA1*B攜帶者給予第1劑白消安后的AUC(AUC1st)顯著高于GSTA1*A/*A,而較高AUC1st水平的患者移植期間血清總膽紅素水平顯著較高;這些均提示攜帶GSTA1*B等位基因增加白消安為基礎預處理方案所致肝毒性風險,可與本研究結果相佐證。而課題組前期研究未發現GSTT1、M1多態性與急性肝損傷相關性,這可能與GSTT1、M1多態性對總GSTs活性影響有限有關,也反映出GSTA1基因多態性對急性肝損傷的主要影響作用[16]。因此,有必要并對攜帶GSTA1*B等位基因的患者的肝功能加強監測和保護。
但GSTA1的活性水平除受GSTA1基因多態性影響外,還受多條信號通路的調控,有研究表明鉛暴露可通過NF-κB信號通路下調GSTA1表達[17],而JNK抑制劑則可通過JNK信號通路上調GSTA1的表達[18];加之GSTs的種類繁多,對于同一底物,不同種類的GSTs之間可能存在代償調節,可見GSTs總體活性影響因素的復雜性。而GSTs酶活性太低容易發生肝損傷及其他不良反應,而太高又可導致白消安清除過快影響療效,故有必要對白消安實行個體化給藥,而進一步的擴大樣本量研究以確認定量關系將具有較大臨床意義。

