血清分泌型絲氨酸蛋白酶抑制劑Kazal 1型對浸潤性肺腺癌的診斷價值
林帥東 續力云 陸暢暢 石邈 黃燕燕 樂涵波
分泌型絲氨酸蛋白酶型抑制劑Kazal 1(serine protease inhibitor kazal type 1,SPINK1)是一種大小為6.2 KDa的絲氨酸蛋白酶分泌抑制劑,最初分離于卵巢癌患者尿液,又名腫瘤相關組織抑制劑(tumor associated tissue inhibitor,TATI)[1]。此后,SPINK1 被發現過表達于多種腫瘤,如乳腺癌、卵巢癌、前列腺癌等[2-3]。SPINK1的結構與表皮生長因子(epidermal growth factor,EGF)相似,可通過激活EGFR/MAPK信號通路刺激腫瘤細胞增殖從而影響腫瘤進展,還可促進上皮-間充質轉換(epithelial-mesenchymal transition,EMT)參與腫瘤轉移[4-8]。
目前有多項研究對血清、腫瘤組織以及尿液進行了分析,發現了SPINK1作為生物標志物的潛在價值[3]。然而,SPINK1在肺腺癌患者血液中的表達情況如何尚不清楚。因此,筆者通過測定肺腺癌患者血清SPINK1濃度,分析其與癌組織SPINK1蛋白表達水平的相關性以及其與臨床病理特征之間的關系,探討其作為血清標志物對浸潤性肺腺癌的潛在診斷價值,現報道如下。
1 對象和方法
1.1 對象 收集2014年1月至2019年12月在浙江大學舟山醫院接受肺葉切除手術或肺楔形切除手術的153例肺腺癌患者的術前血液樣本及手術標本,患者男55例,女98例,平均年齡56.2歲;其中原位腺癌38例,微浸潤性腺癌39例,浸潤性肺腺癌76例。選擇同期本院健康志愿者28例血液樣本,志愿者男10例,女18例,平均年齡55.7歲。兩組受試者性別、年齡比較差異均無統計學意義(均P>0.05)。本研究經本院醫學倫理委員會批準,所有對象均知情同意。
1.2 方法 兩組受試者均采集清晨空腹血2 ml。采血后立即離心,分離血清,保存于-80°C冰箱備用。
1.3 血清SPINK1濃度的檢測 采用ELISA法。按ELISA試劑盒(Human SPINK1 Duoset,R&D system,USA)說明書操作。將所有稀釋的樣品和標準品加入孔中,室溫下孵育2 h,棄上清液,用洗滌緩沖液洗小孔3次,洗滌完畢后加入已稀釋的SPINK1抗體,室溫孵育2 h。再次用洗滌緩沖液洗3次,每孔加入100 μl稀釋的辣根過氧化物酶,室溫孵育20 min。用洗滌緩沖液洗3次后每孔中加入100 μl底物,室溫避光孵育20 min,加反應終止液終止反應,上機檢測450 nm處吸光度,根據標準曲線公式計算每個小孔中的SPINK1濃度。所有檢測的血清樣本以及標準樣本和空白對照均重復檢測3次。
1.4 肺腺癌患者癌組織及癌旁組織中SPINK1 mRNA的檢測 采用熒光定量PCR法。將肺組織放入研磨器中,按照重量體積1∶9的比例加入1×PBS緩沖液,充分研磨后按4℃、3 000r/min、15 min離心,棄上清液,加入1 ml Trizol液并充分混勻后提取RNA。以提取的RNA為模板進行反轉錄,產物即cDNA,放于-20℃備用。采用SYBR Green Realtime PCR Master Mix(Applied Biosystems)進行 qRT-PCR,并在 ABI 7500(Thermo,Waltham,MA) 按以下條件下運行:95 ℃10 min,然后在95℃ 15 s變性,60℃ 1 min退火,72℃ 15延伸的40個循環中運行。末次循環后行熔解曲線檢測反應產物單一性。SPINK1引物序列如下,上游引物:5'-ATATGACCCTGTCTGTGGGAC-3',下游引物:5'-CAGCAAGGCCCAGATTTTTGA-3',擴增的基因片段長度為114 bp。以GAPDH為內參,采用2-ΔΔCT法計算SPINK1 mRNA的表達水平。
1.5 肺腺癌患者癌組織及癌旁組織SPINK1蛋白表達檢測 采用免疫組織化學染色法。每個手術切除的組織樣本經多聚甲醛溶液固定、石蠟包埋,連續切取4個4 μm厚切片。經如下步驟:脫蠟、封閉、抗原修復,滴加小鼠抗人SPINK1單克隆抗體(Abcam)、沖洗、滴加生物素二抗、沖洗、顯色。在染色過程中,以磷酸鹽緩沖液代替原代抗體的切片作為陰性對照。由2位病理科副主任醫師評價免疫反應染色強度(stainingintensity,si)和陽性細胞百分比(positivepercent,pp),并對染色結果進行評分。si評分:0分為未見陽性細胞,1分為細胞陽性染色最強處呈現弱陽性,2分為陽性,3分為可見強陽性染色的細胞。pp評分:0分為無染色陽性區域,1分為陽性染色區域≤10%,2分為陽性染色區域11%~50%,3分為陽性染色區域51%~80%,4分為陽性染色區域>80%。免疫組化染色得分=si分值×pp分值。最后按照得分分為高表達組(7~12分)與低表達組(0~6分)。
1.6 統計學處理 采用SPSS 18.0統計軟件。計量資料以表示,組間比較采用兩獨立樣本t檢驗。計數資料組間比較采用χ2檢驗。血清SPINK1濃度與癌組織SPINK1 mRNA表達水平的關系分析采用Pearson相關;浸潤性肺腺癌的預測因素分析采用單因素及多因素logistic回歸;通過繪制血清SPINK1以及癌胚抗原(CEA)的ROC曲線,評價血清SPINK1對浸潤性肺腺癌的診斷價值。P<0.05為差異有統計學意義。
2 結果
2.1 肺腺癌患者與健康志愿者血清SPINK1濃度的比較 浸潤性肺腺癌患者血清SPINK1濃度為(1 868±105.5)pg/ml明顯高于健康志愿者的(842.0±70.36)pg/ml、原位腺癌的(966.2±75.18)pg/ml、微浸潤性腺癌的(1 076±60.40)pg/ml,差異均有統計學意義(均 P<0.01);而原位腺癌、微浸潤性腺癌患者與健康志愿者間比較差異均無統計學意義(均P>0.05)。
2.2 血清SPINK1濃度與肺腺癌組織SPINK1 mRNA水平的相關性分析 血清SPINK1濃度與癌組織SPINK1 mRNA表達水平呈正相關(r=0.277,P=0.014),見圖1。以肺腺癌患者血清SPINK1濃度的平均值1 419 pg/ml為臨界值,分為血清SPINK1高濃度組71例和低濃度組82例,對比兩組患者癌組織SPINK1蛋白表達水平,結果發現,血清SPINK1低濃度組在SPINK1蛋白低表達組中上占29%,高濃度組在SPINK1蛋白低表達組中上占17%,血清SPINK1低濃度組在SPINK1蛋白高表達組中上占13%,高濃度組在SPINK1蛋白高表達組中上占41%,差異有統計學意義(P<0.05),見圖2。典型患者肺腺癌組織和相應癌旁組織SPINK1蛋白表達見圖3。
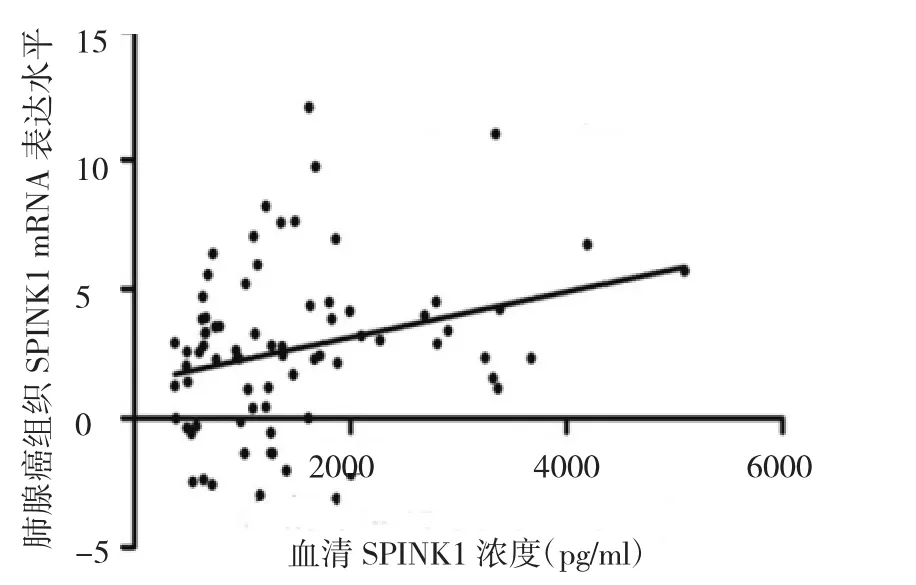
圖1 血清分泌型絲氨酸蛋白酶型抑制劑Kazal 1(SPINK1)濃度與癌組織SPINK1 mRNA表達水平的散點圖

圖2 血清分泌型絲氨酸蛋白酶型抑制劑Kazal 1(SPINK1)高濃度組與低濃度組患者癌組織SPINK1蛋白表達水平比較

圖3 典型患者免疫組織化學染色病理檢查圖(a:肺腺癌組織;b:相應癌旁組織;×200)
2.3 肺腺癌患者血清SPINK1濃度與臨床病理特征的關系 高濃度組與低濃度組患者在性別、年齡、吸煙史、淋巴結轉移和胸膜侵犯間比較差異均無統計學意義(均P>0.05),而在病理類型、腫瘤大小以及 TNM分期間比較差異均有統計學意義(均P<0.05),見表2。
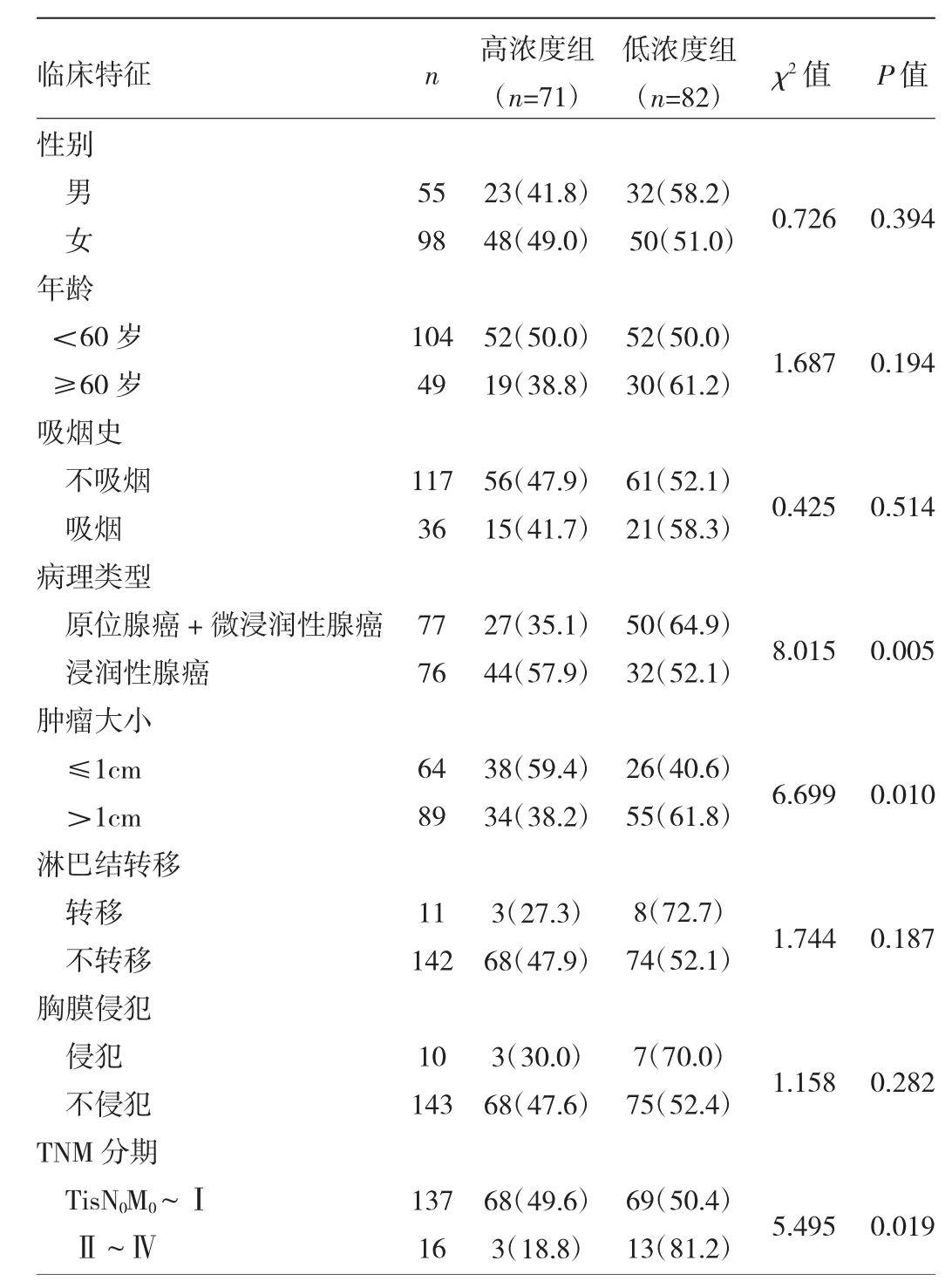
表2 肺腺癌患者血清SPINK1濃度與臨床病理特征的關系[例(%)]
2.4 浸潤性肺腺癌預測因素分析 單因素分析發現,血清SPINK1濃度、CEA和腫瘤大小與浸潤性肺腺癌發生的風險有關。進一步多因素分析顯示,血清SPINK1濃度、CEA和腫瘤大小是浸潤性肺腺癌的獨立預測因素。見表3。
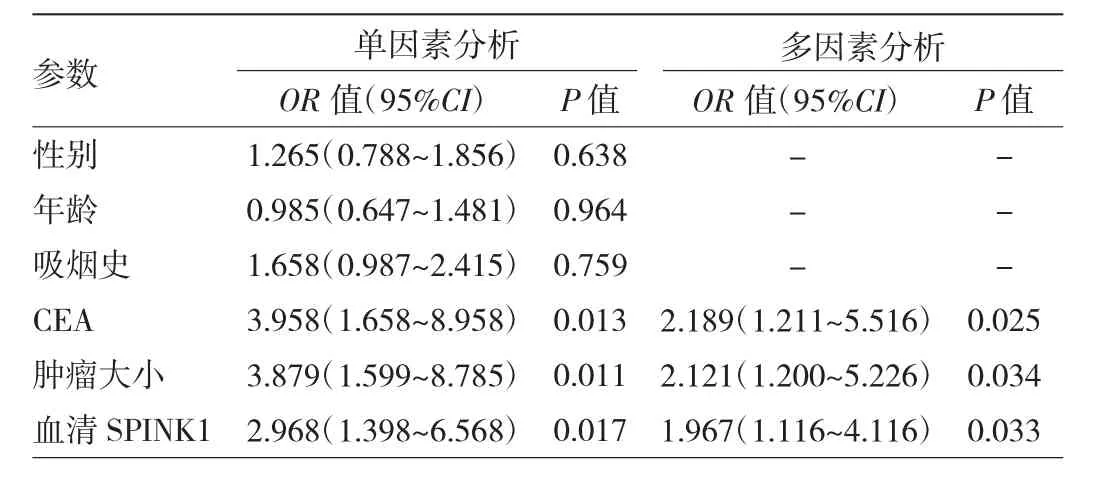
表3 浸潤性肺腺癌預測因素分析
2.5 血清SPINK1濃度、CEA對浸潤性肺腺癌的診斷價值 血清SPINK1濃度診斷的AUC為0.83,最佳截斷值為1 288.5729 pg/ml,靈敏度為0.743,特異度為0.827。而CEA診斷的AUC為0.73,最佳截斷值為1.975pg/ml,靈敏度為0.586,特異度為0.800。見圖4。
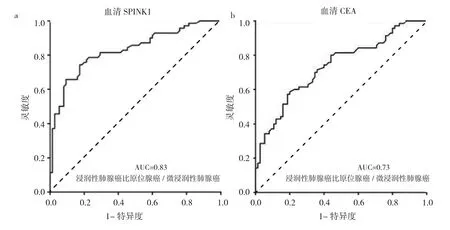
圖4 血清分泌型絲氨酸蛋白酶抑制劑Kazal 1(SPINK1)濃度和癌胚抗原(CEA)診斷浸潤性肺腺癌的ROC曲線(a:血清SPINK1濃度;b:CEA)
3 討論
研究發現SPINK1的氨基酸序列與表皮生長因子(EGF)相似[9]。因此,SPINK1被認為可能是一種自分泌或旁分泌生長因子。有研究證實,SPINK1在多種惡性腫瘤血液中可被檢測到,但在肺腺癌血液中的研究還鮮有報道[10-11]。本研究前期發現,SPINK1在肺癌組織高表達并與預后相關,在此基礎上進一步探討了肺腺癌血清SPINK1濃度及其在組織中表達水平的關系以及與臨床病理特征的關系,以及其作為浸潤性肺腺癌診斷的潛在標志物的可行性。
已有研究發現,大多數胰腺癌患者SPINK1血清濃度明顯升高[10]。另一項研究也發現,肝癌患者血漿SPINK1濃度亦顯著升高[11]。在50%的結直腸癌患者中亦觀察到血清SPINK1濃度升高并且與預后相關[12]。本研究發現,與健康志愿者相比,肺腺癌患者血清SPINK1表達上調,與目前的研究結果相一致。前期研究發現,與癌旁組織相比,肺腺癌組織SPINK1表達上調。在此基礎上,筆者進一步分析了血清SPINK1濃度與癌組織SPINK1表達水平的相關性,結果發現血清SPINK1濃度與癌組織SPINK1 mRNA表達水平呈正相關,與癌組織SPINK1蛋白表達水平亦呈正相關,提示血清SPINK1濃度隨著癌組織SPINK1表達水平變化而變化,提示血清濃度可反映癌組織SPINK1表達水平,具有作為血清診斷標志物的潛力。
本研究進一步分析了肺腺癌患者血清SPINK1濃度與臨床病理特征的關系,結果發現,高濃度組與低濃度組患者在不同病理類型、腫瘤大小以及TNM分期比較差異均有統計學意義。本研究發現,與原位腺癌與微浸性肺腺癌組相比,浸潤性肺腺癌相血清SPINK1高濃度者占比較高。2011年公布的肺腺癌新分類標準中指出,原位腺癌與微浸性肺腺癌,這兩類患者若接受根治性手術,則其疾病特異性生存率分別為100%或接近100%,而浸潤性肺腺癌生存率相對較低。因此,原位腺癌與微浸潤腺癌被認為是早期腺癌階段,而浸潤性肺腺癌惡性程度較高。筆者發現,與腫瘤大小≤1 cm組相比,>1 cm組肺腺癌血清SPINK1高濃度者占比較高;與TisN0M0~Ⅰ組相比,Ⅱ~Ⅳ分期組血清SPINK1高表達者占比亦較高。以上結果提示,血清SPINK1可能是惡性程度較高肺腺癌診斷的標志物。筆者進一步探討了SPINK1對浸潤性肺腺癌的診斷效能,結果顯示,AUC可達0.83,靈敏度為0.743,特異度為0.827,表明血清SPINK1對浸潤性肺腺癌具有良好的診斷效能。因此,本研究認為血清SPINK1可作為浸潤性肺腺癌的血清生物標志物。然而,血清SPINK1的確切來源,具體是由哪些類型的細胞分泌而來的尚無直接證據。現有研究報道以及本研究結果提示,血清SPINK1可能是部分腫瘤細胞分泌而來。然而,發表于Nature Communication的一項研究證實,腫瘤微環境基質細胞能夠分泌SPINK1[13]。因此,筆者推測部分血清SPINK1是由腫瘤基質細胞分泌的。分泌的SPINK1在肺腺癌發生、發展中的作用,目前尚不清楚,有待進一步研究。
本研究尚有不足之處。首先,納入的肺腺癌患者尚無5年生存數據,因此,不能分析血清SPINK1與患者預后關系。其次,樣本例數相對較少,需要進一步擴大樣本量。本研究探索的SPINK1作為浸潤性肺腺癌患者血清診斷標志物的可行性,將為肺腺癌的診斷提供新的靶點。

