欖香烯調節大鼠腦缺血再灌注慢性損傷的保護作用及相關機制
鄭月華 韓雪 湯磊磊
腦卒中是全球成年人致殘、致死的主要原因之一,世界范圍內成年人群腦卒中的發病率為25%,而我國則高達39%[1]。缺血性腦卒中是腦卒中中最主要的類型,占69.6%~77.8%[2],目前臨床上最為有效的治療方式是藥物溶栓治療,如重組組織型纖溶酶原激活物(rt-PA)。但rt-PA治療時間窗狹窄,可使腦內出血轉化風險增加,限制了其臨床應用[3]。而腦缺血再灌注(cerebral ischemic/reperfusion,I/R)過程會對腦組織造成二次損傷,導致腦水腫或出血,甚至破壞血腦屏障,因此神經保護劑被認為是治療缺血性卒中更有潛力的藥物。
欖香烯是從我國傳統中藥姜科植物莪術中提取出來的一種中藥單體,已在臨床應用于廣譜惡性腫瘤的治療[4]。研究表明欖香烯可降低腦缺血小鼠腦組織炎癥因子水平,在小鼠全腦缺血模型中亦可通過抗凋亡機制改善急性期神經損傷[5-6]。欖香烯雖然在腦血管病的治療中取得較好療效,然而其在腦缺血慢性期的作用及相關機制并不明確。研究證實氧化應激、炎癥、凋亡和自噬等病理事件參與了腦I/R損傷的病理生理過程,最終導致神經細胞死亡[7]。因此,尋找針對多種機制進行干預的神經保護劑是治療腦缺血的有效策略。本研究以腦缺血大鼠為研究對象,探討欖香烯對腦I/R慢性損傷的保護作用及相關機制,現報道如下。
1 材料和方法
1.1 主要試劑和儀器 欖香烯乳注射液(規格:0.1 g∶20 ml;批號:20190402)購自大連金港制藥有限公司;4%多聚甲醛(批號:190203)購自上海酶聯生物公司;HE試劑盒購自美國Richard-Allan Scientific公司;TTC染色液(批號:BCCC3620)購自美國Sigma公司;原位末端標記法(TUNEL)試劑盒(批號:31124)購自美國 Roche公司;苯甲酰磺酰氟(PMSF)和RIPA組織裂解液均購自上海康成生物科技有限公司;BCA蛋白定量試劑盒、脫脂奶粉、5×蛋白上樣緩沖液和ECL超敏化學發光液均購自武漢谷歌生物科技有限公司;B細胞瘤-2(Bcl-2)抗體、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)抗體、GAPDH抗體、辣根過氧化物酶-羊抗兔IgG二抗和辣根過氧化物酶-羊抗鼠IgG二抗均購自中國武漢proteintech生物技術有限公司;微管相關蛋白輕鏈3(LC3)抗體購自美國Sigma公司;p62抗體購自美國Abcam公司。Leica切片儀(型號:EMUC7)和倒置相差顯微鏡(型號:DMI3000B)均購自德國Leica公司;化學成像分析儀(型號G:BOX)購自英國Syngene公司。
1.2 實驗動物、建模及分組 48只清潔級SD雄性大鼠,體重(220±20)g,購自杭州醫學院實驗動物中心,實驗動物生產許可證號SCXK(浙)2019-0002。飼養條件:溫度(22±3)℃,相對濕度 45%~65%,通風換氣10~15次/h,晝/夜各12 h光照周期循環。動物可自由飲食、飲水。實驗動物使用許可證:SYXK(浙)2019-0011。采用隨機數字表法將SD大鼠分為欖香烯低劑量組(1 mg/kg)、欖香烯高劑量組(10 mg/kg)、模型組和假手術組,每組12只。大鼠大腦中動脈阻斷(middle cerebral artery blockage,MCAO)模型建立參照文獻[8]。欖香烯低劑量組、欖香烯高劑量組和模型組大鼠用10%水合氯醛(400 mg/kg)腹腔注射麻醉,仰臥固定于泡沫板上,剃去頸部毛發,75%乙醇溶液消毒,沿頸正中線切口,分離肌肉和筋膜,分離暴露頸總、頸外和頸內動脈。用動脈夾暫時夾閉頸內動脈,結扎頸總動脈近心端和頸外動脈,在頸總動脈分叉下方4 mm處剪一小口,將線栓(長4 cm,直徑0.25 mm)從開口處插入,插入頸內動脈17~18 mm且遇到有輕微阻力感為止,結扎頸內和頸總動脈遠心端以固定線栓,縫合皮膚。缺血90 min后,拔出線栓再灌注14 d。假手術組大鼠僅暴露頸內外動脈分支,不閉塞大腦中動脈。術后大鼠置于電熱毯上維持體溫36.5~37.5℃。欖香烯溶于0.2 ml 0.9%氯化鈉注射液,腹腔注射,手術當天起連續給藥14 d,1次/d,首次給藥時間為術前30 min;模型組和假手術組大鼠腹腔注射0.2 ml 0.9%氯化鈉注射液。
1.3 方法
1.3.1 大鼠神經功能缺損評分測定 采用Longa等[8]報道的評分標準,各組隨機取6只大鼠在給藥14 d后進行評分。評分標準:未見明顯異常為0分;將大鼠尾巴提起后其對側前爪不能完全伸展為1分;大鼠向對側轉圈為2分;大鼠損傷側癱瘓或傾倒,出現重度神經功能損傷為3分;大鼠無自發性走,意識喪失為4分。
1.3.2 大鼠腦梗死體積檢測 上述每組6只大鼠行TTC染色。大鼠麻醉后,進行0.9%氯化鈉溶液心臟灌流,待血液完全流盡后斷頭取腦,剔除嗅球、小腦和低位腦干,-20℃冷凍20 min后沿冠狀面切成厚度約2 mm的5張切片,并置于2%TTC染色液中充分浸泡,37℃避光孵育30 min,再置于4%多聚甲醛溶液中固定過夜,取出切片進行拍照。染色呈紅色為正常腦組織,白色為梗死組織。采用Image J圖像分析軟件測量腦梗死體積。腦梗死面積(%)=(5片大腦非缺血側梗死面積-5片大腦缺血側未梗死面積)/5片大腦腦總面積×100%。腦梗死面積乘以厚度(2 mm)后即為腦梗死體積[9]。
1.3.3 大鼠腦組織皮層神經元形態觀察 每組再隨機抽取3只大鼠,處死方法同上,取出腦組織后置于4%多聚甲醛室溫固定24 h,梯度乙醇溶液脫水,二甲苯透明,石蠟包埋。4 μm厚度切片,HE染色后在光學顯微鏡下觀察皮層組織并拍照。
1.3.4 大鼠腦組織皮層神經元凋亡數檢測 采用TUNEL染色。將上述各組3只大鼠腦組織石蠟切片用抗神經元核抗體4℃孵育過夜,PBS清洗3遍,TUNEL試劑37℃孵育1 h,在顯微鏡下觀察并拍照,用Image J圖像分析軟件計算皮層神經元凋亡數。
1.3.5 Bcl-2、Caspase-3、LC3-Ⅱ、LC3-Ⅰ、p62 表達水平檢測 采用Western blot法。每組剩余的3只大鼠同上述方法處死后取出腦組織,用鑷子小心分離出大腦皮層組織,立即凍存于-80℃冰箱。檢測時取出樣本置于冰上融化,稱取100 mg皮層組織放入含PMSF的500 μl裂解液中,加入鋼珠,在研磨器上震蕩研磨,90 Hz,60 s,裂解后的組織12 000 r/min、4℃離心15 min,收集上清液。每組上樣30 μg,聚丙烯酰胺凝膠電泳分離膠(SDSPAGE)電泳分離蛋白,轉至聚偏氟乙烯(PVDF)膜上,5%脫脂奶粉封閉 1 h,分別加入 Bcl-2(1∶1 000)、Caspase-3(1∶800)、LC3B(1∶800)、p62(1∶800)和 GAPDH(1∶1 000)一抗在4℃搖床孵育過夜,三乙醇胺+Tween緩沖鹽溶液(TBST)清洗3次,每次5 min。加入二抗(1∶3 000)室溫孵育1.5 h,使用TBST清洗3次,每次5 min。在暗室中使用ECL顯色后用化學成像分析儀獲取蛋白條帶,GAPDH作為內參,使用Image J軟件進行灰度值分析。
1.4 統計學處理 采用Prism 8.0統計軟件。計量資料以表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 4組大鼠神經功能缺損評分比較 與假手術組相比,模型組大鼠神經功能缺損評分明顯升高,差異有統計學意義(P<0.01);與模型組相比,欖香烯低劑量和高劑量組大鼠神經功能缺損評分均明顯降低,差異均有統計學意義(均P<0.05)。見表1。

表1 4組大鼠神經功能缺損評分比較(分)
2.2 4組大鼠腦梗死體積比較 與假手術組相比,模型組大鼠腦梗死體積明顯增大,差異有統計學意義(P<0.01);與模型組相比,欖香烯低劑量和高劑量組大鼠腦梗死體積均明顯縮小,差異均有統計學意義(均P<0.05)。見表2和圖1(插頁)。
表2 4組大鼠腦梗死體積比較(%)
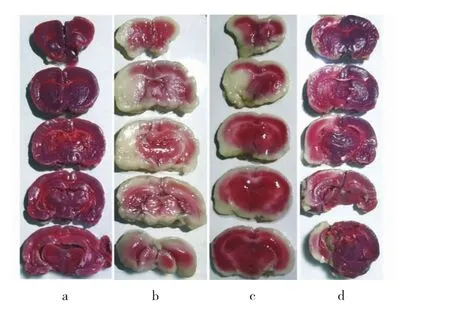
圖1 4組大鼠腦梗死體積TTC染色圖(a:假手術組;b:模型組;c:欖香烯低劑量組;d:欖香烯高劑量組)
2.3 4組大鼠腦組織皮層神經元形態比較 HE染色結果顯示,除假手術組外,模型組、欖香烯低劑量組和欖香烯高劑量組大鼠腦組織皮層神經元均出現細胞核固縮、不規則,碎片化。與模型組相比,欖香烯低劑量組和欖香烯高劑量組大鼠腦組織皮層神經元細胞核畸形有所改善。見圖2(插頁)。

圖2 4組大鼠皮層神經元形態HE染色圖(a:假手術組;b:模型組;c:欖香烯低劑量組;d:欖香烯高劑量組;黑色箭頭指示畸形神經元,標尺:100 μm;×200)
2.4 4組大鼠腦組織皮層神經元凋亡數比較 TUNEL染色結果顯示,與假手術組相比,模型組大鼠皮層神經元核固縮明顯,呈碎片狀、深棕色顆粒,神經元凋亡數明顯增加,差異有統計學意義(P<0.01);與模型組相比,欖香烯低劑量組和欖香烯高劑量組大鼠腦組織皮層神經元凋亡數均呈不同程度降低,差異均有統計學意義(均P<0.01)。見表3和圖3(插頁)。
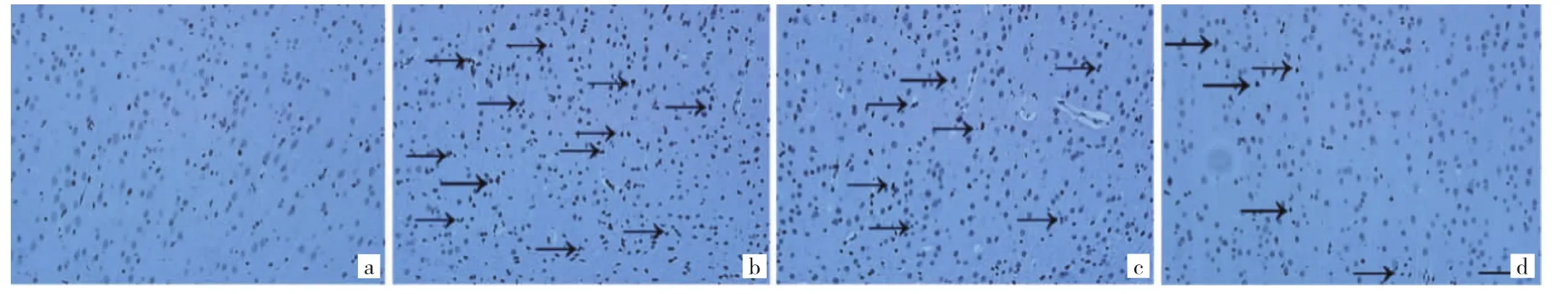
圖3 4組大鼠皮層神經元TUNEL染色圖(a:假手術組;b:模型組;c:欖香烯低劑量組;d:欖香烯高劑量組;黑色箭頭指示凋亡的神經元,標尺:100 μm;×200)

表3 4組大鼠皮層神經元凋亡數比較(個)
2.5 4 組大鼠腦組織 Bcl-2、Caspase-3、LC3-Ⅱ、LC3-Ⅰ、p62表達水平比較 與假手術組相比,模型組Bcl-2、p62表達水平均明顯下調,Caspase-3表達水平、LC3-Ⅱ/LC3-Ⅰ比值明顯上調,差異均有統計學意義(均P<0.01);與模型組相比,欖香烯高劑量組Bcl-2表達水平明顯上調,欖香烯高劑量和低劑量組Caspase-3表達水平、LC3-Ⅱ/LC3-Ⅰ比值均明顯下調,p62表達水平均明顯上調,差異均有統計學意義(均P<0.01)。見圖4、5和表4。

表4 4組大鼠凋亡和自噬蛋白表達水平比較

圖4 4組大鼠皮層凋亡蛋白表達的電泳圖(a:假手術組;b:模型組;c:欖香烯低劑量組;d:欖香烯高劑量組;Caspase-3為半胱氨酸天冬氨酸蛋白酶-3;Bcl-2為B細胞瘤-2)
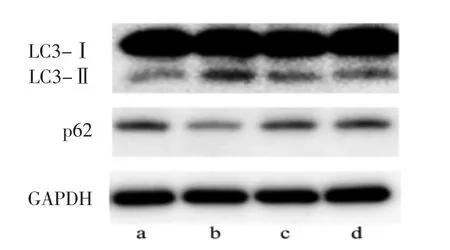
圖5 4組大鼠皮層自噬蛋白表達的電泳圖(a:假手術組;b:模型組;c:欖香烯低劑量組;d:欖香烯高劑量組;LC3為微管相關蛋白輕鏈3)
3 討論
腦卒中是指腦內動脈狹窄、閉塞或破裂造成腦血液循環障礙的一種神經性疾病,目前研究主要集中于缺血性腦卒中。針對缺血性腦卒中的治療策略,首選溶栓治療。然而,臨床缺血性腦卒中的溶栓率和rt-PA的使用率均很低[10],目前尚缺乏有效治療腦缺血的神經保護藥物。因此,深入探索缺血性腦卒中的發病機制,尋找治療腦缺血的有效措施具有積極的意義。
莪術作為姜科植物的根莖,具有行氣破血、消積止痛的功效,欖香烯是其揮發油中提取的單體[11],它是我國自行開發研制的國家級二類廣譜抗腫瘤新藥,在臨床上常用作抗腫瘤輔助藥物。欖香烯靜脈或口服給藥后,均有部分藥物可通過血腦屏障進入腦組織[12]。研究表明,欖香烯通過抗炎和抗凋亡機制可改善全腦缺血急性損傷[6],欖香烯還可通過調節小膠質細胞RAC1蛋白/蛋白激酶3/p38信號通路改善敗血癥誘導的小鼠腦損傷,提高學習記憶能力[13]。另有研究也發現,100 mg/kg欖香烯能顯著改善外傷性腦損傷鼠神經功能評分[14]。本研究采用MCAO模型大鼠缺血1.5 h再灌注14 d,結果顯示經欖香烯處理能顯著提高腦I/R 14 d后神經功能評分,減少腦梗死體積;而從形態學觀察發現,欖香烯可改善大腦皮層神經元損傷情況。本研究結果提示,欖香烯對MCAO模型大鼠慢性損傷具有神經保護作用。
腦缺血再灌注引發了一系列缺血級聯反應,最終觸發神經元凋亡和神經功能損傷。研究表明興奮性毒性、凋亡、自噬和炎癥作為腦I/R的關鍵分子事件,在正向反饋中觸發彼此,參與腦缺血損傷病理過程[15],靶向這些機制顯示出良好的神經保護作用。腦缺血后數小時稱為急性期,主要病理過程為神經元損傷和炎癥反應;腦缺血慢性期出現在缺血后數天至數月,本研究采用大鼠I/R 14 d作為腦缺血慢性期模型,持久的缺血觸發神經元自噬上調,可誘導細胞發生自噬性死亡[16-17]。在小鼠持續性MCAO模型中缺血誘導小膠質細胞自噬,造成腦損傷,自噬抑制劑3-MA可顯著減少腦梗死、腦水腫和神經功能缺陷,提示過度自噬參與了腦缺血損傷過程[18]。研究發現欖香烯可通過調節磷脂酰肌醇-3-羥激酶/蘇氨酸激酶/雷帕霉素靶蛋白信號通路誘導人非小細胞肺癌細胞A549發生保護性自噬[19],表明欖香烯參與自噬活性的調節,然而其在腦缺血慢性損傷中對自噬的影響還不明確。泛素結合蛋白p62在靶向錯誤折疊的蛋白通過自噬溶酶體途徑降解,在抑制線粒體凋亡和氧化應激方向發揮重要作用。p62與LC3相結合形成復合物,通過氮端的PB1結構域與LC3-Ⅱ結合,參與自噬小體的形成,并在自噬溶酶體中降解,引發自噬,因此兩者可以看作自噬體的標記蛋白[20]。本研究發現,欖香烯能夠顯著抑制腦I/R 14 d后大鼠皮層LC3-Ⅱ/LC3-Ⅰ比值,提高p62表達水平,提示欖香烯發揮神經保護作用與抑制過度自噬有關。
大量證據表明氧化應激和細胞凋亡是缺血性腦卒中病理生理學中常見的現象,凋亡細胞特征性改變包括細胞皺縮、核破裂和DNA片段化等。Bcl-2及其家族成員是最強大的死亡抑制蛋白之一,并且抑制Caspase-依賴性和Caspase-非依賴性細胞死亡[21]。有研究顯示抑制Caspase-3激活可減少鼠MCAO模型腦梗死體積[22]。欖香烯能夠降低大鼠腦外傷誘導的細胞凋亡,減少TUNEL陽性細胞和Caspase-3表達[14]。本研究結果發現欖香烯可上調Bcl-2表達水平,下調Caspase-3水平,從而顯著減少腦I/R損傷后皮層神經元TUNEL陽性細胞數。以上結果提示欖香烯的神經保護作用是通過抑制過度自噬和凋亡實現的。
綜上所述,欖香烯處理可能通過抑制大鼠腦I/R 14 d后皮層過度自噬和凋亡,而發揮神經保護作用。本研究為腦缺血的治療提供新的研究思路,但欖香烯調控自噬和凋亡的具體分子機制尚需進一步探索。

