基于生物信息學方法鑒別骨關節炎自噬的關鍵基因和途徑
袁長深 容偉明 李 哲 官巖兵 梅其杰 段 戡
1.廣西中醫藥大學第一附屬醫院骨三科,廣西南寧 530023;2.廣西中醫藥大學研究生院,廣西南寧 530000
骨關節炎(osteoarthritis,OA)是一種伴隨結構改變的關節疼痛綜合征,是最常見的關節疾病。目前其發病機制不明確,缺乏有效手段逆轉該病的進程[1],其導致的關節疼痛、殘疾問題較為突出,加之該病容易喪失勞動力,故將其防治作為區域衛生政策的優先事項對待,甚至建議通過修訂有關OA 臨床和公共政策加以重視[2]。
軟骨細胞死亡/存活在OA 發病中起著關鍵作用。在OA 的軟骨細胞中,自噬相關標志物的表達顯著降低,表明自噬可能是OA 重要的發病機制[3],甚至決定OA 的命運[4]。自噬雖不是細胞死亡的方式,但可通過清除受損和功能失調的細胞器和大分子,維持OA軟骨內環境的穩定。通過增強體內自噬平衡機制,可作為延緩關節衰老和降低OA 風險的一種新途徑[5]。
目前關于OA 自噬的研究仍處于早期階段,利用生物信息學方法挖掘自噬參與OA 發生、發展的重要基因及通路,可從一個新角度更好地闡明OA 發病機制,也為開發新藥提供可靠的理論依據。
1 材料和方法
1.1 數據來源
通過美國國立生物技術信息中心建立的GEO 數據庫中的GEO DataSets 檢索窗口,以“Osteoarthritis”為檢索詞,同時限制條目類型為DataSets、研究的類型為Expression profiling by array、種屬類型為homo sapiens 和公開日期為2010 年1 月1 日至2020 年1 月1 日,基于GPL96 平臺,最終篩選得到基因微陣列數據集(GSE55457);該數據集包含10 例正常和10 例OA 關節的滑膜組織,將其分別作為對照組和實驗組。
1.2 差異表達基因篩選
使用R 軟件limma 包對20 例樣品(對照組和實驗組)的表達矩陣進行校正和分位數歸一化,再利用高級的t 檢驗分析并根據假設檢驗對P 值進行校正,篩選出校正后P <0.05 和|logFC|>1 的基因作為差異表達基因(differentially expressed genes,DEGs),并構建火山圖。
1.3 OA 自噬基因的篩選
通過GeneCards 網站使用“自噬”檢索詞獲取自噬相關基因。由于相關性評分被用來表示基因與自噬活性之間的強度,本研究將相關性評分≥1 分的基因作為自噬相關基因。將差異分析獲得的DEGs 與自噬相關基因進行交集,利用R 軟件Venn Diagram 包繪制交集圖,交集基因即為OA 自噬基因。
1.4 GO 和KEGG 富集分析
對篩選出的基因進行GO 和KEGG 富集分析,可清楚其在疾病中的主要功能和途徑,有助于深入研究疾病的機制。通過R 軟件中Bioconductor 軟件包對交集基因進行GO 和KEGG 富集分析,篩選出校正后P <0.05 的結果,再利用ggplot2 包對顯著富集的結果分別進行可視化。
1.5 蛋白質-蛋白質相互作用(proteinprotein interaction,PPI)網絡構建與模塊分析
通過STRING 數據庫在線構建交集基因的PPI網絡,并設定篩選閾值為0.4,獲得交集基因編碼的PPI網絡圖,再將PPI 網絡數據導入Cytoscape 軟件,并使用MCODE 插件進行網絡聚類,以篩選出主要模塊,最后對其基因再次做KEGG 富集分析,比較兩種基因所得信號通路的異同。
1.6 Hub 基因的選擇
使用CytoHubba 插件對PPI 網絡進行拓撲分析,根據度、最大鄰域分量、緊密度、放射性、壓力5 種方法篩選出關鍵基因。
2 結果
2.1 DEGs 的篩選
使用R 軟件對GSE55457 數據集中的20 例滑膜樣品歸一化后,比較各基因在OA 滑膜組織和正常者滑膜組織之間的表達差異,篩選同時符合校正后的P <0.05 和|LogFC|>1 的差異基因,共得到203 個DEGs,包括上調基因55 個和下調基因148 個。見圖1(封三)。
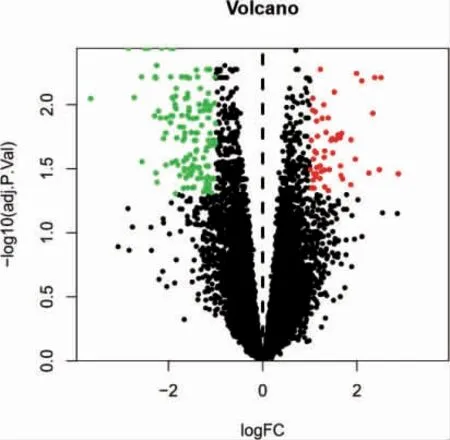
圖1 差異表達分析的火山圖
2.2 OA 自噬基因的篩選
通過GeneCards 網站獲得符合條件即自噬關聯評分≥1 分的自噬基因5786 個,再與DEGs 交集,共獲得65 個OA 自噬基因。見圖2。
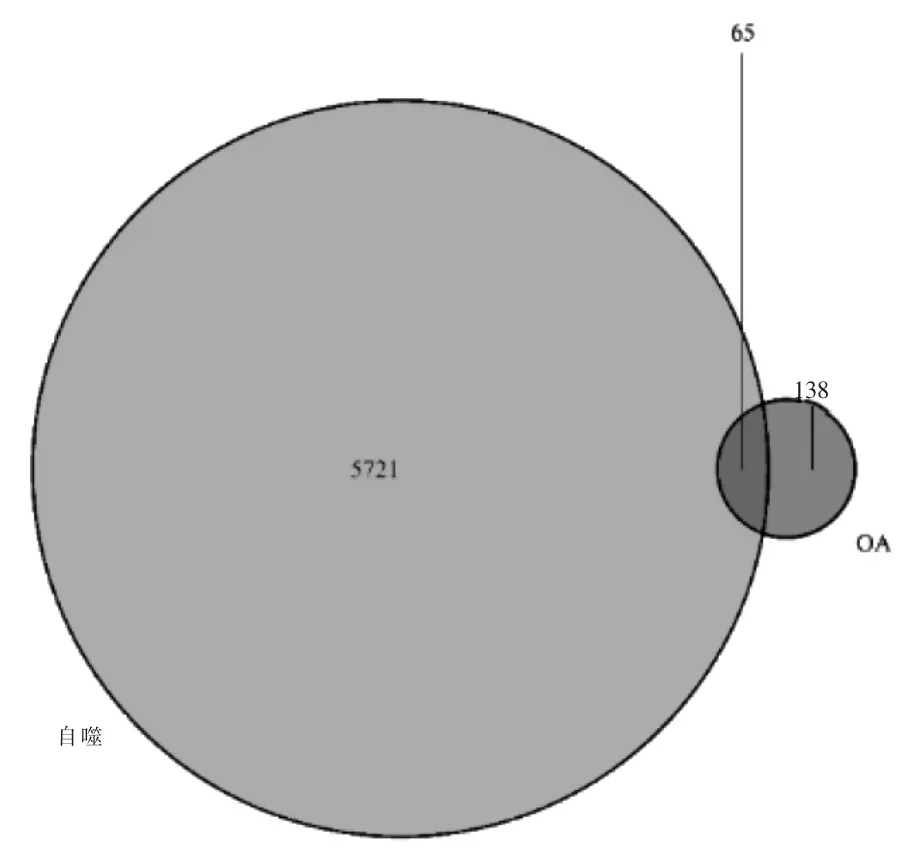
圖2 自噬基因與骨關節炎差異基因的交集
2.3 GO 和KEGG 富集分析
利用R 軟件對篩選出的65 個OA 自噬基因進行GO 和KEGG 富集分析,結果顯示有279 個GO 條目和44 個KEGG 條目;其中與OA 密切相關的GO 分析主要富集在調控DNA 生物合成過程、負調控蛋白質磷酸化、轉移酶活性的負調控和血管生成的調節等(圖3,見封三);與OA 高度相關的KEGG 通路有MAPK、TNF、JAK-STAT 和PI3K-Akt 等通路(圖4,見封三)。
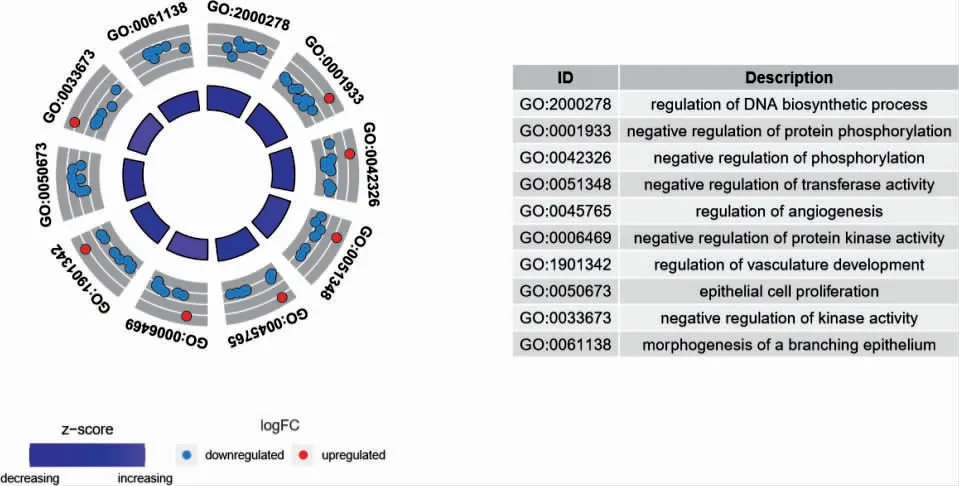
圖3 GO 富集分析結果
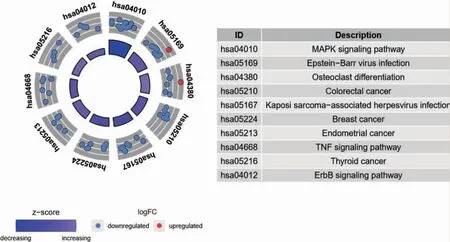
圖4 KEGG 富集分析結果
2.4 PPI 網絡構建與模塊分析
通過STRING 數據庫構建交集基因的PPI 網絡,其節點數目有64 個,邊數是129 條,PPI 網絡的P 值小于1.0e-16(圖5)。另外利用MCODE 插件對網絡進行聚類,得到一個較為重要的模塊,其包含9 個基因(圖6),對其進行KEGG 富集分析得到MAPK、JAKSTAT 和PI3K-Akt 信號通絡較為重要(圖7,見封三),這與OA 自噬基因富集分析得到結果大致相同。
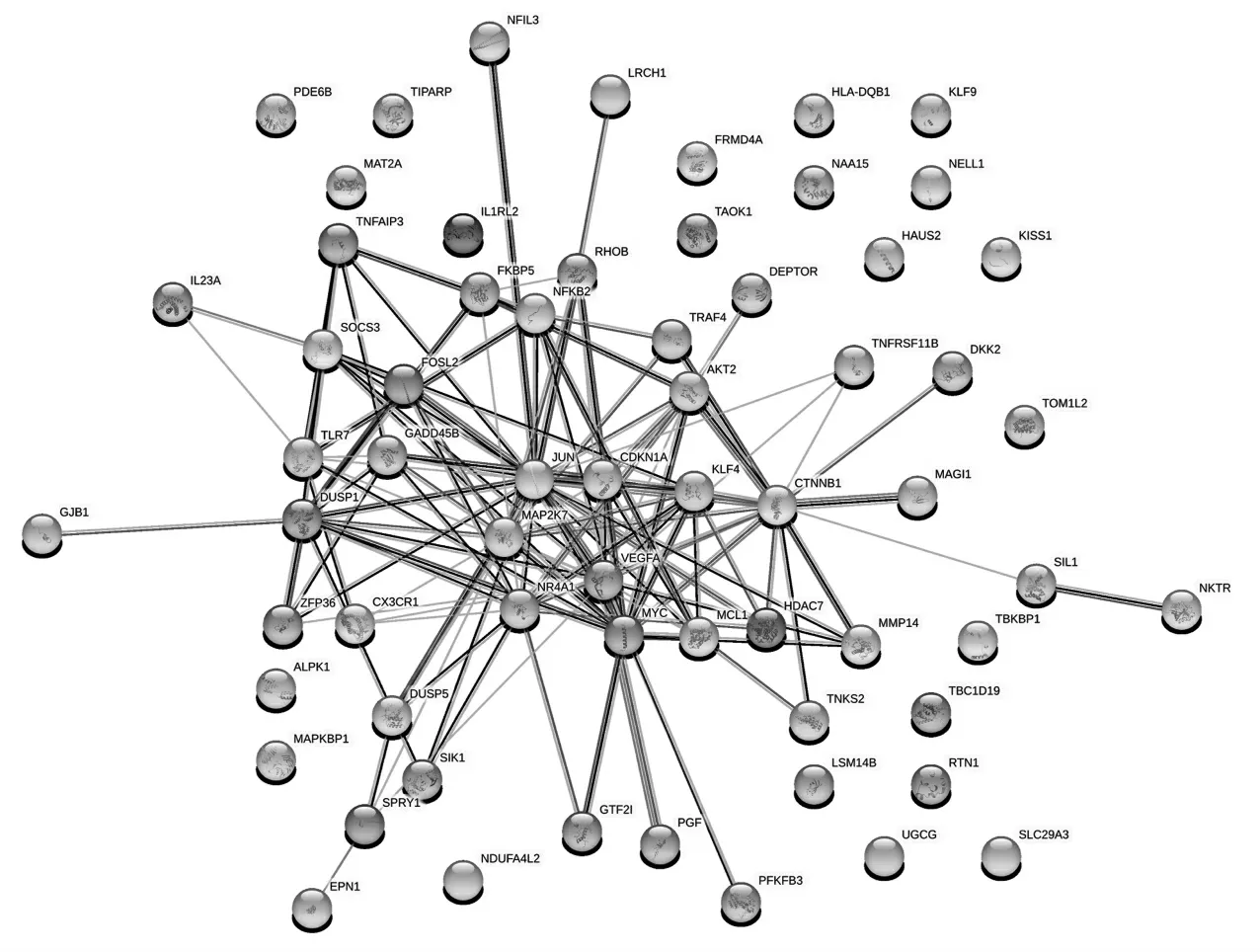
圖5 交集基因的蛋白質-蛋白質相互作用網絡
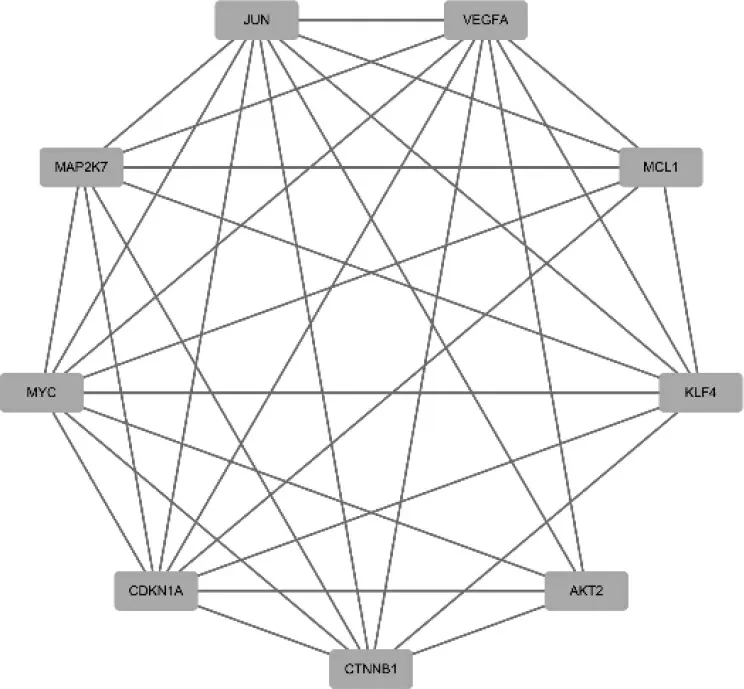
圖6 蛋白質-蛋白質相互作用網絡中較為重要的模塊
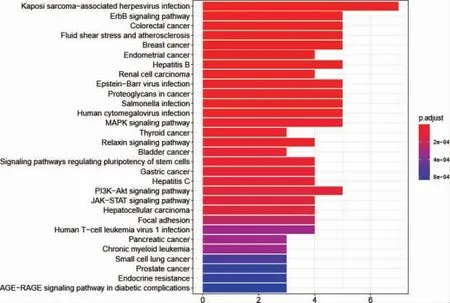
圖7 模塊基因的KEGG 富集分析
2.5 Hub 基因的選擇
本研究通過5 種計算方法均篩選出前10 位的關鍵基因,并利用“Venn”軟件對其進行交集和可視化,獲得7 個關鍵基因,包括VEGFA、JUN、CTNNB1、MYC、NR4A1、MAP2K7 和DUSP1。見圖8。
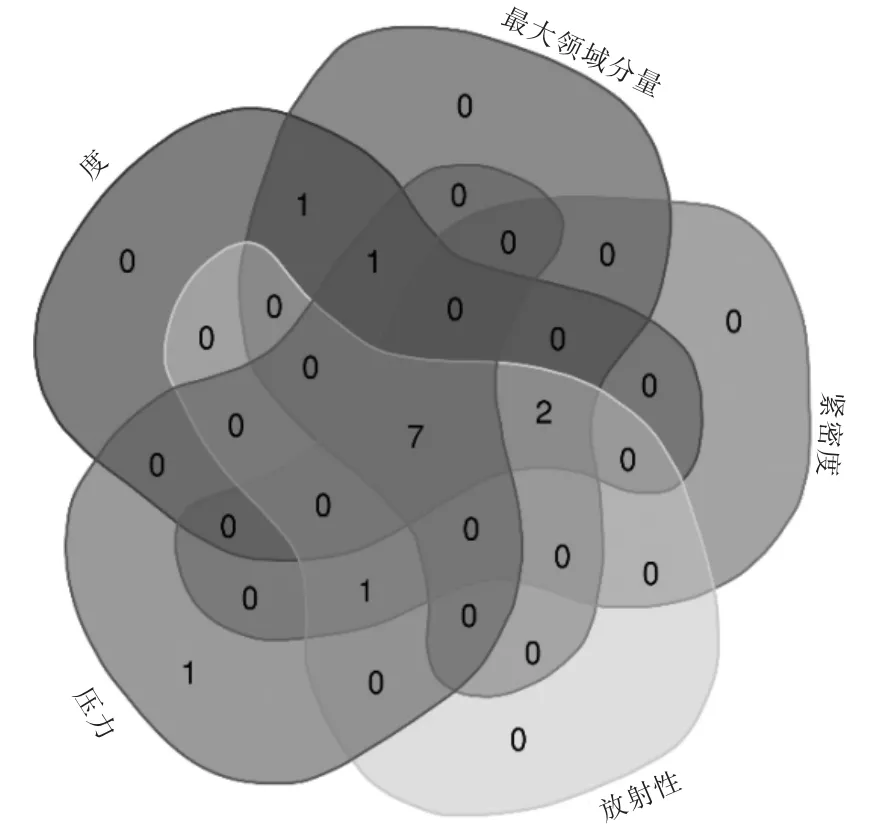
圖8 5 種計算方法前10 個基因的交集
3 討論
OA 是最常見的關節退行性疾病,其發病機制尚未明確,而自噬可能在OA 發病中起到重要作用[3],同時鑒于OA 發病與復雜的細胞因子網絡密切相關[6],因而通過生物信息學挖掘參與OA 發生、發展的自噬重要基因、通路,探究其分子機制。
本研究通過生物信息學分析發現MAPK、JAKSTAT 和PI3K-Akt 通路在OA 自噬中發揮重要作用。在OA 中,MAPK 途徑的激活不僅增加軟骨和滑液中IL-1、TNF-α、NO 和基質金屬蛋白酶-13 的含量[7],而且可抑制自噬的發生[8],同時通過抑制MAPK 通路引起下游反應可有效地控制OA 的進展[7]。JAK-STAT 通路的發生是通過激活JAK 激酶而使STAT 磷酸化,接著2 個磷酸化的STAT 在核內與靶基因啟動子中特異DNA 序列結合,最終調節細胞增殖、分化、凋亡等[9];STAT3 作為一種新的自噬調節劑,其通過與PKR 結合使磷酸化的eIF2A 失活以減少自噬途徑[10],因此JAK-STAT 信號通路也介導著自噬的發生[11],但通過該途徑探討OA 的機制研究甚少,后期可通過實驗進一步探討其相關性。PI3K-AKT 作為調控自噬的經典傳導通路,PI3K 的激活可使Akt 磷酸化并引起下游一系列反應,進而導致軟骨細胞的炎癥反應及自噬相關基因和蛋白表達水平下降[12-13],而通過抑制PI3K/AKT/mTOR 信號通路可提高細胞自噬來改善軟骨的損傷[14]。
此外,本研究通過進一步分析發現了7 個關鍵基因。VEGFA 可引發滑膜增生和軟骨破壞,導致OA 的發生、發展[15-16]。雖然未見有VEGFA 與OA 自噬的報道,但認為由于自噬功能低下而無法抑制VEGFA 表達,可導致腫瘤細胞的持續繁殖,通過激活自噬可有效控制病情發展[17]。JUN 屬于原癌基因c-Jun 的表達產物,在轉導偶聯信息傳遞中起到核內“第三信使”作用。c-Jun在膝骨關節炎軟骨下骨組織中呈高表達狀態[18],可加速OA 軟骨損傷。CTNNB1(又稱“β-catenin”)是Wnt 信號通路必不可少的蛋白,該途徑可調節自噬、細胞凋亡和增殖等[19]。β-catenin 在OA 滑膜組織中呈高表達,不僅可引起滑膜成纖維細胞病理改變[20],而且可抑制軟骨細胞自噬的激活,導致OA 發展[21]。MYC基因家族成員包括c-myc、n-myc 及l-myc,通過影響細胞增殖、分化、自噬和凋亡過程在疾病中發揮作用[22]。c-myc 在OA 軟骨中呈高表達,參與OA 發展[23];有效抑制MYC 表達可增強自噬水平,從而延緩OA 的進程[24]。NR4A1 被認為是調控OA 發展的一種調節劑[25],其作為TNF/p38 細胞信號傳導的下游介質,通過影響軟骨細胞的凋亡或自噬在OA 發展中發揮作用[26]。MAP2K7 是MAPK 信號通路中一種重要的激酶,通過JNK 途徑可調節OA 中的炎癥反應,是研發藥物治療OA 的新靶標[27]。DUSP1(又稱“MKP-1”)可通過MAPK通路發揮對OA 的調控作用[28];另外有研究發現降低或敲除DUSP1 的表達,可促進MAP1/LC3-Ⅱ水平升高,激活細胞自噬[29],因而DUSP1 可能通過自噬影響OA 進展。
本研究通過對OA 基因表達譜芯片數據與OA自噬基因的分析,挖掘出OA 中與自噬激活相關的重要基因、通路,從自噬角度闡明OA 的發病機制,為研究OA 的分子機制提供一種新的思路。然而,本研究根據大數據預測出的分子機制,仍需進一步通過實驗加以驗證。

