基于適配體與聚多巴胺納米粒的熒光內濾效應研究*
張夢麗,蘭慧寧,王雪陽,高一喬,孫祥德,李 娜
(新鄉醫學院藥學院,河南 新鄉 453003)
多巴胺(dopamine, DA)是腦內的一種兒茶酚胺類神經遞質,具有與海洋貽貝分泌的粘附性蛋白成分類似的結構[1-2]。聚多巴胺納米顆粒是一種近年來被廣泛研究的新型納米材料,其合成過程簡單、成本低,具有良好的水溶性和生物相容性[3-4]。適配體[5]是一類通過體外分子進化技術從隨機DNA庫中篩選出的具有高效催化活性和特異性識別功能的DNA片段,它具有結合力強、選擇性好、靶標范圍廣、生物相容性好、易合成和易功能化修飾等優點,為構建各種分子或者離子的熒光探針提供了分子識別的工具。適配體與納米材料的結合既保留了適配體的催化特性和識別能力又引入了納米材料的信號轉導功能,實現了識別與信號轉導功能的一體化,大大促進了生物傳感器的快速發展[5]。基于此,本研究以聚多巴胺納米材料做載體,研究其與具有特異性識別鉛離子能力的適配體之間的內濾效應,為后期構建聚多巴胺-脫氧核酶[7-9]生物傳感器來檢測鉛離子奠定基礎,對環境監控和人類健康具有非常重要的意義。
1 實 驗
1.1 儀器與試劑
RF-5310PC熒光分光光度計,島津企業管理(中國)有限公司;TG16-WS高速臺式離心機,長沙湘儀離心機儀器有限公司;ZNCL-B智能數顯磁力加熱板,河南愛博特科技發展有限公司;Malvern Zetasizer Nano ZS900納米粒徑電位分析儀,英國馬爾文儀器有限公司;KQ2200B超聲波清洗器,昆山市超聲儀器有限公司;NicoletiS50傅里葉變換紅外光譜儀,美國賽默飛。
鹽酸多巴胺,薩恩化學技術(上海)有限公司;氨水,煙臺市雙雙化工有限公司;無水乙醇、異丙醇,天津市德恩化學試劑有限公司;實驗中所用的寡核苷酸序列GR-5 DNAzyme均由寶生物工程有限公司(大連,中國)合成并且通過高效液相色譜法(HPLC)純化;實驗過程所用水均為去離子水。除非特別指明,其它的化學試劑均為分析純,不需要進一步的純化和處理,可以直接使用。
本實驗所用的熒光儀,激發狹縫寬為8 nm,發射光的狹縫寬為8 nm,所用的激發波長為480 nm,發射波長為525 nm。
1.2 聚多巴胺納米粒的制備與表征
1.2.1 聚多巴胺納米粒子(PDANPs)的制備
取22.5 mL超純水置于100 mL的圓底燒瓶中,置于磁力攪拌器上,水浴升溫至30 ℃,依次加入10 mL無水乙醇、0.75 mL氨水,繼續攪拌30 min。準確稱取0.125 g鹽酸多巴胺溶于2.5 mL去離子水中,完全溶解后迅速加入到上述混合液中,攪拌反應24 h。反應結束后,將懸浮液離心,用去離子水洗滌沉淀三次。最后,干燥沉淀以備后續實驗。
1.2.2 聚多巴胺納米顆粒的紅外表征
采用傅里葉變換紅外光譜儀掃描該聚合物的紅外光譜。根據圖譜中各峰的位置,分析并確定納米粒的合成情況。
1.2.3 粒徑與Zeta電位表征
采用動態光散射法測定聚合物膠束的粒徑及粒徑分布,用馬爾文激光散射粒度儀測定其粒徑分布以及Zeta電位。實驗方法:吸取適量樣品,在石英比色皿中測定兩者的粒徑分布,在Zeta電位檢測池中測其Zeta電位。
1.2.4 形貌表征
使用透射電子顯微鏡觀察聚多巴胺復合納米顆粒的形貌特征。實驗方法:先將顆粒分散在水溶液中得到其分散液,然后用去離子水進行適當的稀釋,滴于銅網上,銅網暴露于室溫環境下,待溶劑全部揮發時在透射電子顯微鏡上進行觀測。
1.2.5 穩定性實驗
制備PDANPs,透析48 h后,取透析液在室溫下放置,每隔2 h取樣,測其24 h的粒徑,考察其粒徑變化,重復三次,取粒徑平均值作圖。
1.3 熒光測定
將對鉛離子特異性識別的脫氧核酶GR-5 DNAzyme和不同濃度PDANPs混合,測定其熒光信號的強度。實驗方法:固定酶鏈和底物鏈的濃度30 nM,雜交反應10 min后,加入一系列不同濃度的PDANPs,反應10 min,測定熒光強度。
2 結果與討論
2.1 FTIR結果
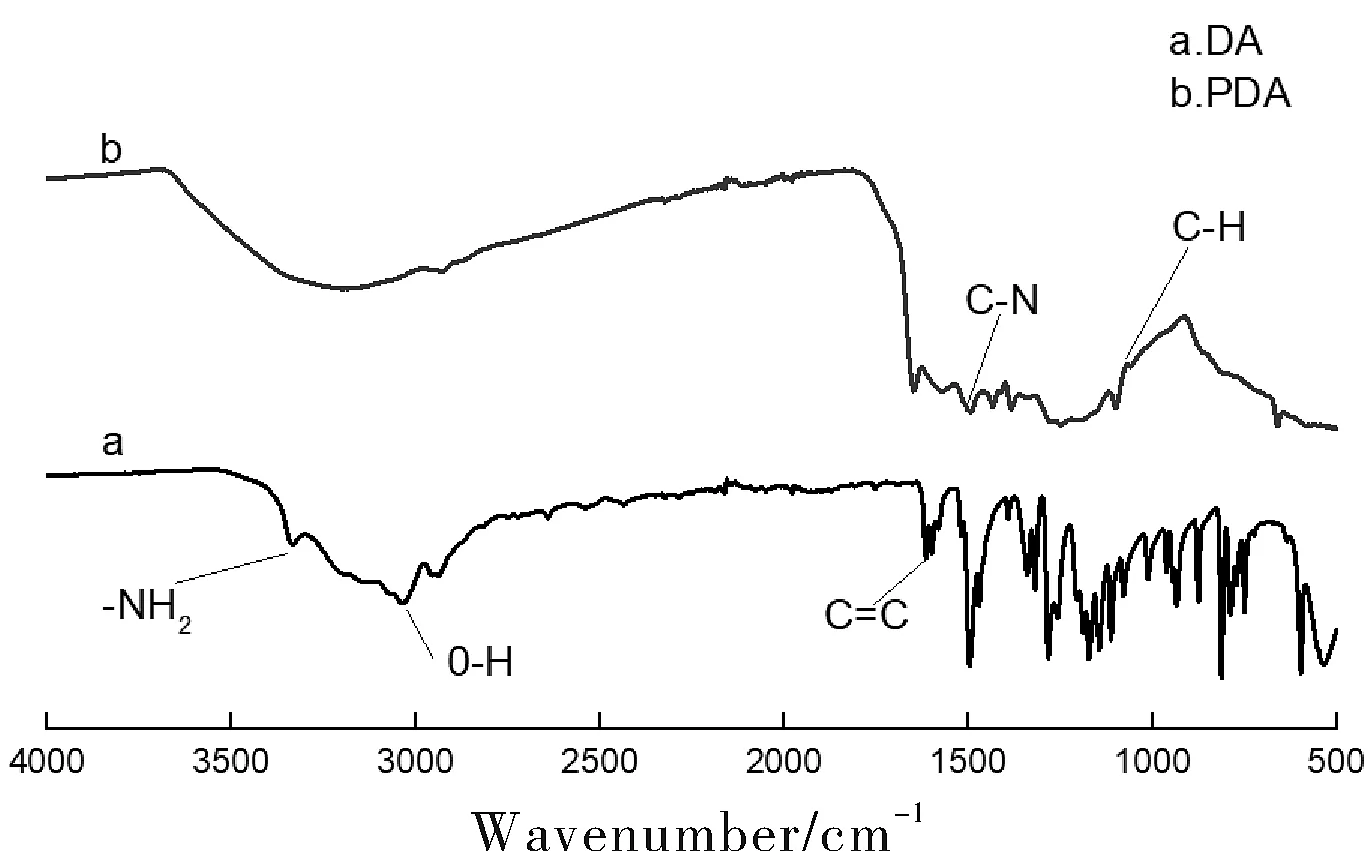
圖1 多巴胺(a)和聚多巴胺(b)的紅外光譜圖Fig.1 Infrared spectra of dopamine (a) and polydopamine (b)
由紅外光譜圖可以看出,多巴胺單體中,3340 cm-1和3210 cm-1處為-NH2的伸縮振動峰,3146 cm-1,3088 cm-1,3070 cm-1,2950 cm-1處為苯環上O-H的不對稱伸縮振動峰,2638 cm-1,2530 cm-1,2400 cm-1處為N-H伸縮振動峰,1611 cm-1處為C=C伸縮振動峰。在聚多巴胺中,在3500~3000 cm-1處的寬峰,是氨基與羥基締合后產生的吸收峰,3340 cm-1處的峰由于伯氨基轉變為叔、仲氨基而消失,1644 cm-1,1504 cm-1處是多巴胺聚合后產生的吲哚結構的特征吸收峰。
2.2 粒徑與Zeta電位
2.2.1 粒徑結果
粒徑是影響納米粒的物理化學特性的重要參數之一。如圖2所示,聚多巴胺納米粒的粒徑平均在270 nm,PDI平均0.1左右,粒徑分布范圍較窄。
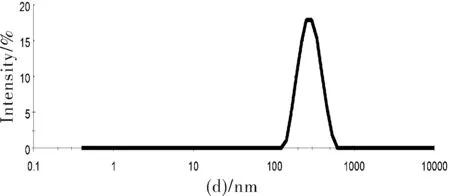
圖2 聚多巴胺納米粒的粒徑分布圖Fig.2 Particle size distribution of polydopamine nanoparticles
2.2.2 Zeta電位結果
Zeta電位是指剪切面的電位,Zeta電位絕對值越高,越不易聚集,反之納米粒間相互斥力減小,穩定性降低。圖3中聚多巴胺納米粒的Zeta電位為28.0,納米粒具有一定程度的穩定性。
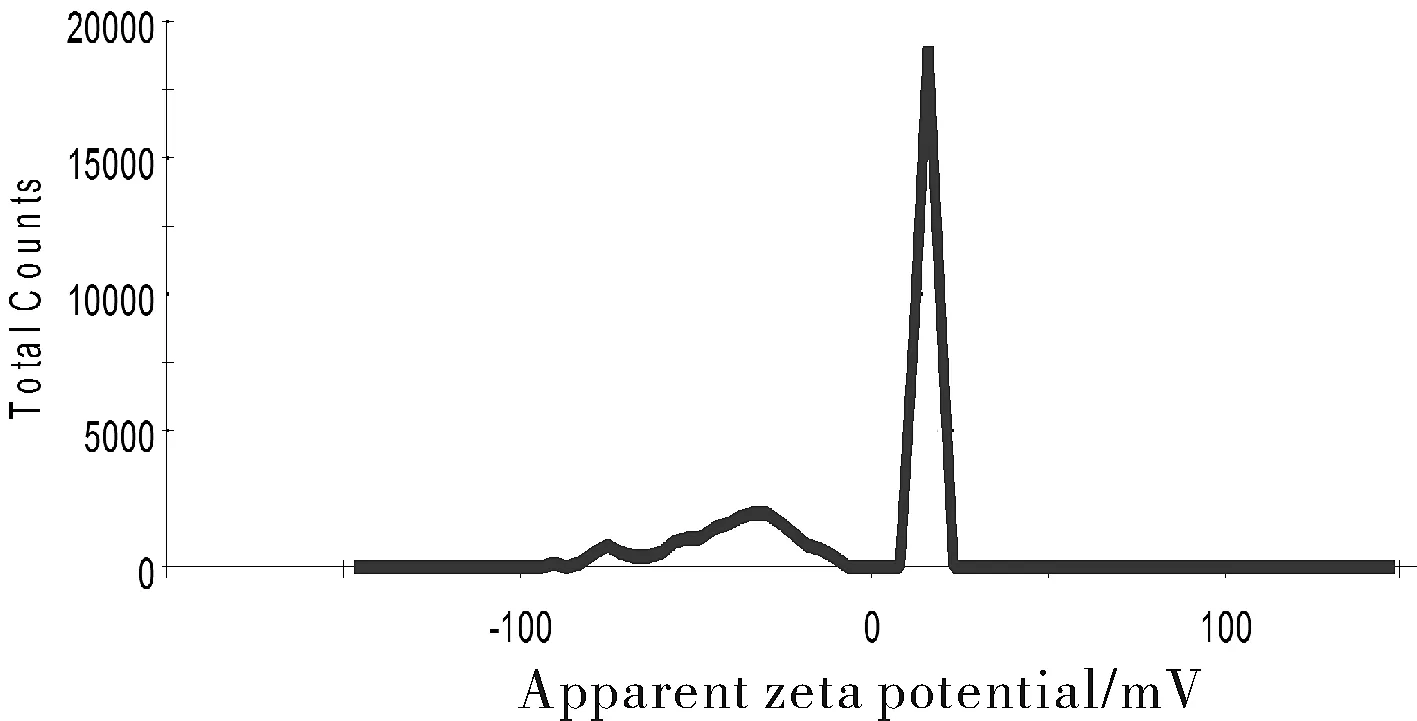
圖3 聚多巴胺電位圖Fig.3 Potential diagram of Polydopamine
2.3 透射電鏡結果
由圖4電鏡圖中可以看出,納米顆粒為均勻的球狀顆粒,尺寸均勻,顆粒之間無明顯粘連,無破損現象。

圖4 聚多巴胺納米粒的透射電鏡圖Fig.4 TEM of polydopamine nanoparticles
2.4 穩定性結果
如圖5所示,制備的聚多巴胺納米顆粒分散性良好,不易發生聚集,在水溶液中能夠保持一定程度的穩定性。
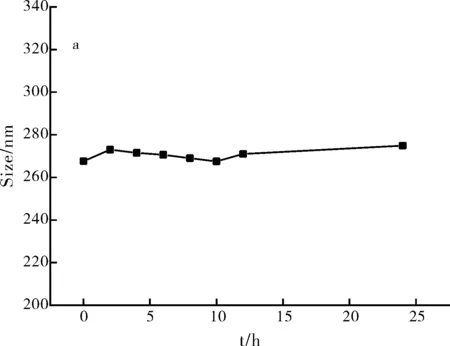
圖5 聚多巴胺納米粒在水中的粒徑變化Fig.5 Particle size changes of polydopamine nanoparticles in water
2. 5 脫氧核酶與和聚多巴胺納米粒的之間的反應機理
采用熒光光譜法和紫外可見吸收光譜法,考察脫氧核酶的激發光譜和聚多巴胺納米粒的紫外-可見吸收光譜。如圖6所示可以看出,在400~700 nm內,脫氧核酶的熒光發射光譜最大發射峰位于525 nm,而聚多巴胺納米粒在200 nm到600 nm區間有較寬的吸收峰,且與聚多巴胺納米粒發射光譜有較好地重疊,因此二者可能會產生熒光內濾效應。
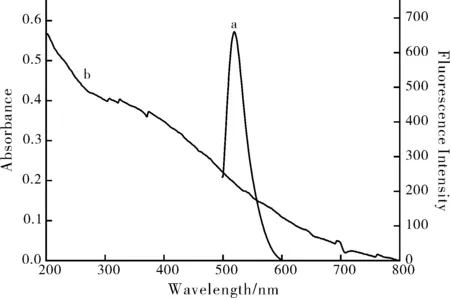
圖6 適配體的熒光發射光譜(a)和聚多巴胺納米粒的 紫外-可見吸收光譜(b)Fig.6 Fluorescence emission spectra of aptamers (a) and UV-visible absorption spectra of polydopamine nanoparticles (b)
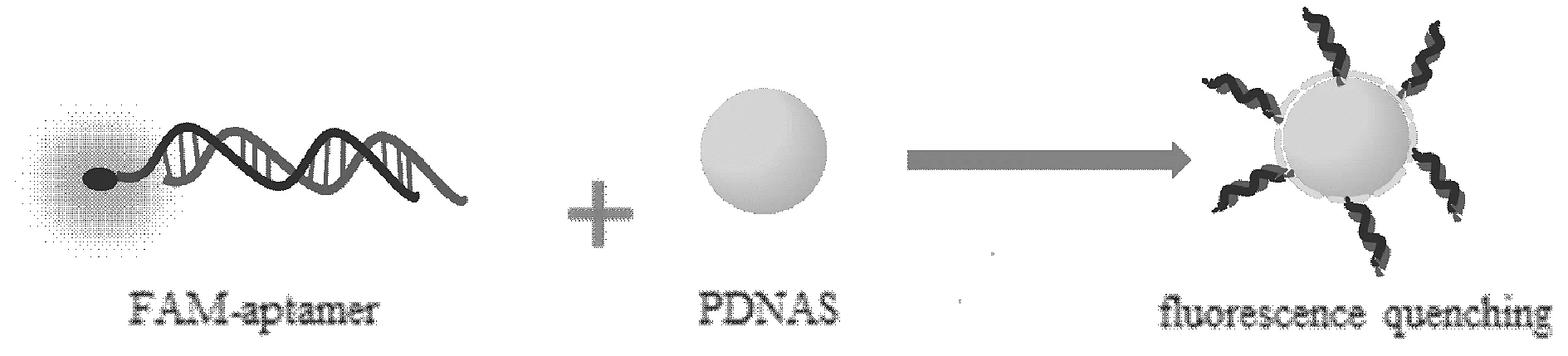
圖7 內濾效應示意圖Fig.7 Diagram of internal filtering effect
2.6 聚多巴胺熒光猝滅能力的考察
隨著聚多巴胺納米粒濃度的逐漸增大,脫氧核酶上熒光團的熒光被逐漸猝滅,并且當聚多巴胺納米粒的濃度達到0.8 mg/mL時,它的熒光猝滅效率達到了96.7%,熒光信號幾乎被猝滅至基線水平。這一結果表明所制備的聚多巴胺納米粒能夠將雜交后的酶鏈和底物鏈吸附在表面,并能使底物鏈上鏈接的羧基熒光素的熒光猝滅,且其熒光猝滅能力較強。

圖8 不同濃度的PDANPs下脫氧核酶的熒光圖Fig.8 Fluorescence spectra of deoxyribozyme under different concentrations of PDANPs
2.7 猝滅機制的確定
熒光猝滅有兩種不同的機制,分別為靜態猝滅和動態猝滅。靜態猝滅即熒光物質分子和猝滅劑形成一種靜態配合物,隨著溫度升高,該配合物穩定性下降,使得靜態猝滅常數減小;動態猝滅是熒光物質分子和猝滅劑之間發生碰撞作用,隨著溫度升高,動態猝滅擴散速率增大,使得動態猝滅常數增大。
根據 Stern-Volmer方程計算:
F0/F=1+kqτ0C=1+KSVC
①
其中: F0-適配體的熒光強度; F-加入聚多巴胺納米粒后適配體的熒光強度; kq-猝滅速率常數,KSV-猝滅常數,C-猝滅劑濃度,τ0-沒有聚多巴胺納米粒存在時適配體熒光分子的平均壽命,約為10-8s。
根據式①,以F0/F 為縱坐標,C為橫坐標作圖可得聚多巴胺納米粒子和適配體體系的Stern-Volmer曲線,如圖9所示
由圖9可得:曲線方程及相關系數為y=10.606x+0.4887, R2=0.9938,由上述信息計算可得:Ksv=10.606 L·mol-1,Kq=1.0606×109L·mol-1s-1,很顯然Kq小于淬滅劑對熒光物質最大擴散控制的碰撞淬滅常數 2.0×1010L·mol-1s-1,由此可以得出結論:聚多巴胺納米粒對適配體的熒光淬滅過程是動態的。
3 結 論
本實驗利用多巴胺氧化自聚合,成功制備了聚多巴胺納米粒,形態圓整、光滑、均一、穩定性好,且分散性良好。并研究了聚多巴胺納米粒和適配體之間的內濾效應,且作用機制是動態猝滅。

