金屬與氫原子相互作用的第一性原理研究進展
劉佳敏
(東北大學材料科學與工程學院,遼寧 沈陽 110819)
一直以來,可擴散氫是導致金屬脆化和焊接冷裂紋產生的主要因素之一,氫對金屬結構性質的降解被稱為氫脆,是一個待解決的典型得科學問題,也是一個很重要技術相關性問題。金屬隨著強度的提高氫致延遲斷裂敏感性變得明顯[1],這是因為氫原子進入材料內部在晶格缺陷處造成局部大應力,使得裂紋形成,在持續受到應力時,會造成材料內部的氫重新分布,這些氫聚集在裂縫尖端,使得裂縫更易于生長最終導致氫脆。金屬中的氫原子主要來源于空氣和化學液計,氫氣以氣態形式進入到金屬的裂縫、空隙或者氣泡中,也有可能以氫原子的形式與金屬原子或者第二相之間發生化學反應形成氫化物而滯留。金屬中影響氫加熱時候的釋放行為的氫捕獲位點稱之為氫陷阱,擴散氫可能被捕獲在位錯[2-4]、晶界[5-6]、空位[7]或顆粒基體界面[3, 8-9]等氫陷阱位置,如果材料中還存在其他相時,氫原子也可能偏聚在母相和第二相的接觸的界面位置。當氫原子被捕獲時,若想逃離該位置需要克服此捕獲位點的活化能才能離開,根據每種位置活化能的大小,可以將捕集位置分為可逆捕獲位點和不可逆捕獲位點,晶界、差排、微孔洞等都屬于可逆捕獲位置,高角度晶界、空位、碳化物等介面等都屬于不可逆捕獲位置[10]。氫陷阱能夠降低可擴散氫濃度,從而影響氫擴散系數和溶解度[11]。有人認為,金屬中析出碳化物和氮化物等第二相顆粒可以作為氫陷阱有效地捕獲氫減少金屬中的可擴散氫,從而降低金屬對氫脆的敏感性[12]。Akihide Nagao等[13]也研究表明了納米尺寸析出物在高強度回火條狀馬氏體鋼中被證明可以增加對氫脆的抵抗;T. Depover等[14]利用熱解吸光譜和滲透實驗對碳化鈦和碳化釩的氫俘獲特性進行了評價,得到第二相析出物對可以有效的降低氫引起的延性開裂傾向。金屬在實際中的應用受制于氫致延遲斷裂的影響,充分了解擴散氫在金屬中的溶解行為和分布規律有助于認清氫致裂紋的形成機理。但是目前研究氫脆的實驗手段較為復雜,并且由于氫原子半徑太小,實驗中不容易測得,而第一性原理計算可以在實驗的基礎上更深入的了解氫脆機理,它能夠克服實驗中樣品制備、性能檢測和表征的困難,只需要通過計算和分析原子相互作用和化學鍵合以及電子結構等情況,便能揭示材料性能變化的物理本質、解釋實驗觀察到的現象及其機理,這些都是目前實驗研究手段難以實現的,第一性原理計算已成為當前材料研究中的重要手段,經過多年來不斷發展已經逐漸成熟,已經得到了廣泛的應用。
1 第一性原理計算方法
第一性原理計算是以量子力學為基礎從最基本的物理原理出發來求解薛定諤方程,通過計算晶胞能量來推算實驗所需要的相對能量,比如偏聚能、溶解熱、捕獲能等等,可以得到材料的物理化學性能來全面了解原子、分子和介觀特征在宏觀行為中的表現。量子力學計算提供了一種手段來理解和預測原子和分子之間的相互作用,并在微觀尺度上模擬化學反應。基于統計力學和連續介質力學的方法可以利用這些信息作為輸入來研究介觀和宏觀行為。該方法的特點是計算過程方便,實驗中需要考慮的因素可以通過經驗參數來調節,計算結果依靠能量準則達到自洽收斂,故可排除一切人為因素的影響。
第一性原理計算方法首先需要理解建模方法的基本思想來建立合理的模型,該方法只需知道原子的結構信息、位置信息、電子信息,便可以通過密度泛函理論精確的計算結構中各個原子之間的相互作用力和電子交互作用,獲得材料中原子的穩定位置信息和電子云的空間分布情況。通過計算彈性模量、體積膨脹量和熱膨脹系數得到材料的塑性、韌性、硬度、強度等力學性能;通過計算晶胞的總能量和晶格常數可以判斷材料的穩定性;通過計算電荷密度分布可以得到原子間的化學鍵鍵和作用,計算態密度和能帶可以得到電子軌道之間的雜化情況[15]。與實驗相比計算模擬不僅能夠在短期內計算出符合需求的實驗,還可以計算出實驗中難以觀測的現象,并從原子的尺度出發解釋微觀作用機理。第一性原理能解決實驗中難以實現的極端條件(0 K溫度下,高溫高壓)下的問題,還能節約實驗成本。目前實現第一性原理計算的主要程序有:VASP、CESTAP、Made A、PWmat、ABINIT。
2 金屬基體對氫原子捕獲的第一性原理研究
已有學者利用第一性原理得到當氫原子被捕獲到基體內部時候,會造成晶格常數、夾角、鍵長發生畸變[16-17];張鳳春等[16]研究了鐵和氫原子的相互作用,結果表明氫原子固溶在體系中會造成晶格畸變何體積膨脹,并且畸變的程度和體積膨脹率隨氫含量的增加而增大。Hirata等[18]研究了體心立方金屬中氫原子的占位情況,得到四面體間隙(Tsite)比八面體間隙(Osite)更容易捕獲氫原子,氫原子在Tsite和Osite所引起的晶格畸變幾乎相同,但氫原子固溶在Osite位的能量明顯高于Tsite,并且低濃度的金屬-氫體系中,經過原子弛豫后,Osite位氫原子最終會移動到Tsite位,因此,體心立方晶格的四面體間隙更容易捕獲氫原子。邢煒偉等[19]還計算了體心立方金屬V的Tsite和Osite的電荷分布情況,發現Tsite處出現電荷聚集帶,且數量約是Osite電荷數量的兩倍,如圖1所示,最終得到結論在本征體心立方金屬中氫原子的行為與電荷的分布有關,氫原子傾向于聚集在間隙電荷數量較多的間隙位置。Di Stefano D[20]還利用第一性原理研究了含有空位的金屬和氫原子相互作用,得到在真空條件下單個空位最多能捕獲3個氫原子,而且計算H-H鍵長小于氫分子的鍵長,所以氫原子之間并沒有自發形成氫氣;并且還計算了金屬-氫體系的電子結構,證明了氫原子固溶到間隙或者空位中會改變原子周圍的電荷分布,從而改變原子間的相互作用力。成應晉[17, 21]等人證明了空位是強氫陷阱,含有空位的體心立方金屬中氫原子優先占據緊鄰空位的Osite位置,因此,空位捕獲的氫原子數量取決于Osite的數量,由于每個空位周圍最多有六個Osite,所以可捕獲六個氫原子[22],將這種情況稱之為氫-空位缺陷簇。Tateyama等[23-25]還研究了V、Fe、Al、Pt等金屬的空位缺陷簇,發現氫原子固溶到晶體中,空位與氫所形成的缺陷簇的俘獲能比只有一個空位的俘獲能顯著降低,這說明氫原子的存在確實更易促進空位生成,氫-空位缺陷簇會很大程度降低體系對氫原子的捕獲能,使得氫原子容易在此聚集而形成氫泡。同時也表明,氫的加入,使周圍的原子聚合能力減弱,形成過剩空位,而過多空位的生成又會導致體積收縮,從而使得氫脆現象的產生。例如在鐵素體中[26],空位的存在能使周圍的鐵原子之間形成強烈的化學鍵,但隨著氫原子的引入,形成了新的Fe-H鍵,導致Fe-Fe金屬鍵強度降低。通過對軌道相互作用的分析表明,Fe-H鍵主要由Fe_4s和H_1s軌道相互作用導致,Fe_4p和Fe_3d軌道參與較少使得增強的 Fe-Fe 鍵大大的減弱,揭示了氫致延遲開裂的根本原因。同時也有學者研究了含有空位的面心立方金屬與氫原子的相互作用情況,得到被捕獲的氫原子并不位于空位處位置較大的Osite,而是位于空位周圍空間較小的Tsite,比如金屬Al[27]、Mg[27],并且Tsite氫-空位簇可以捕獲的氫原子個數是8個(8個Tsite處的氫原子);但并非所有的面心立方金屬都是這種情況,比如Pt和Au[28]捕獲的氫原子最多只能占據其中四個Tsite位置,而對于其他面心立方金屬Ag[28]、Cu[28]及γ-Fe[29]等,氫原子則傾向占據在空位周圍的Osite處。那么,影響氫原子的占位情況和捕獲數量的究竟什么原因,目前研究較少,還待繼續探索。

圖1 體心立方金屬中的局域電荷分布[19]Fig.1 Schematic diagram of the local charge distribution in the body-centered cubic metal [19]
3 金屬界面對氫原子捕獲的第一性原理研究
界面問題一直是實驗中最難解決的問題,由于界面結構復雜,實驗技術很難測得,所以近年來很多學者都應用第一性原理計算界面的相關性質,通過對界面相關能量、原子間結合強度、電荷密度分布的分析可以為實驗得到理論依據。目前,針對金屬界面與氫原子的相互作用已經有大量的研究。Davide等[30]研究表明化學計量比型碳化物與鐵素體形成的界面處是氫陷阱位點,并且氫原子最終的穩定位置不是位于兩者之間的界面區域而是待在最靠近界面的Fe平面處,如圖2所示,三角形、正方形、五邊形和菱形標記的位點表示結構優化后原子的穩定位點(靠近界面的Fe平面處)。他們還計算了含有空位的碳化鈦/鐵素體界面的偏聚能,研究了碳空位分別在界面和碳化鈦內部的俘獲特性,如圖3所示。計算的偏聚能結果為V2處偏聚能最小為-1.09 eV,偏聚能越小表示氫原子偏聚在此位置所需要的能量勢壘越低,越容易偏聚在此處,所以氫原子最終的穩定位置是V2,表明非化學計量比碳化物與鐵素體形成界面后會在碳化物內靠近界面的空位處形成強氫陷阱[31],Kazuto等[32-33]也得到了類似的結論。Boning等[34]還證明氫原子的捕獲不僅與空位和間隙有關,還取決于局部的原子環境,比如晶格應變,幾何體積和電荷密度。因此,準確研究氫原子與金屬之間的相互作用,應充分考慮實際情況構建合理的模型。

圖2 氫原子在(001)Fe/(001)TiC界面的穩定位置示意圖[29]Fig.2 Schematic representation of the stable positions for H at the (001)Fe/(001)TiC interface[29]
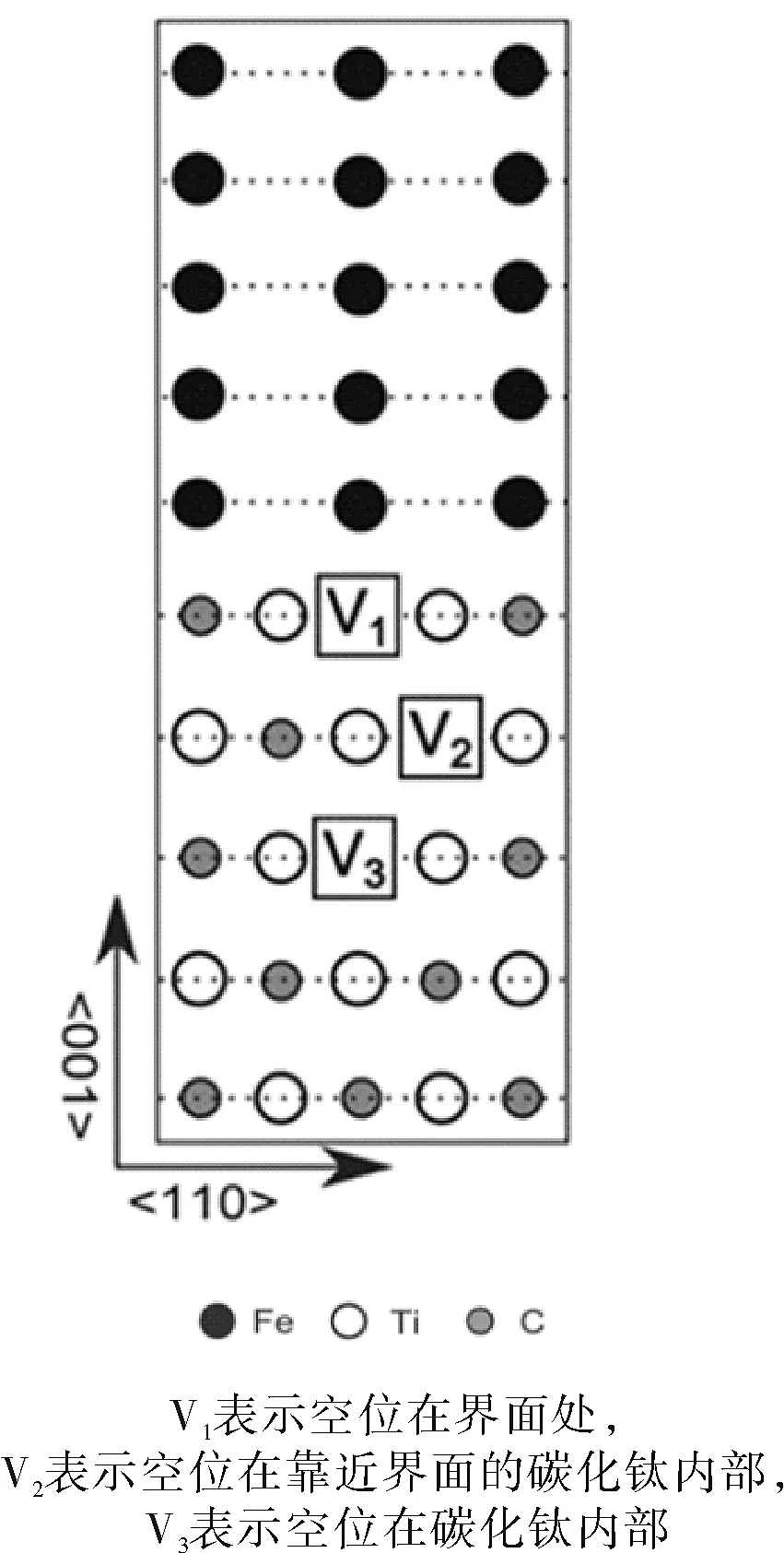
圖3 碳化鈦與鐵素體界面三種不同位置空位的示意圖[29]Fig.3 Schematic diagram of vacancies at three different positions at the interface between titanium carbide and ferrite [29]
關于其他金屬界面的捕氫情況也有大量學者進行研究,柳文波[35]等人也通過第一性原理計算了鎢/銅界面對氫原子的捕獲情況,得到鎢/銅體系中的氫原子被捕獲在界面處和銅晶格內部,還計算了有空位的界面結構并比較了鎢空位和銅空位對氫原子的捕獲情況,得到氫原子容易被鎢空位捕獲,并且當界面處存在空位時,氫原子更傾向占據鎢空位而非銅晶格內部,因此鎢/銅界面形成氫泡是界面附近的氫原子與空位相互作用的結果。馮宇超[36]等人通過第一原理計算系統研究了氧化物彌散強化鋼(ODS鋼)中氧化物析出相Y2TiO5和Y2Ti2O7間隙對氫原子捕獲情況,Y2TiO5/鐵素體、Y2Ti2O7/鐵素體界面中靠近鐵相的一側更容易捕獲氫原子,這是由于靠近界面的Fe相一側電荷密度更高,氫原子容易固溶在電荷密度較高的間隙位置,這表明在ODS鋼中氫原子會優先被氧化物沉淀相與基體間界面所吸收,氧化物和鐵素體界面是氫陷阱,可以捕獲可擴散氫而降低氫的擴散率,為減少氫致裂紋發揮重要作用。
4 結 論
第一性原理在研究氫原子的捕獲情況中已經得到了廣泛應用,本文對目前金屬基體以及界面對氫原子的捕獲情況的研究成果進行了整理分析,闡明了氫原子容易被空位、間隙、界面捕獲,其根本原因是這些氫陷阱位置的電荷密度高,氫陷阱可以減少金屬中的擴散氫,從而減少氫致延遲開裂現象。目前針對空位、間隙和界面捕獲氫原子情況已經有了大量研究,未來可以探究位錯、晶界對氫原子的捕獲情況。但第一性原理還有一定的局限性,計算會受到原子數目限制,計算速度較慢,建模中沒有把實際因素考慮進去等因素的影響從而對計算結果有一定的偏差。但隨著計算機技術的發展以及計算模擬水平的提升,這些問題都會逐步解決,未來第一性原理在氫脆機理的研究中還必將發揮更大的作用。

