牛乳主要過敏原酪蛋白的特性和分離純化研究進展
熊子奕,馬 鑫,陳紅兵,李 欣,熊春紅,
(1.南昌大學食品科學與技術國家重點實驗室,江西南昌 330047;2.南昌大學食品學院,江西南昌 330047;3.南昌大學中德聯合研究院,江西南昌 330047)
食物過敏是指人體接觸某特定食物后,引發的不良免疫反應[1]。有數據顯示,約有5%的成年人和6%的兒童(特別是3歲以下)會發生食物過敏[2?3],且發病率呈上升趨勢。牛乳是聯合國糧食及農業組織(Food and Agriculture Organization, FAO)和世界衛生組織(World Health Organization, WHO)認定的八大過敏性食物之一,同時也是嬰幼兒最早接觸的食物過敏原[4]。最新研究表明,在我國有2.69%的嬰幼兒對牛乳蛋白過敏[5]。牛乳蛋白種類較多,至少有25種蛋白具有潛在致敏性[6]。酪蛋白(casein,CN)、β-乳球蛋白(Beta- lactoglobulin,β-Lg)和α-乳白蛋白(Alpha-lactalbumin,α-La)被認為是牛乳中最主要的過敏原,其中,酪蛋白含量約占牛乳蛋白總量的80%[7],大約有65%的牛乳過敏患者對酪蛋白過敏[8],其癥狀通常表現為濕疹、腹瀉和胃腸出血等[9?11]。
研究表明,酪蛋白的致敏性與其結構特性密切相關。通過質譜、圓二色光譜、核磁共振波譜和X射線等分析技術[12],可以分析酪蛋白的各級結構,但是由于酪蛋白易受外界因素的影響,相互聚集形成較為復雜的膠束結構,造成包括致敏性在內的諸多生物特性的變化。因此,酪蛋白的結構測定和酪蛋白膠束的模型構建成為研究其致敏性的關鍵,而提取出高純度且具有完整生物學特性的酪蛋白是準確測定其結構及致敏性的前提條件。
本文重點綜述了牛乳酪蛋白的分離純化研究進展,總結歸納了單一酪蛋白組分的生物學特征和多種酪蛋白膠束結構模型的共同特點,并介紹了酪蛋白的結構與其致敏性的關系,為利用蛋白質改性技術降低或消除酪蛋白致敏性的研究提供理論參考。
1 牛乳中酪蛋白的結構及特性
酪蛋白是哺乳動物乳汁中的一類含磷鈣的結合蛋白,其含量豐富,相當于總乳成分的2.75%[13]。根據分子特性的差異,乳品中酪蛋白可分為四類:αs1-、αs2-、β-和κ-酪蛋白,分別由位于6號染色體上的CSN1S1、CSN1S2、CSN2和CSN3基因編碼[14],其中β-酪蛋白還可進一步水解,得到的水解產物被稱為γ-酪蛋白[15]。不同品種的乳中四種酪蛋白的相對比例不同,在牛乳中αs1-、αs2-、β-和κ-酪蛋白比例分別為45.0%、12.0%、35.0%和8.0%[16]。酪蛋白等電點為4.6~4.8,在常溫下微溶于水和有機溶劑,具有非吸濕性和非結晶性[17]。表1[18]為牛乳中酪蛋白的組分及化學性質。酪蛋白對酸敏感,當溶液的pH較低時,蛋白分子聚集形成沉淀,加工后可制得干酪和干酪素。
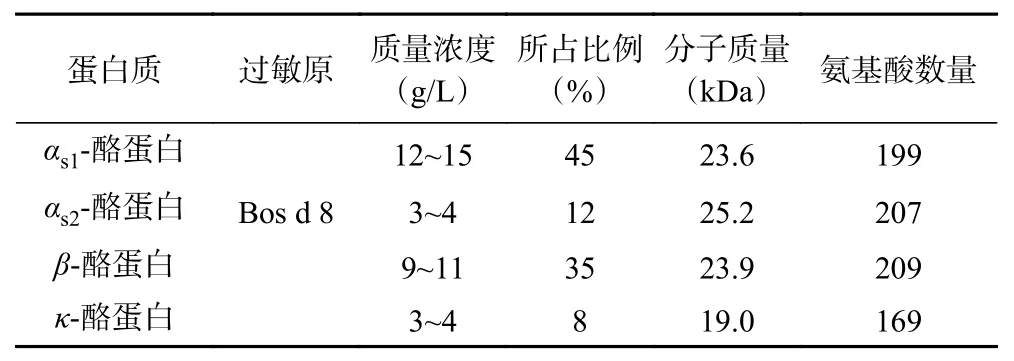
表1 牛乳中酪蛋白的組分及化學性質[18]Table 1 Components and chemical properties of casein in milk[18]
1.1 牛乳中酪蛋白的結構
酪蛋白在牛乳中并不是以單一組分的形式存在,而是相互交聯形成類似球狀的聚集體[19],即酪蛋白膠束,其平均直徑約為150 nm[20]。圖1[12]為酪蛋白膠束冷場發射電鏡的掃描圖。通常情況下,酪蛋白膠束含有成千上萬個酪蛋白分子,其中大部分與礦物質結合形成熱力學穩定的配位化合物。酪蛋白膠束與傳統意義上的膠束存在著很大的區別,其具體結構較為復雜,由于檢測水平的限制,人們對酪蛋白膠束結構的認識還處于理論假說和模型構建的階段[21]。目前,模擬酪蛋白膠束結構模型有套核結構模型、亞單元結構模型、Holt模型和雙結合模型[22?24]。近年來,對于這些結構模型還存在很大爭議,但是學者們普遍認為,酪蛋白膠束具有由αs1-、αs2-、β-酪蛋白與礦物質(主要為非晶態磷酸鈣)構成的內部結構和由κ-酪蛋白構成的覆蓋在膠束表面的外部“毛”層。外部“毛”層分布不均勻,僅部分覆蓋在酪蛋白膠束的表面,形成聚電解質刷[25],其空間位阻和靜電斥力共同抑制了乳中酪蛋白膠束的聚集,對維持酪蛋白膠束的穩定起到了非常關鍵的作用。除此之外,酪蛋白膠束表面的κ-酪蛋白有一個糖基化的親水基團,被稱為糖巨肽[26],易于發生水合,其膠束內部也包含著大量的水分,這是酪蛋白膠束結構的一個很重要的特點。
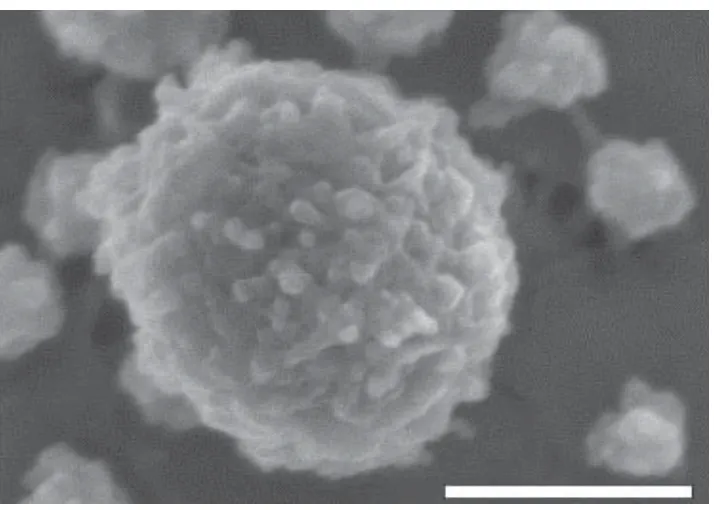
圖1 酪蛋白膠束冷場發射電鏡的掃描圖[12]Fig.1 Electron micrograph of casein micelle cold field emission[12]
酪蛋白膠束的生物學功能與其結構密切相關。它的三個主要的生物學功能是:有助于乳腺安全分泌高濃度的鈣和磷酸鹽,未使其鈣化;通過乳腺安全分泌高濃度的潛在纖維性酪蛋白;膠束在新生兒胃內滯留,使營養物質得以充分消化吸收[27]。
酪蛋白的結構與其致敏性關系密切。酪蛋白存在可以與特異性抗體相結合的結構組織,稱為抗原決定簇(表位),是引發牛乳過敏反應的免疫學物質基礎[2?29]。根據表位結構的不同,可將其分為連續性過敏原表位(線性表位)和不連續性過敏原表位(構象性表位);又根據過敏原表位與細胞的不同結合方式,可將其分為B細胞表位和T細胞表位。一般來說,T細胞表位都是線性表位,而B細胞可以識別并呈遞完整抗原,所以B細胞表位既可以是線性表位,也可以是構象性表位。牛乳中酪蛋白相互聚集形成膠束,會覆蓋一定數量的過敏原表位,當人體攝入牛乳時,酪蛋白膠束結構易被破壞,被覆蓋的過敏原表位重新暴露,增強了酪蛋白的致敏性。
1.2 牛乳中單一酪蛋白的特性
1.2.1α-酪蛋白α-酪蛋白又稱αS-酪蛋白,由兩個單獨的基因產物αs1-和αs2-酪蛋白組成[30]。
αs1-酪蛋白的分子量約為23.6 kDa[31],是由199個氨基酸(圖2)組成的單鏈磷酸化蛋白[32],具有2種常見的磷酸化狀態,即含有8個(αs1-CN-8P)或9個(αs1-CN-9P)磷酸化絲氨酸殘基[33]。另外,αs1-酪蛋白的脯氨酸殘基和疏水殘基數量較多,分布均勻,使其不具有確定的三級結構,而是一個隨機線圈構象,由基團間疏水相互作用穩定[34]。目前,已經發現了牛乳αs1-酪蛋白的9種變異型, 并以A到I進行分類[35]。其中,最常見的兩種變體是B和C,兩者區別在于蛋白質的192處的氨基酸不同,分別為Glu和Gly。這種變化改變了αs1-酪蛋白的等電點,從而使這兩種變體很容易通過等電聚焦(IEF)識別區分[36]。有研究表明,牛乳酪蛋白中αs1-酪蛋白的致敏性明顯高于其他幾種酪蛋白,所以它被認為是牛乳酪蛋白中最為關鍵的過敏原[37?38]。

圖2 牛αs1-酪蛋白B-8P的氨基酸序列[31]Fig.2 Amino acid sequence of αs1-CN B-8P[31]
αs2-酪蛋白由207個氨基酸殘基組成(圖3[31]),分子量大小約為25.2 kDa[39],在牛乳總酪蛋白中占比較低。它由兩個主要結構域和數個次要結構域組成,這幾個結構域呈現不同程度的翻譯后磷酸化以及分子間二硫鍵[40]。αs2-酪蛋白是酪蛋白家族中對鈣最敏感的成員,這可能是因為它的酯磷酸含量很高,酯磷酸來源于每條肽鏈上的磷酸基團[41]。目前,已發現αs2-酪蛋白存在A、B、C、D和E這5個等位基因,呈現出基因多態性[42]。研究表明,αs2-酪蛋白基因的多態性與奶牛泌乳量、乳蛋白量、乳脂量及乳脂率等產奶性狀呈現一定相關性[43]。在過去的幾年中,人們發現αs1-和αs2-酪蛋白都具有分子伴侶的特性,可以防止由于高溫和其他應激條件而導致的凝血和沉淀[44]。

圖3 牛αs2-酪蛋白A-11P的氨基酸序列[31]Fig.3 Amino acid sequence of αs2-CN A-11P[31]
1.2.2β-酪蛋白 在牛乳中,β-酪蛋白的含量僅次于αs1-酪蛋白[45],由209個氨基酸殘基組成(圖4[31]),分子量約為23.6 kDa,若加上5個修飾的磷酸基團,則分子量可增加至24 kDa[46]。β-酪蛋白不穩定,易發生水解從而產生γ-酪蛋白和短肽[47]。根據相同位置上氨基酸的不同,β-酪蛋白中至少存在13個遺傳變異體[48]。其中,根據β-酪蛋白的第67位氨基酸是脯氨酸還是組氨酸,可將其分為A1和A2兩種類型,這兩種變體在β-酪蛋白中最為常見[49?51]。有研究顯示,部分β-酪蛋白變體,如A1、B和C,可能是導致人體患有牛乳不耐癥和一些其他疾病的重要因素,這是由于這些變體在消化過程中產生一種具有阿片活性的生物活性肽β-酪啡肽(BCM-7)[51?52]。相比之下,A2變異體不參與致病機制。有一種假說認為A1β-酪蛋白可能增加遺傳易感兒童患Ⅰ型糖尿病(DM-I)的風險,也有人認為A1β-酪蛋白可能是導致冠心病的危險因素,而含A2β-酪蛋白的牛奶則可以減輕牛乳不耐癥患者的急性腸胃道癥狀[53?54]。

圖4 牛β-酪蛋白A2-5P的氨基酸序列[31]Fig.4 Amino acid sequence of β-CN A2-5P[31]
1.2.3κ-酪蛋白κ-酪蛋白是唯一具有糖成分的酪蛋白,含有169個氨基酸殘基(圖5[31]),分子量為19 kDa[55?56]。κ-酪蛋白分子中僅含有1個磷酸基團,2個SH基,二硫鍵含量占總酪蛋白的15%。在距離肽鏈的C端三分之一處可結合碳水化合物,如唾液酸、半乳糖苷、巖藻糖。另外在肽鏈的11位和88位上有2個半胱氨酸殘基[57]。κ-酪蛋白對鈣的敏感性低,一般不與鈣結合,易發生糖基化作用[58]。牛乳中κ-酪蛋白易與其他酪蛋白結合,形成膠束,大部分的κ-酪蛋白是以酪蛋白膠束形式存在的[59]。有研究表明,κ-酪蛋白具有一定的免疫調節功能,其通過阻斷NFκB途徑,誘導巨噬細胞產生M2樣表型,這些細胞可以顯著減少Th1相關的促炎細胞因子和白細胞介素-2(IL-2)的釋放,降低經κ-酪蛋白處理的巨噬細胞誘導適應性免疫反應的能力[60]。現已發現該蛋白主要存在兩種變異型:即A和B,在大多數牛乳品種中A出現的頻率相對更高,而B則與κ-酪蛋白中高比例的糖基化組分密切相關,并且影響著凝乳酶對酪蛋白的作用效果[61?62]。

圖5 牛κ-酪蛋白A-1P的氨基酸序列[31]Fig.5 Amino acid sequence of bovine κ-CN A-1P[31]
2 牛乳酪蛋白分離純化的方法
目前,牛乳中主要過敏原蛋白的分離方法較多:利用蛋白質等電點的不同而分離,包括等電點沉淀法和選擇性沉淀法;利用選擇性吸附不同而分離,包括疏水作用層析;利用過敏原在層析柱中帶電性不同而分離,包括陰離子交換層析和陽離子交換層析;利用過敏原的分子質量不同而分離,包括膜技術和凝膠層析。在酪蛋白的分離純化方法中,根據分離目的物的不同,也可將上述方法初步劃分為膠束酪蛋白的初步分離和酪蛋白組分的提取純化。除此之外,利用多種分離方法結合純化酪蛋白已成為分離純化技術發展的新方向。
2.1 膠束酪蛋白的初步分離
2.1.1 高速離心法 高速離心是實驗室常用的酪蛋白粗提方法。酪蛋白膠束在高速離心的狀態下沿徑向分離,導致離心的酪蛋白顆粒化,形成沉淀析出。與其他分離方法不同,酪蛋白在高速離心過程中,膠束結構不會被破壞,因此可以重新分散,其性質與原膠束的性質基本相似。葛攀瑋等[63]利用高速離心法提取純化3種市售牛奶中的酪蛋白,并對所提取的酪蛋白進行聚丙烯酰胺凝膠電泳(SDS-PAGE)鑒定分析,其平均濃度為2.02 mg/mL,分子量為28 kDa。牛欣等[64]將鮮乳高速離心得到酪蛋白,并以分離得到的酪蛋白為原料,從流變學特性、粒徑、Zeta電位和透光度等幾個指標研究了其在不同 pH 下的變化情況。高速離心法所得沉淀是不純的,需經過再懸浮和再離心2~3次,才能取得較純的蛋白顆粒。
2.1.2 凝乳酶誘導分離法 凝乳酶是一種天冬氨酸內切蛋白酶,可高特異性地水解κ-酪蛋白。κ-酪蛋白對維持酪蛋白膠束的穩定起到了至關重要的作用,它能防止酪蛋白膠束凝聚。利用凝乳酶有限地水解κ-酪蛋白,破壞酪蛋白膠束的穩定,導致結構解體和凝乳的形成。凝乳可進一步分離出各酪蛋白組分。
凝乳酶誘導分離法操作簡單,是常用的酪蛋白粗提方法,但是利用該方法提取的酪蛋白純度不高,需與選擇性沉淀法等分離方法結合,進一步分離出各酪蛋白組分。Huppertz等[65]用凝乳酶處理脫脂乳樣品,再利用低溫酸性條件下αs-酪蛋白和β-酪蛋白溶解度的不同,進一步分離酪蛋白組分。使用該方法提取的β-酪蛋白含量大約占脫脂乳樣品中總酪蛋白含量的7%,純度較高。由于κ-酪蛋白被高度特異性水解,所以該方法不利于后續提純κ-酪蛋白。
2.1.3 等電點沉淀法 等電點沉淀法是利用蛋白質在等電點處溶解度最低這一化學特性而開發的分離方法。蛋白質在溶液中具有兩性電離的現象,當溶液pH與其等電點相等時,蛋白質處于兼性分子的狀態,凈電荷為零,分子間靜電斥力較小,更容易相互碰撞凝聚,形成沉淀析出[66]。利用這一性質,可以通過調節溶液pH來達到分離不同蛋白質組分的目的。
等電點沉淀法可以快速地分離牛乳酪蛋白,方法簡單,易于操作,對設備要求不高,是實驗室制備酪蛋白的常用方法。蔣紅玲等[67]以脫脂乳為原料,加入磷酸緩沖鹽溶液(PBS)后,用1moL/L 的HCl將溶液pH調節至4.6,析出酪蛋白沉淀,取得了較好的分離純化效果,其純度>90%。宋宏新等[68]采用新鮮牛乳為原料,利用等電點沉淀法分離出粗品酪蛋白,再通過水洗凈化除雜和有機溶劑脫脂等步驟制得牛乳酪蛋白,通過凱氏定氮法和SDS-PAGE凝膠電泳分析比較酪蛋白組分差異,獲得酪蛋白的純度與得率分別為91.13%和86.75%。利用此方法分離出的酪蛋白純度能滿足后續實驗的需要,常與其他分離方法結合以進一步分離純化酪蛋白組分。
2.2 酪蛋白組分的提取純化
2.2.1 選擇性沉淀法 選擇性沉淀法是利用蛋白質對某些物理或化學因素敏感性的不同,而有選擇地使之變性沉淀,從而達到分離提純的目的。αs-酪蛋白比β-酪蛋白具有更多的磷酸絲氨酸基團,在堿性條件下,帶有更多的凈負電荷,因此αs-酪蛋白對Ca2+的親和性比β-酪蛋白更高[69]。而在酪蛋白組分中,β-酪蛋白疏水性最強,但是其溶解度受溫度的影響較大。當溫度較低時(≤4 ℃),即使溶液pH在其等電點處,β-酪蛋白也還是擁有較高的溶解度。通過低溫分離后再加熱的方法,可獲得β-酪蛋白組分。κ-酪蛋白在含三氯乙酸(TCA)的尿素溶液中有較高的溶解度[70],可利用這一性質將其與其他酪蛋白組分分離。
選擇性沉淀法是等電點沉淀法的一種改進方法,能夠將牛乳中分離出的膠束酪蛋白進一步分離純化,從而得到各種酪蛋白組分。Thomas等[71]以牛乳中分離出的膠束酪蛋白為原料,采用選擇性沉淀的方法,分離各酪蛋白組分。利用該方法得到的αs-和β-酪蛋白組分純度均達到95%以上,而κ-酪蛋白純度為54%,得率為83%。雖然該方法步驟較多,但是得到的酪蛋白組分純度高,且對過程稍加改進便可用于中試規模分離酪蛋白,所以選擇性沉淀法是最常用的酪蛋白分離純化方法之一。
2.2.2 疏水作用層析法 蛋白質表面一般含有疏水基團和親水基團,疏水作用層析是利用蛋白質表面某一部分具有疏水性,與同樣帶有疏水性的層析介質在高鹽濃度的條件下相結合。在洗脫時,將鹽濃度逐漸降低,根據蛋白質組分的疏水性不同而逐個洗脫純化。疏水性弱的蛋白組分,在較高離子強度的溶液中被洗脫下來,當離子強度降低時,疏水性強的蛋白才被洗脫[72]。疏水作用層析法分離酪蛋白,以尿素為流動相,將待分離的樣品吸附在疏水性層析介質上,然后線性或階段降低離子強度,選擇性的將樣品解吸。
牛乳酪蛋白各組分疏水性差別較大,β-酪蛋白疏水性最強,α-酪蛋白次之,κ-酪蛋白疏水性最弱[73],因此可以有效地分離各酪蛋白組分。Emilia等[74]使用TSK-Gel Ether-5PW疏水色譜柱分離和測定各酪蛋白組分,得到的αs1-、αs2-、β-、κ-酪蛋白純度分別為76.1%、85.0%、87.9%和65.5%。由于蛋白質與疏水性層析介質之間的作用力相對較弱,分離過程對蛋白質活性影響較小,更加有利于蛋白質的后續分析實驗。該方法對疏水性層析介質的選擇要求較高,需要依據目標蛋白的化學性質而定,結合能力太強的介質會使得蛋白很難洗脫,而結合能力太弱的介質無法達到分離出各蛋白組分的效果,所以這也是該分離方法的技術難點。
2.2.3 離子交換層析法 離子交換層析法是利用蛋白質分子表面所帶電荷性質的不同而達到分離純化目的的一種分離方法。利用該方法分離酪蛋白組分,是依據各種酪蛋白在特定的條件下,呈現不同的電荷強度,與離子交換劑的結合能力存在明顯差別,用洗脫劑洗脫時,按結合能力的大小,由弱到強依次洗脫分離。離子交換層析法主要分為陰離子交換層析和陽離子交換層析,其中分離酪蛋白組分常用陰離子交換層析。
離子交換層析法具有良好的樣品處理能力和廣泛的適用性,適中的成本和高度的自動化使其成為應用最廣泛的酪蛋白分離純化技術之一。劉納[75]以牛乳加工制得的干酪素為原料,將尿素沉淀法與離子交換層析法相結合對干酪素進行分級分離,最終得到的αs-酪蛋白相對純度和回收率分別為75.4%與73.8%,β-酪蛋白相對純度和回收率為87.9%與62.0%,κ-酪蛋白相對純度和回收率為57.3%與49.8%。Johann等[76]通過Source 30Q陰離子交換樹脂分離純化各酪蛋白組分,每1.2 g全酪蛋白中可分離αs-酪蛋白456 mg、β-酪蛋白358 mg和κ-酪蛋白99 mg。雖然離子交換層析法具有許多優點,但是也存在一定的局限性。在工業生產中,洗脫劑中的鹽濃度很難精準控制,所以只能采用分步洗脫而不是連續升高的鹽梯度,分離效果會有所下降,但即使是用最為精確的控制條件,僅用離子交換層析這一單一方法,也很難得到純度高的蛋白,需要與其他分離純化技術相結合,比如疏水作用層析法。
2.2.4 高效液相色譜法 高效液相色譜法是一種常用的快速分離方法。其分離效率高,通常分析一個樣品在15~30 min,有些樣品甚至在5 min內即可完成。高效液相色譜分辨率較高,重復性好,色譜柱可以反復使用,樣品不易被破壞,易回收,且自動化程度高。因此高效液相色譜法的應用較廣,大部分有機化合物都可用高效液相色譜分析,特別是高沸點、大分子、強極性、熱穩定性差的化合物的分離分析。
高效液相色譜法方便快捷,酪蛋白產物純度高,可作為高精度研究的實驗材料。隨著牛乳致敏性研究的深入,該方法分離過敏原蛋白的應用也越來越廣泛。劉夢云等[77]以C8色譜柱為分離柱,利用反相高效液相色譜法對乳粉中酪蛋白的4種組分(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白)進行分離檢測。4種酪蛋白的加標回收率在95.2%~100.6%之間,且純度高。王娟等[78]采用Agilent Zorbax 300SB-C8色譜柱對牛乳樣品進行檢測,以三氟乙酸-水-乙腈為流動相梯度洗脫,在波長214 nm處測定牛乳蛋白組分。其中αs1-、αs2-、β-、κ-酪蛋白的回收率分別為94.3%、83.3%、91.9% 和 80.7%,純度可達99%。
2.2.5 膜分離技術 膜分離是利用高分子膜的選擇透過性,實現不同分子量蛋白質組分分離的技術。由于牛乳中各組分的分子量和粒徑不同,大部分乳清蛋白、乳糖、礦物質和水能透過膜成為滲透液,而酪蛋白不能透過膜留在截留液中,從而實現酪蛋白的分離純化[79]。應用于酪蛋白組分分離的膜技術主要為微濾(MF)和超濾(UF)。
膜分離技術選擇性強,操作過程簡單,適用范圍廣,是一種發展迅速的新興分離技術。由于β-酪蛋白在低溫條件下是單量體,隨著溫度的升高會變為聚合體,與原膠束的直徑存在明顯的差別,使用膜分離效果顯著,所以膜分離技術也是中試規模分離純化β-酪蛋白的常用方法。Johannes等[80]在50 ℃的條件下,將脫脂乳在孔徑為0.1 mm的陶瓷膜上進行微濾,獲得膠束酪蛋白濃縮物。進而經冷藏處理后,在溫度≤5 ℃的條件下,使用孔徑為0.3 mm的有機膜從冷藏濃縮物中微濾分離β-酪蛋白。進一步將β-酪蛋白滲透液加熱至50 ℃,使β-酪蛋白自締合,采用截留值為10 kDa的有機膜進行超濾。利用該方法獲得的β-酪蛋白純度為92.64%,產率最高為18.07%。值得注意的是,利用該方法分離蛋白之后,膜面易發生污染,致使膜分離性能降低,故需采用與工藝相適應的膜面清洗方法。
2.3 多種分離方法結合純化酪蛋白
每種分離純化酪蛋白的方法都具有其優勢,但也存在一定的局限性。在實際應用中,單獨使用一種分離方法純化酪蛋白,其純度和生物學性質可能不能滿足后續實驗的需要,而不同的分離純化方法之間可能存在協同作用,達到優勢互補的效果,所以多種分離方法相結合純化酪蛋白,可以顯著改善酪蛋白的分離效果。叢艷君等[81]使用等電點沉淀法,將脫脂乳pH調至4.2,得到的酪蛋白沉淀反復洗滌并冷凍干燥;再將得到的酪蛋白溶于含有尿素和二硫蘇糖醇(DTT)的甲酸鈉緩沖液,加至離子交換層析柱中,以NaCl為洗脫液進行梯度洗脫,最后使用10 kDa膜進行超濾以除去尿素和氯化鈉,得到高純度的αs1-酪蛋白、β-酪蛋白和κ-酪蛋白。Katharina等[82]先通過膜技術從牛乳中分離出膠束酪蛋白,再采用選擇性沉淀法進一步分離,獲得不同酪蛋白組分。其中β-酪蛋白的純度與產率分別可達到89.6%和32%;而αs-和κ-酪蛋白的純度分別為61%和43%。實驗結果表明,相比于利用單一方法純化酪蛋白,多種分離方法相結合純化酪蛋白更具有競爭力。
3 前景與展望
酪蛋白是牛乳中最主要的蛋白質,是良好的蛋白補充劑及添加劑,但是其較高的致敏性同樣不容忽視。分離出較高純度的酪蛋白,是人們研究牛乳過敏的物質基礎。目前,關于牛乳酪蛋白分離純化的技術雖然很多,但仍然存在需要解決的問題。一些操作簡便、成本較低的方法分離出的酪蛋白純度很難滿足后續實驗的需要,而分離純度高的分離純化技術則需要較為精密的實驗設備,成本較高。因此,牛乳酪蛋白的分離純化技術有待于進一步研究。除了對現有技術的改良之外,還必須發展全新的分離技術,以期實現蛋白質分離和后續蛋白質組學分析全過程的自動化。與此同時,采用多種分離方法結合純化酪蛋白也將成為今后的主要發展趨勢。

