陜西省2017年至2019年醫(yī)療器械生產企業(yè)現(xiàn)場檢查情況分析
胡碧榮
(陜西省藥品技術審核查驗中心,陜西 西安 710065)
陜西省目前有醫(yī)療器械生產企業(yè)524家,其中一類269家,二類235家,三類29家。陜西省醫(yī)療器械產業(yè)較弱,企業(yè)規(guī)模以中小型為主,生產實力強、品種科技含量高的大型企業(yè)占比不高,多數(shù)企業(yè)產品品種單一,創(chuàng)新能力不強[1]。實施《醫(yī)療器械生產質量管理規(guī)范》(以下簡稱《規(guī)范》)是監(jiān)管生產過程,提高醫(yī)療器械產品質量的重要手段,也是保障公眾用械安全的重要舉措[2-3]。本研究中,結合《醫(yī)療器械生產質量管理規(guī)范現(xiàn)場檢查指導原則》等4個原則[4]的要求,匯總了陜西省2017年至2019年295家醫(yī)療器械生產企業(yè)質量管理規(guī)范現(xiàn)場檢查情況,分析企業(yè)存在的問題并提出建議,旨在為本省醫(yī)療器械生產企業(yè)日常監(jiān)管提供數(shù)據(jù)支持,為企業(yè)質量管理體系的改進提供參考。現(xiàn)報道如下。
1 現(xiàn)場檢查企業(yè)基本情況
由表1可知,依據(jù)《規(guī)范》[2]開展現(xiàn)場檢查共136家,占46.10%;依據(jù)《醫(yī)療器械生產質量管理規(guī)范附錄無菌醫(yī)療器械》[5]開展現(xiàn)場檢查共70家,占23.73%;依據(jù)《醫(yī)療器械生產質量管理規(guī)范附錄植入性醫(yī)療器械》[6]開展現(xiàn)場檢查共15家,占5.08%;依據(jù)《醫(yī)療器械生產質量管理規(guī)范附錄定制式義齒》[7]開展現(xiàn)場檢查共66家,占22.37%;依據(jù)《醫(yī)療器械生產質量管理規(guī)范附錄體外診斷試劑》[8]開展現(xiàn)場檢查共8家,占2.71%。
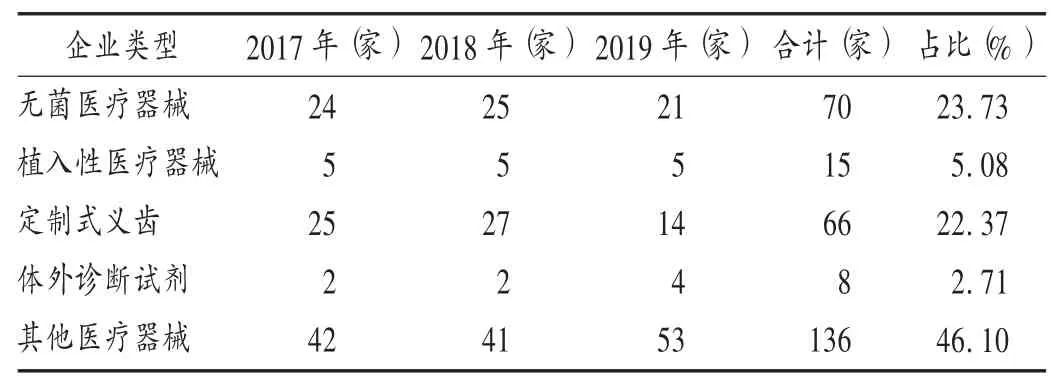
表1 不同企業(yè)類型醫(yī)療器械生產企業(yè)現(xiàn)場檢查分布(n=295)Tab.1 Distribution of the on-site inspection for different types of medical device manufacturers(n=295)
由表2可知,首次注冊及延續(xù)注冊啟動類現(xiàn)場檢查共157家,占53.22%;生產許可及注冊事項變更類現(xiàn)場檢查共94家,占31.86%;監(jiān)督檢查及其他類現(xiàn)場檢查共44家,占14.92%。
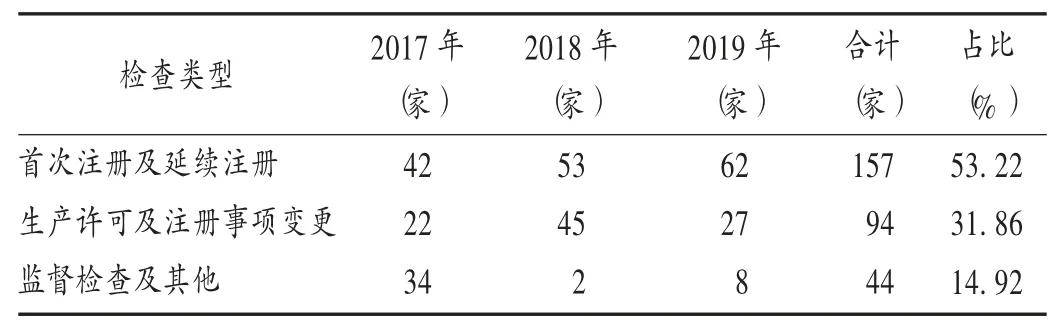
表2 不同檢查類型醫(yī)療器械生產企業(yè)現(xiàn)場檢查分布(n=295)Tab.2 Distribution of different on-site inspection types for medical device manufacturers(n=295)
2 結果與分析
2.1 結果
總體情況:由表3可知,2017年至2019年現(xiàn)場檢查的295家醫(yī)療器械生產企業(yè)中,21家企業(yè)未通過檢查,274家企業(yè)整改后符合要求。
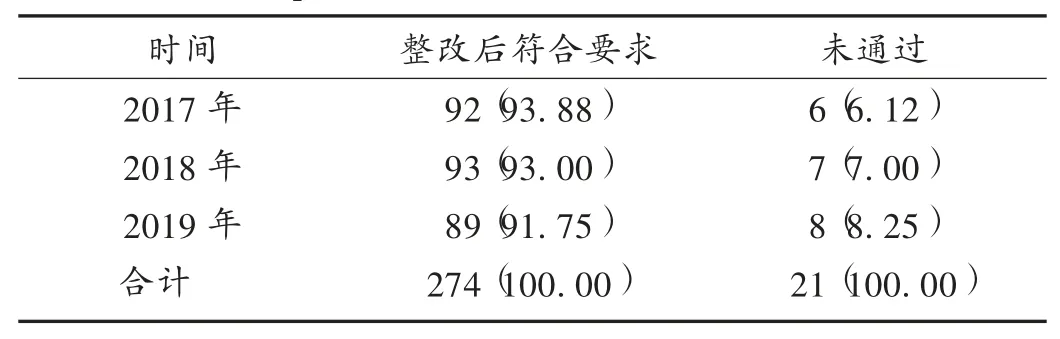
表3 醫(yī)療器械生產企業(yè)現(xiàn)場檢查結果[家(%)]Tab.3 On-site inspection results of medical device manufacturers[n(%)]
缺陷項目分布情況:2017年至2019年現(xiàn)場檢查的295家醫(yī)療器械生產企業(yè)中,不符合項共2 513條。其中,一般缺陷項目2 453項,嚴重缺陷項目60項。詳見表4。可見,一般缺陷項目逐年增多,嚴重缺陷項目逐年減少,說明隨著《規(guī)范》的深入實施,企業(yè)的法規(guī)認知和規(guī)范意識逐步提升,質量管理體系正在持續(xù)改進和不斷優(yōu)化。由圖1可知,質量控制章節(jié)出現(xiàn)13次,生產管理章節(jié)出現(xiàn)12次,機構和人員章節(jié)出現(xiàn)7次,采購章節(jié)出現(xiàn)5次。可見,生產管理、質量控制、機構和人員章節(jié)是企業(yè)質量管理體系問題的重災區(qū),同時采購、文件管理、不良事件監(jiān)測分析和改進章節(jié)也值得重視。由此推測,企業(yè)在廠房與設施、設備等硬件管理方面存在較多問題,與企業(yè)規(guī)模小、實力弱、投入不足有一定關系。隨著企業(yè)質量意識的提升,盈利能力的增加,規(guī)模的不斷擴大,這一問題將得到有效解決。
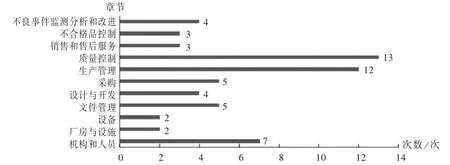
圖1 醫(yī)療器械生產企業(yè)現(xiàn)場檢查嚴重缺陷項目分布Fig.1 Distribution of serious defects in on-site inspection of medical device manufacturers
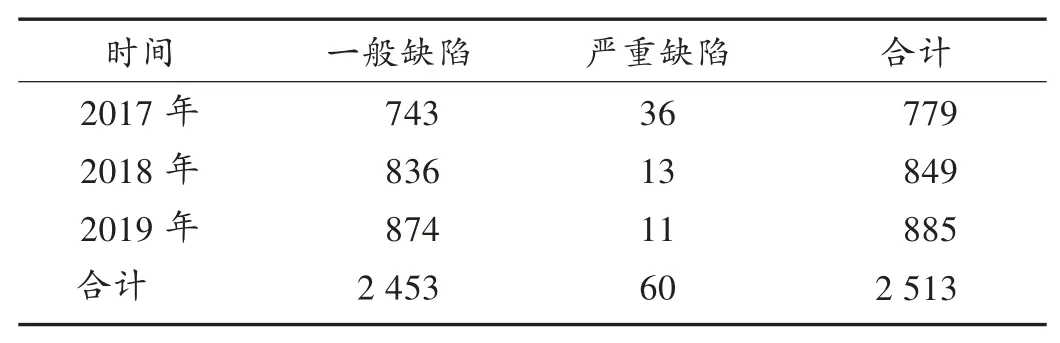
表4 醫(yī)療器械生產企業(yè)現(xiàn)場檢查缺陷項目分布(項)Tab.4 Distribution of defect items in on-site inspection of medical device manufacturers(item)
2.2 質量管理體系薄弱環(huán)節(jié)分析
2.2.1 綜合分析
陜西省醫(yī)療器械生產企業(yè)整體質量管理水平不高,出現(xiàn)的不符合項目較多,企業(yè)內審、自查和糾錯能力不足,表現(xiàn)在歷次檢查不符合項相同或相似,各章節(jié)不符合條款相對集中。如2017年,廠房與設施章節(jié)2.6.2項“倉儲問題”出現(xiàn)次數(shù)最多(34次),機構和人員章節(jié)1.4.1項“部門負責人任職能力考核問題”和生產管理章節(jié)7.6.2項“批生產記錄”并列第2(28次),質量控制章節(jié)8.4.2項“檢驗記錄問題”到第3(21次);2018年,廠房與設施章節(jié)2.6.2項仍列第1(38次),生產管理章節(jié)7.6.2項和設備章節(jié)3.2.2項“設備狀態(tài)標識”并列第2(27次);2019年數(shù)據(jù)高頻不符合項也基本一致。
2.2.2 單項分析
由圖2可知,廠房與設施、設備、生產管理、質量控制章節(jié)出現(xiàn)不符合項頻率較高,不符合主要內容包括以下5個方面。
廠房與設施章節(jié):倉儲區(qū)域劃分問題突出,如倉儲區(qū)無待檢區(qū)、退貨召回區(qū),物料未按規(guī)定區(qū)域存放,物料存放要求不明確,設施不能滿足存儲環(huán)境要求;貨位卡及臺賬信息不全;壓差表、溫度計等設施配備、安裝配備問題;潔凈區(qū)管道密封、傳遞窗、互鎖裝置故障問題;物料卡內容不完整等。有源醫(yī)療器械和診斷試劑生產企業(yè)還存在生產區(qū)域劃分不明確,生產工具、原材料、中間產品存放混亂等問題[9]。
設備章節(jié):生產設備、檢驗設備驗證記錄問題,如缺少驗證計劃、驗證記錄不全、驗證結果未運用(與實際運行參數(shù)不一致)等;使用、維護保養(yǎng)和操作規(guī)程及記錄問題,如未建立設備操作、維護保養(yǎng)規(guī)程或內容不全,未按規(guī)程要求建立記錄等;潔凈區(qū)管理方面,空調系統(tǒng)維護保養(yǎng)問題,如未建立空調系統(tǒng)維護保養(yǎng)記錄,未查見初中效濾過濾網(wǎng)清潔更換記錄。水系統(tǒng)維護保養(yǎng)問題,如純化水系統(tǒng)使用維護保養(yǎng)標準操作規(guī)程未明確具體的日常保養(yǎng)方法[10],存在盲管、水質監(jiān)測記錄不全等。
生產管理章節(jié):批生產記錄不全,如①未記錄物料批號、設備編號、工藝參數(shù)、無操作人員簽字等。②有源醫(yī)療器械未記錄生產設備和工藝參數(shù)、部分工序無記錄。③無菌醫(yī)療器械關鍵工序工藝參數(shù)記錄及生產批與滅菌批之間的關系記錄常出現(xiàn)問題。④生產工藝規(guī)程、作業(yè)指導書的要求與批生產記錄之間無法對應;工藝規(guī)程中設置的工序與批生產記錄中設置的工序不一致;工序參數(shù)在工藝規(guī)程中有要求,但記錄中未設置等。⑤物料進入潔凈區(qū)程序存在問題,如未明確物料進入潔凈區(qū)的凈化要求,未查見物料進入潔凈區(qū)的流轉記錄。
質量控制章節(jié):《醫(yī)療器械生產企業(yè)質量控制與成品放行指南》明確要求,“企業(yè)應當根據(jù)強制性標準以及經(jīng)注冊或者備案的產品技術要求、產品交付要求、企業(yè)內部控制標準等制定成品檢驗規(guī)程”[11]。現(xiàn)場檢查實踐中,企業(yè)經(jīng)常不能區(qū)分標準與規(guī)程的關系,檢驗項目往往不能涵蓋強制性標準和產品技術要求的內容。另外,建立的原材料、中間產品、半成品的標準不清晰,檢驗規(guī)程中具體檢驗項目的檢驗方法不明確,存在記錄缺失現(xiàn)象。企業(yè)關注成品和關鍵原材料較多,往往忽視輔助材料(如初包裝材料)要求,對于中間產品、半成品的檢驗要求也不夠重視,檢驗方法和檢驗原始記錄問題高發(fā)。
其他:除高發(fā)不符合項的章節(jié)外,以下項目也均為高發(fā)條款,如機構和人員章節(jié)的部門及崗位職責權限劃分項,文件管理章節(jié)的文件更改和作廢文件管理項,設計與開發(fā)章節(jié)的設計轉換記錄項,采購章節(jié)的供應商審計銷售項,銷售和售后服務章節(jié)的銷售記錄項,不合格品控制章節(jié)的不可返工產品處置規(guī)定項,不良事件監(jiān)測分析和改進章節(jié)的數(shù)據(jù)分析和內審項目。
2.2.3 原因分析
分析不同類型企業(yè)檢查數(shù)據(jù)得知,義齒、有源類、無菌植入等企業(yè)平均缺陷條款較多。以2018年為例,義齒企業(yè)不符合項268項,平均不符合9.9項;有源類企業(yè)不符合項346項,平均不符合8.4項;無菌植入企業(yè)不符合項215項,平均不符合7.1項。從條款總數(shù)來看,義齒和有源類企業(yè)缺陷條款占比較大,企業(yè)平均不符合項數(shù)值高,一定程度反映了這類企業(yè)規(guī)模較小、實力較弱,人員素質較低,質量管理意識較低。分析其原因,認為存在問題較多的企業(yè)往往存在管理制度和管理實際“兩張皮”現(xiàn)象,這類企業(yè)雖按要求制訂了質量手冊、程序文件、記錄表格等,但在管理實際中不能按文件要求執(zhí)行或不能完全執(zhí)行。一是企業(yè)質量管理人員數(shù)量不足,素質不高,自查能力、風險分析能力和糾正預防能力不夠。二是企業(yè)質量管理體系文件與企業(yè)管理實際不貼和,發(fā)現(xiàn)問題不能根據(jù)自身實際不斷修改完善,導致執(zhí)行越來越難。三是企業(yè)對質量管理體系文件認知不夠,在法規(guī)用于注冊產品、企業(yè)質量管理體系時認識有偏差,轉化、落實不夠。在檢查實踐中,經(jīng)常發(fā)現(xiàn)企業(yè)未識別國標和行業(yè)標準等強制性標準,不能及時獲取和學習注冊產品強制標準的變更、相關規(guī)范文件的發(fā)布,出現(xiàn)企業(yè)產品技術要求、檢驗方法、原材料等引用標準和文件不是現(xiàn)行版本,以及未采用強制性標準。四是企業(yè)對員工培訓不力,質量管理全員參與不夠,導致員工不能合規(guī)執(zhí)行,體系管理存在“真空”地帶。
2.3 檢查章節(jié)不符合項目分布
由圖2可知,2017年檢查章節(jié)不符合項目占前3位的是廠房與設施、質量控制、機構和人員3個章節(jié),分別為138,121,96項;2018年占前3位的是廠房與設施、生產管理、設備3個章節(jié),分別為140,124,106項;2019年占前3位的是廠房與設施、生產管理、質量控制3個章節(jié),分別為133,125,119項。可見,機構和人員、章節(jié)不符合項目有所減少,文件管理、設計與開發(fā)、采購、生產管理章節(jié)不符合項目增加,特別是文件管理和設計與開發(fā)章節(jié)不符合項增長明顯。

圖2 醫(yī)療器械生產企業(yè)現(xiàn)場檢查不符合項目按章節(jié)分布Fig.2 Distribution of non-conformance items by chapter in on-site inspection of medical device manufacturers
3 改進措施建議
3.1 監(jiān)管部門
一是要加大法規(guī)宣傳力度,督促企業(yè)學法,提升企業(yè)遵法守法及主體責任意識,抓好企業(yè)“關鍵人員”培訓,提高企業(yè)自查能力和糾正預防能力,逐步完善體系,提高質量管理水平。二是要充分運用風險分析研判、數(shù)據(jù)分析等手段,確定監(jiān)管重點和“短板”,重點監(jiān)控高風險品種和加強企業(yè)監(jiān)督檢查力度,抓好部分定制式義齒、有源類小弱企業(yè)的教育培訓,整體提升其質量管理水平,實現(xiàn)科學決策與長效監(jiān)管,推動醫(yī)療器械產業(yè)健康發(fā)展[12]。三是要加強監(jiān)管力量配備和監(jiān)管能力建設,解決新形勢下行業(yè)發(fā)展快、監(jiān)管任務重、監(jiān)管人員不足、能力不足等問題,在監(jiān)督檢查的同時分析企業(yè)表象問題下深層次原因,幫助企業(yè)發(fā)現(xiàn)及解決問題。
3.2 企業(yè)
一是要不斷提升質量意識和主體責任意識,建立質量管理體系持續(xù)改進機制。二是要完善內部管理制度、相關程序、文件,使流程更加順暢、文件記錄更加貼合實際。三是要分層級、崗位開展有針對性的員工培訓,培養(yǎng)其良好的自查、糾正預防和分析改進能力,提升企業(yè)質量管理的整體素養(yǎng)。

