急性髓系白血病患者血清miR-10a-5p、miR-203表達與臨床病理特征及預后的關系
郭亮,寇儒,李光,宋艷萍,藺旭紅,李真真
西安交通大學醫學院附屬西安市中心醫院血液科1、檢驗科2,陜西 西安 710003
急性髓系白血病(acute myeloid leukemia,AML)是一種起源于髓系造血干祖細胞,以侵犯骨髓、血液以及其他組織器官的具有高度異質性的惡性克隆性疾病[1]。AML 的發病機制尚未完全闡明,目前有研究證實微小RNA (microRNA,miR)參與調控AML 發生發展、治療以及預后等方面[2]。miR是一種進化高度保守的長度約為22 個核苷酸的短鏈非編碼RNA,通過與目標mRNA 的3'UTR 特異性結合抑制信號通路的表達介導轉錄后基因沉默,miR主要由RNA聚合酶Ⅱ介導其轉錄過程,轉錄產物稱為pri-miR,其特征在于發夾結構[3]。近年來隨著研究的不斷深入,發現miR 通過調控細胞增殖、分化、應激、自噬、凋亡、血管新生、骨髓微環境等方面促進白血病的發生發展[4]。因此了解miR 在AML 中的表達有助于人們更深入的理解AML 的發病機制,并探討其在AML 分類、早期診斷、疾病預后、治療等方面的應用價值。miR-10a-5p、miR-203是近年來新興的參與腫瘤病理生理過程的分子生物標志物,兩者在AML 患者中的表達水平及對預后影響的研究尚不多見。鑒于此,本研究通過檢測初治AML 患者血清中miR-10a-5p、miR-203 的表達水平,進一步探討其與臨床病理特征及預后的關系。
1 資料與方法
1.1 一般資料選取2014 年7 月至2018 年1 月期間在西安市中心醫院住院治療的100 例初治AML患者(初治組)納入研究。納入標準:(1)臨床資料完整;(2)符合世界衛生組織關于AML的診斷標準[5];(3)患者或家屬知情同意,且簽署知情同意書;(4)均符合初治AML患者;(5)所有入組人員均耐受化療。排除標準:(1)慢性髓系白血病;(2)嚴重心力衰竭或嚴重免疫缺陷者;(3)骨髓增生異常綜合征;(4)合并其他腫瘤者;(5)嚴重感染者;(6)失訪者。100例初治AML患者中有30例獲得完全緩解(完全緩解組),27例獲得部分緩解(部分緩解組),43例未獲得緩解(未緩解組)。同期選取我院體檢中心50例體檢正常者作為正常對照組。初治組患者中男性56 例,女性44 例;年齡20~78 歲,平均(50.77±8.44)歲。正常對照組中男性25 例,女性25 例;年齡22~75 歲,平均(49.31±6.23)歲。兩組受檢者的性別和年齡比較差異均無統計學意義(P>0.05),具有可比性。本研究經我院倫理委員會批準。
1.2 治療方法100 例AML 患者均采取誘導化療。其中CAG 方案治療31 例:即靜脈滴注阿克拉霉素10 mg/次,1 次/d,連續8 d;皮下注射阿糖胞苷10 mg/m2,2 次/d,連續14 d;皮下注射粒細胞集落刺激因子200 μg/m2,1次/d,且以患者白細胞計數>20×109/L為停藥標準。MA方案治療19例:即靜脈滴注阿糖胞苷120~150 mg/m2,1次/d,連續3 d;米托蒽醌6~8 mg/m2,1 次/d,連續3 d。DA 方案治療50 例:即靜脈滴注阿糖胞苷120~150 mg/m2,1 次/d,連續7 d;柔紅霉素35~45 mg/m2,1 次/d,連續7 d。
1.3 療效評價標準按照《血液病診斷及療效標準》[6]對100 例AML 患者的療效進行評價:(1)完全緩解:治療后各項癥狀徹底消失,且外周血PLT≥100×109/L,中性粒細胞計數≥1.5×109/L,白細胞分類中未檢出白血病細胞,巨核細胞和紅細胞恢復正常,骨髓內原始粒細胞Ⅰ型+Ⅱ型≤5%;(2)部分緩解:治療后血象、臨床表現兩項中存在1項未達完全緩解標準,且骨髓內原始粒細胞Ⅰ型+Ⅱ型≤20%;(3)未緩解:血象、臨床表現以及骨髓象均未達到部分緩解標準。
1.4 研究方法
1.4.1 臨床資料收集收集AML 患者的臨床資料,包括年齡、性別、脾腫大、染色體預后、白細胞計數(white blood cell,WBC)、血紅蛋白(hemoglobin,HGB)、血小板計數(platelet,PLT)、造血祖細胞抗原CD34(hematopoietic progenitor cell antigen CD34,CD34)陽性率、核仁磷酸蛋白(nucleophosmin,NPM)突變類型。
1.4.2 miR-10a-5p、miR-203 水平檢測收集AML 患者入院次日清晨空腹狀態下及正常對照組體檢時的外周靜脈血3 mL 置于5 mL 的EDTA 試管中,轉速3 000 r/min離心5 min,吸取上層澄黃色液體至無菌的Eppendorf 管中,-80℃冰箱中保存備用。應用TRIzol 法提取AML 患者及正常對照組受試者血清總RNA,通過分光光度法驗純后根據說明書采用日本TaKaRa 公司的PrimeScriptTM逆轉錄試劑盒進行逆轉錄合成cDNA。采用瑞士羅氏公司的實時熒光定量PCR 試劑盒和美國ABI 公司的ABI7500 熒光PCR 儀進行實時熒光定量PCR檢測。采用Primer 5.0軟件設計實時熒光定量PCR上下游引物,其中miR-10a-5p引物序列如下:上游,5'-GCGGCGGTACCCTGTAGATC CG-3',下 游,5'-ATCCAGTGCAGGGTCCGAGG-3'。miR-203 引物序列如下:上游,5'-AACCTTGCTCGTGAAATGTTTAG-3',下游,5'-TATGCTTGTTCTCGTC TCTGTGTC-3'。擴增40 個循環,每個循環包括預變性95℃20 s,變性95℃10 s、退火57℃20 s、延伸72℃15 s。設定統一的CT 值分析實驗結果,取3 次實驗的平均值。使用cer-miR-39作為內源性對照,通過比較2-△△CT方法計算樣本中miR-10a-5p、miR-203 的相對表達量。
1.4.3 隨訪所有患者均隨訪3 年,統計其生存情況,若中途死亡則隨訪終止。
1.5 評價指標比較初治組和正常對照組受檢者的血清miR-10a-5p、miR-203 表達水平;比較完全緩解組、部分緩解組、未緩解組患者的血清miR-10a-5p、miR-203 表達水平;分析血清miR-10a-5p、miR-203 表達水平與AML 患者的臨床病理特征的關系;分析不同miR-10a-5p、miR-203 表達水平AML患者的預后。
1.6 統計學方法應用SPSS23.0 統計軟件分析數據,計量資料符合正態分布,以均數±標準差(±ss)表示,兩組組間樣本均數比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析;計數資料組間比較采用χ2檢驗;單因素分析血清miR-10a-5p、miR-203 表達與臨床病理特征的關系,生存數據分析采用Kaplan-Meier法,組間差異采用Log-rank 檢驗法,以P<0.05 為差異有統計學意義。
2 結果
2.1 正常對照組與初治組受檢者的血清miR-10a-5p、miR-203 表達水平比較初治組患者的血清miR-10-5p 表達水平明顯高于正常對照組,而血清miR-203表達水平明顯低于正常對照組,差異均有統計學意義(P<0.05),見表1。
表1 正常對照組與初治組血清miR-10a-5p、miR-203 的表達水平比較(±s)
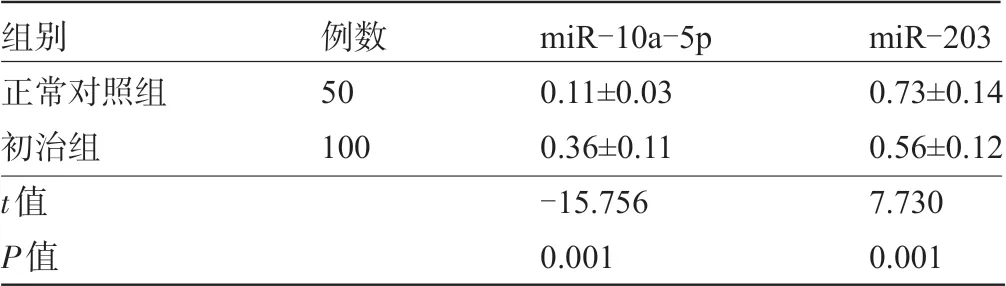
表1 正常對照組與初治組血清miR-10a-5p、miR-203 的表達水平比較(±s)
組別正常對照組初治組t值P值例數50 100 miR-10a-5p 0.11±0.03 0.36±0.11-15.756 0.001 miR-203 0.73±0.14 0.56±0.12 7.730 0.001
2.2 不同療效AML 患者的血清miR-10a-5p、miR-203表達水平比較完全緩解組和部分緩解組的血清miR-10a-5p表達水平均低于未緩解組,且完全緩解組低于部分緩解組,差異均有統計學意義(P<0.05);完全緩解組和部分緩解組的血清miR-203 表達水平均高于未緩解組,且完全緩解組高于部分緩解組,差異均有統計學意義(P<0.05),見表2。
表2 不同療效AML 患者的血清miR-10a-5p、miR-203 表達水平比較(±s)
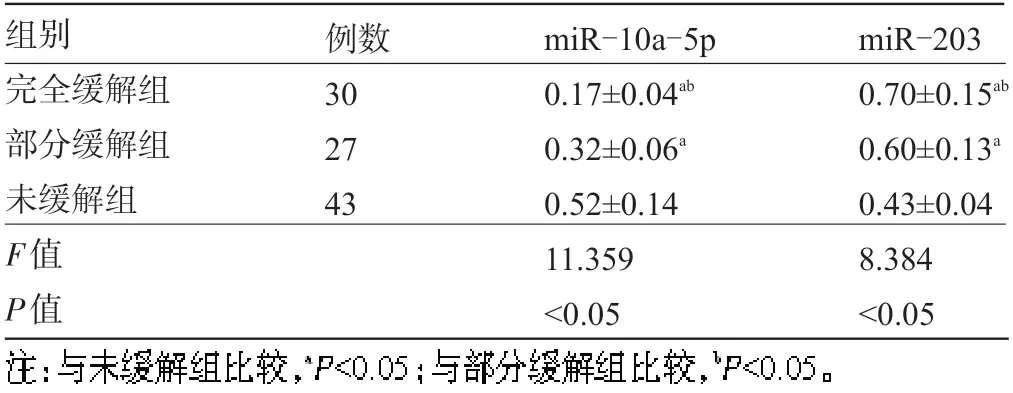
表2 不同療效AML 患者的血清miR-10a-5p、miR-203 表達水平比較(±s)
?
2.3 血清miR-10a-5p、miR-203 表達水平與AML 患者臨床病理特征的關系以中位表達水平分別將100 例初治AML 患者分為miR-10a-5p 高表達組、miR-10a-5p 低表達組以及miR-203 高表達組、miR-203低表達組,單因素分析結果顯示:100例初治AML 患者的血清miR-10a-5p、miR-203 的表達水平與脾腫大及WBC有關(P<0.05),而與患者年齡、性別、染色體預后、HGB、PLT、CD34陽性率、NPM突變無關(P>0.05),見表3。
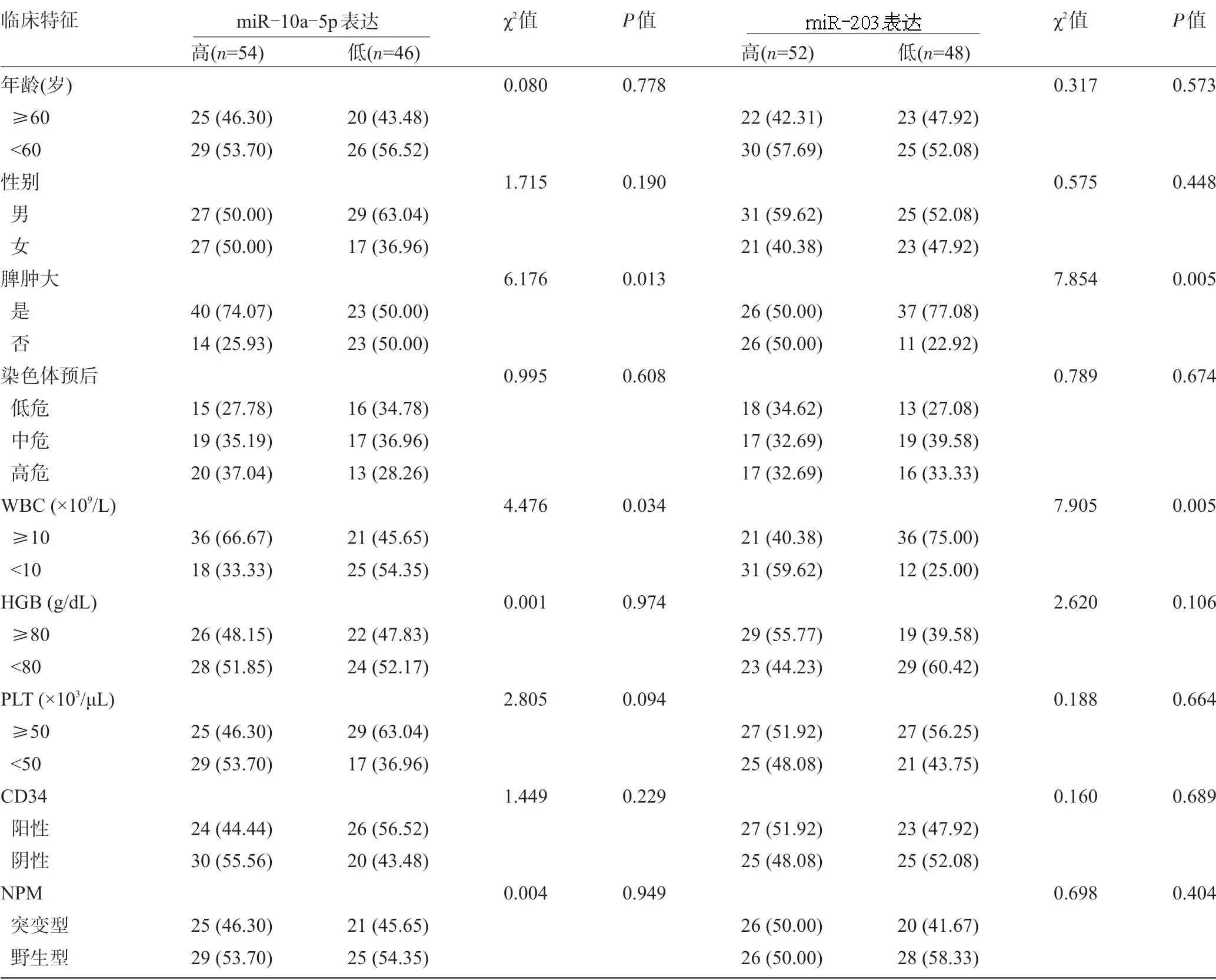
表3 miR-10a-5p、miR-203表達與AML患者臨床特征的關系[例(%)]
2.4 血清miR-10a-5p、miR-203 表達水平與AML 患者預后的關系截止隨訪結束時,100例初治AML 患者死亡55例,存活45例。其中miR-10a-5p高表達的AML 患者生存率為27.78% (15/54),低于miR-10a-5p低表達的65.22% (30/46),差異有統計學意義(Log-rank χ2=21.220,P<0.05);miR-203高表達的AML患者生存率為55.77% (29/52),高于miR-203低表達的33.33% (16/48),差異有統計學意義(Log-rankχ2=14.706,P<0.05),Kaplan-Meier生存率曲線圖見圖1。
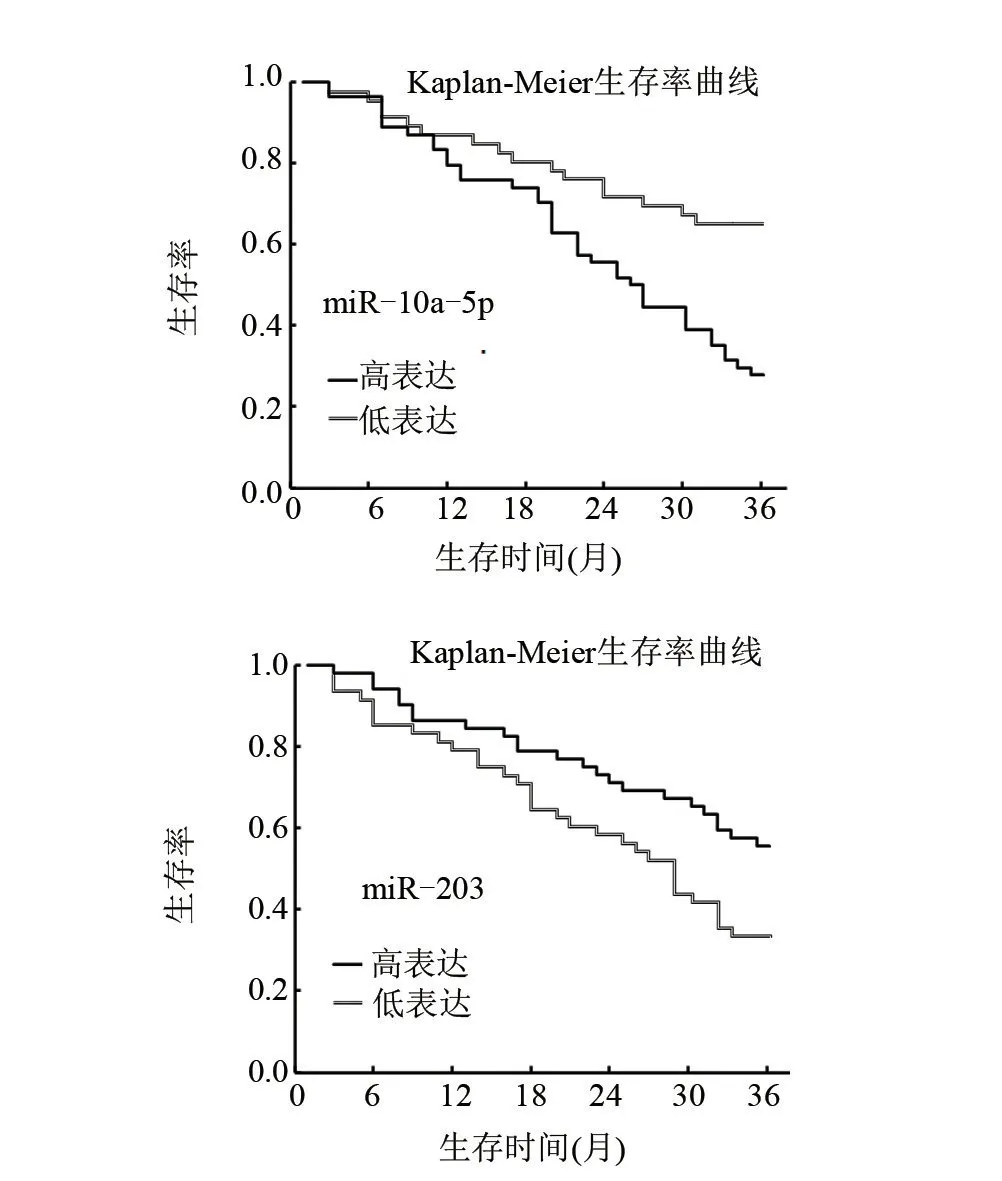
圖1 血清miR-10a-5p、miR-203表達水平與AML患者預后的關系
3 討論
AML是成年群體中最為常見的急性白血病之一,占成年群體急性白血病的80%~90%,目前其發病機制尚未完全闡明[7]。研究顯示miR調控著人體大約30%的基因表達,其可作為促癌基因或抑癌基因參與細胞增殖、分化、凋亡、發育、造血、器官形成等一系列重要的病理生理學過程[8],同時miR 的發現和認識為深入探討腫瘤發生發展的分子機制、臨床診斷、靶向治療及預后評估等方面開啟了新的思路和方法[9]。
miR-10a-5p是近年來新發現的miR-10基因家族的成員之一,相關研究顯示miR-10a-5p作為癌基因可與靶基因相互作用,進而參與多種腫瘤的發生發展,而miR-10a-5p在多種腫瘤中表達異常,但是在不同腫瘤類型中miR-10a-5p 的表達量具有一定的腫瘤異質性[10]。本研究結果顯示,初治AML 患者血清中的miR-10a-5p表達水平明顯高于正常人群,而完全緩解組和部分緩解組的miR-10a-5p 表達水平低于未緩解組,完全緩解組又低于部分緩解組,并且miR-10a-5p高表達的AML 患者預后較差,提示miR-10a-5p 可能是AML不良預后的影響因子,與ZHI 等[11]的研究結果相吻合,這可能與miR-10a-5p可通過抑制腫瘤細胞的凋亡有關[12],既往已有研究顯示敲低miR-10a-5p的表達可靶向抑制血小板反應蛋白2 (platelet reactive protein 2,THBS2)基因的表達,進而抑制胃癌細胞的生長和轉移[9]。而支勇金等[13]檢測到miR-10a在AML患者血清中普遍存在高表達,且與腫瘤負荷相關,提示miR-10a 高表達可能是AML 預后不良的分子標志物之一,但并未發現其表達水平與脾腫大和WBC有關,這可能是該研究樣本量較少所致。
miR-203 定位于染色體不穩定脆性區域14q32-33,參與細胞分化、增殖、遷徙、轉移、凋亡和自噬等生物學過程,同時miR-203還可通過與多種目標靶點如轉錄因子、分泌蛋白、受體、轉運蛋白等相互作用而發揮功能[14]。此外,miR-203在血液系統腫瘤、食管鱗癌、胃癌、肝癌、結直腸癌、膀胱癌、前列腺癌、喉癌、骨肉瘤等多種腫瘤中的表達下調,提示miR-203在腫瘤發生發展中起著抑癌基因的作用[15]。本研究結果顯示,初治AML患者血清中的miR-203表達水平明顯低于正常人群,而完全緩解組和部分緩解組的血清miR-203 表達水平均高于未緩解組,完全緩解組又高于部分緩解組,并且miR-203低表達的AML患者預后較差,提示miR-203在AML中發揮抑癌基因的作用,這可能是因為miR-203 可通過靶向抑制SRC、ABL基因的表達從而抑制腫瘤細胞的增殖[16-17]。ZHANG等[18]研究顯示miR-203 在取自AML 患者的原代培養細胞中表達下調,并且miR-203 直接靶向survivin 和Bmi-1 mRNA 的3'非翻譯區,影響白血病干細胞的增殖和自我更新,證明miR-203/survivin/Bmi-1 軸參與了白血病干細胞生物學特性的調控,以上結果均提示miR-203 的低表達與AML 患者不良預后可能有密切關系,臨床可通過檢測miR-203的表達水平評估AML患者預后不良的風險。
綜上所述,miR-10a-5p、miR-203 在AML 患者中異常表達,且表達水平與脾腫大和WBC 有關,miR-10a-5p高表達及miR-203低表達均提示AML患者具有不良預后的風險。

