湖北楓楊水煎液誘導CIA模型大鼠滑膜細胞凋亡機制研究
陳 明 向 陽*
1.湖北民族大學醫學部,湖北 恩施 445000; 2.風濕病發生與干預湖北省重點實驗室(湖北民族大學),湖北 恩施 445000
類風濕關節炎(Rheumatoid arthritis,RA)是一種慢性自身免疫性疾病,以關節滑膜慢性炎癥及關節的進行性破壞為主要特征,以對稱性多關節炎為主要臨床表現,常見關節處疼痛、腫脹,呈持續性、反復性發作[1-4]。若不及時治療,最終可引起關節畸形,喪失關節功能。RA的發病機制并不十分明確,滑膜細胞增殖與凋亡失衡是目前研究的重要方向。RA滑膜細胞的增殖與炎性細胞浸潤、血管翳形成、侵蝕軟骨及骨組織損傷為主要病理特征,從而導致關節結構破壞、畸形及功能喪失[5]。有研究[6]發現,RA患者滑膜細胞增生明顯,而細胞凋亡率顯著減少,卻并沒有因過度增生出現過多的細胞凋亡,提示滑膜細胞的凋亡障礙可能是導致滑膜增厚的原因之一。有研究[7-8]表明,湖北楓楊(Pterocarya Hupehensis Skan,PHS)通過影響線粒體凋亡途徑誘導RA滑膜細胞凋亡,本實驗建立CIA模型大鼠,用湖北楓楊水煎液進行干預,進一步探討楓楊對CIA大鼠膝關節滑膜凋亡的影響。
1 材料與方法
1.1 實驗動物 SD大鼠60只(200±20)g,購于武漢劍悅生物科技有限公司,許可證號為SCXK(遼)2015-0001。
1.2 藥材與試劑 湖北楓楊樹皮,采自湖北省恩施市清江河灘,經袁林副教授鑒定,為胡桃科Juglandaceae楓楊屬Pterocary Kunth植物。甲醇、異丙醇、冰醋酸(武漢市中天化工有限責任公司);BCA試劑盒、HRP標記的羊抗兔二抗(武漢科瑞生物技術有限公司);雷公藤多苷片(浙江得恩德制藥股份有限公司);牛Ⅱ型膠原、完全弗氏佐劑(美國Sigma公司);大鼠IL-4、IFN-γ、TGF-β、IL-17AELISA試劑盒(酶聯生物);β-Actin 抗體、HRP 羊抗兔二抗(武漢博士德生物工程有限公司);Bcl-xl、Caspase-8(abcam公司);TNFRⅡ抗體(美國CST公司);RIPA裂解液、彩色預染蛋白質分子量標準(10-180kD)、SDS-PAGE蛋白上樣緩沖液、蛋白酶抑制劑(上海碧云天生物技術研究所)。
1.3 設備和儀器 酶標儀(Thermo公司);電泳儀電源(北京六一生物科技有限公司);包埋機(美國通用電氣醫療集團);石蠟切片機(Leica公司);化學發光成像分析儀(美國通用電氣醫療集團)。
2 實驗方法
2.1 模型建立 60只大鼠適應性喂養1周,隨機選取10只作為正常組,其余50只制作CIA模型。
2.2 動物分組 將造模成功的50只大鼠,隨機分為5組,分別為模型組、雷公藤多苷組、低劑量組、中劑量組、高劑量組,每組10只,未造模的10只大鼠作為正常組。
2.3 給藥方案 雷公藤多苷組大鼠予以 6.25 mg/(kg·d) 的雷公藤多苷混懸液灌服,楓楊低、中、高劑量組分別給予2.0 g/(kg·d)、4.0 g/(kg·d)、8.0 g/(kg·d) 的水煎液灌服,正常組、模型組灌服等體積的生理鹽水,每組大鼠每天灌胃1次,連續灌胃28 d。
2.4 取材 灌胃28 d后,禁食禁水12 h,待麻醉成功,打開胸腔,用采血針于心尖搏動處取血,用于ELISA法檢測血清TGF-β、IFN-γ、IL-17A及IL-4水平。充分暴露大鼠雙膝關節腔,髕骨處可見一層淡黃色光滑組織,即為滑膜組織,利用手術刀及手術鑷小心對其進行剝離并分離。
2.5 一般情況 每7天測量一次體重、膝關節直徑、并進行關節炎評分,用以評價關節炎癥程度。關節炎評分按照以下標準:0分:無紅腫;1分:小趾關節紅腫;2分:趾關節和足趾腫脹;3分:踝關節以下的足爪腫脹;4分:包括踝關節在內的全部足爪腫脹。
2.6 HE染色 將組織從多聚甲醛固定液中取出,在通風櫥內用手術刀將目的部位組織修平整,經酒精脫水、二甲苯透明,明膠浸蠟及石蠟樹脂等包埋成含有滑膜組織的石蠟塊。蠟凝固后,從包埋框中取出,并進行修整。將修整好的蠟塊置于切片機上切片,切片漂浮于攤片機溫水上將組織攤平,用載玻片將組織撈起,放入烘箱中烤片。取出切片,置于自動染色機脫蠟染色,再用中性樹膠封片。最后鏡下觀察,并進行病理學評分。關節組織病理學評分標準為:組織無病理學改變,記作0分;輕微炎癥浸潤記為1分;中度記為2分;重度,但無血管翳生成記3分;嚴重的炎癥浸潤,形成血管翳或軟骨、骨侵蝕,記4分。
2.7 ELISA法 檢測血清細胞因子水平 按照ELISA試劑盒方法檢測血清TGF-β、IFN-γ、IL-17A及IL-4水平。
2.8 Western Blot法檢測相關蛋白表達 提取滑膜蛋白,用BCA法測定蛋白濃度,然后將各組蛋白煮沸,加入四分之一體積的蛋白上樣緩沖液(5×)。取適量的樣本,在凝膠中依次加入蛋白上樣緩沖液(1×),Maker,各組蛋白樣本,蛋白上樣緩沖液(1×)進行電泳。再將蛋白轉移至PVDF膜上,用3%濃度的BSA封閉1h,加入不同的一抗進行孵育:TNFRⅡ(1∶1000),Caspase-8(1∶1200),Bcl-xl(1∶1000)。過夜之后取出,TBST溶液洗膜3次,每次10 min,放入二抗(1∶12000),孵育2 h,TBST溶液洗膜3次。最后進行顯色,ImageJ軟件分析條帶的灰度值,以內參β-acting作為對照,得到各目的蛋白的相對表達量。實驗獨立重復3次。

3 結果
3.1 各組大鼠一般情況 正常組大鼠精神狀態較好,體重明顯增加,皮毛順亮,飲食正常,足部皮膚無紅腫情況,活動自如。模型組大鼠體重增長較正常組緩慢,皮毛較為暗淡枯槁,活動量明顯減少,足部皮膚發紅腫起,關節活動受限。各治療組大鼠關節腫脹程度均有所降低,飲食量略有增加,體重逐漸增長,足部皮膚情況也有所改善。
3.2 體重變化 與正常組比較,模型組大鼠體重增長緩慢。用藥后,各治療組大鼠體重均有所增加,楓楊中、高劑量組和雷公藤多苷組體重增長明顯(P<0.05),楓楊低劑量組在用藥2周后體重明顯增加(P<0.05)。如圖1所示。

圖1 大鼠體重變化情況
3.3 楓楊水煎液對CIA模型大鼠膝關節直徑的影響 模型組與正常組相比,關節直徑明顯增大(P<0.05),治療1周后,各用藥組與模型組比較,關節直徑有所減小(P<0.05),到第4周發現,關節直徑明顯減小(P<0.05)。與雷公藤多苷組相比,楓楊高劑量組對大鼠關節腫脹的改善更為顯著(P<0.05)。如圖2所示。
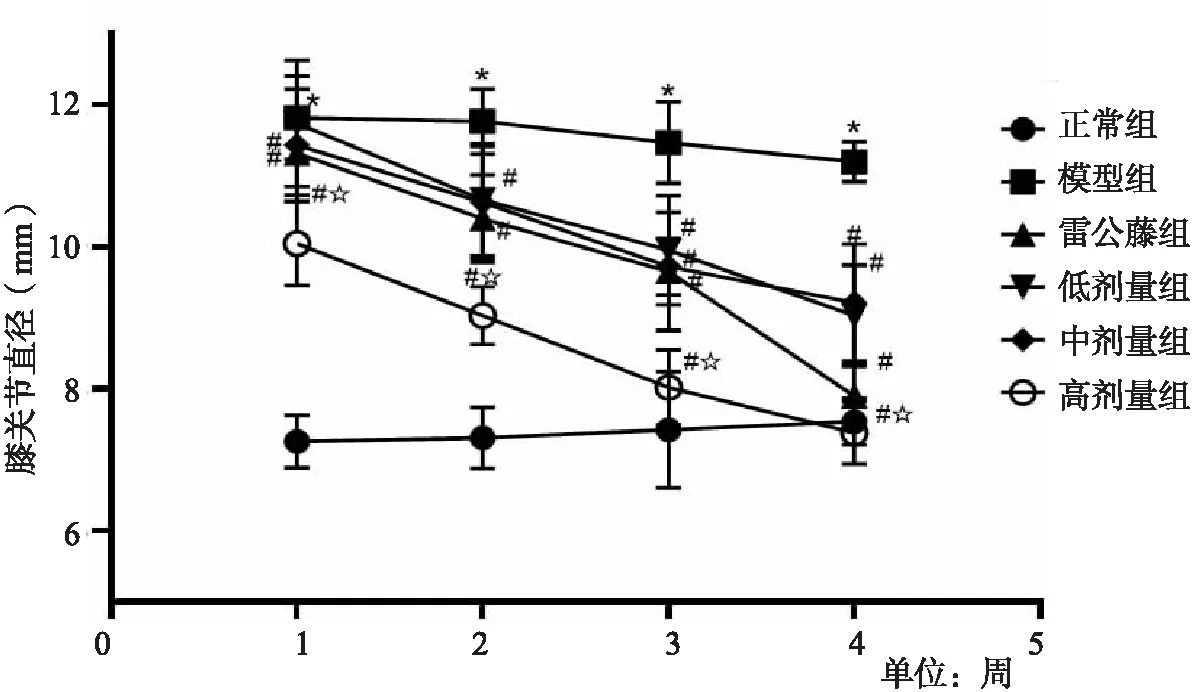
圖2 大鼠膝關節直徑變化情況
3.4 楓楊水煎液對CIA模型大鼠關節炎指數的影響 模型組與正常組比較,有顯著性差異(P<0.01),且模型組數據上升,提示造模成功。治療1周后,雷公藤多苷組和楓楊高劑量組與模型組比較,有顯著性差異(P<0.05),治療2周以后,各治療組與模型組相比,有顯著性差異(P<0.05)。且與雷公藤多苷組相比,楓楊高劑量組對關節炎指數的改善有顯著效果(P<0.05)。如圖3所示。
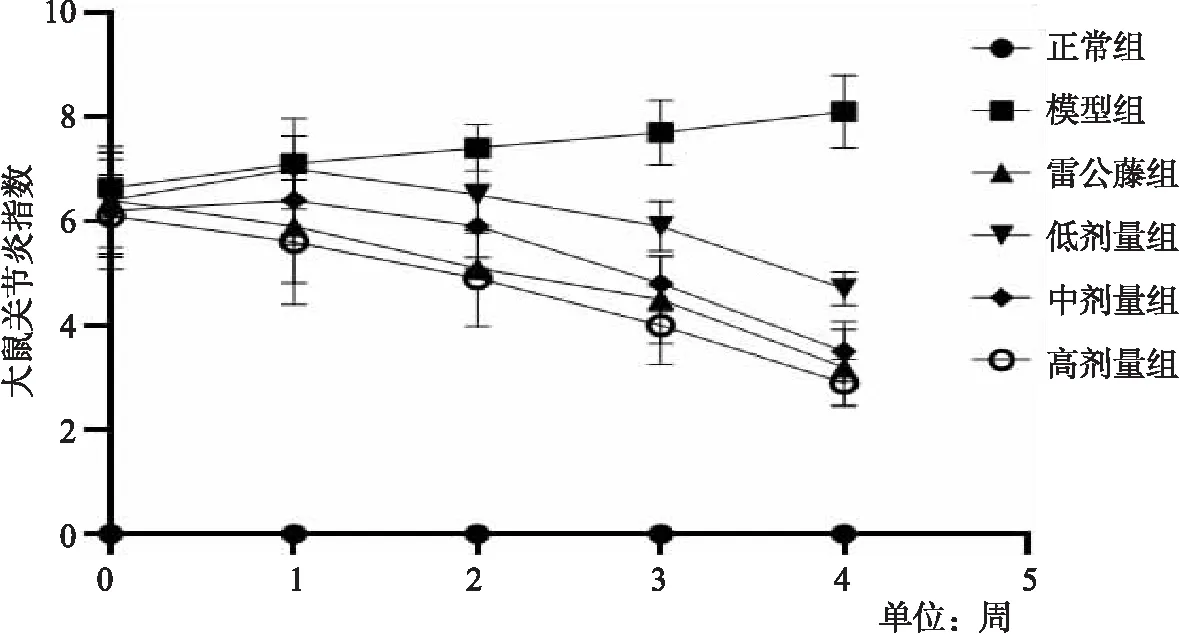
圖3 大鼠關節炎指數變化
3.5 楓楊水煎液對CIA模型大鼠關節滑膜的影響 與正常組比較,模型組大鼠滑膜病理評分明顯升高(P<0.05),與模型組比較,各用藥組病理評分明顯降低(P<0.05),與雷公藤多苷組相比,楓楊高劑量組改善病理方面更為顯著(P<0.05),如圖4所示。鏡下可見:正常組大鼠滑膜組織中無明顯病理變化,模型組出現大量炎性細胞浸潤,滑膜細胞增多,且呈現多層,達到5~6層甚至更多。各用藥組與模型組相比,滑膜增生,炎性細胞浸潤有所緩解,層數也有所減少,而楓楊高劑量組效果最為明顯,如圖5所示。
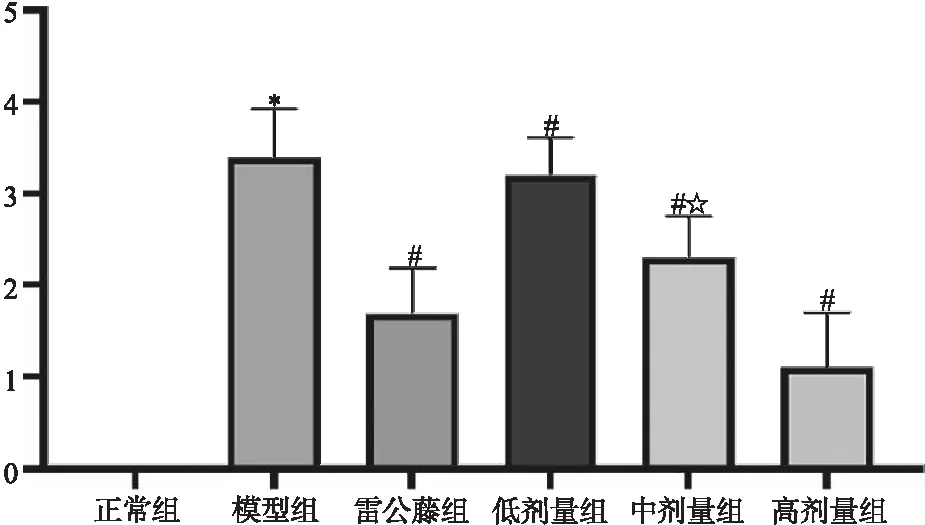
圖4 滑膜組織病理評分注:模型組與正常組比較,*P<0.05;各用藥組與模型組比較,#P<0.05;楓楊高劑量組與雷公藤多苷組比較,☆P<0.05。
3.6 楓楊水煎液對CIA大鼠血清炎性因子水平的影響 與正常組相比,模型組大鼠血清中 TGF-β、IL-4含量明顯降低(P<0.05),IFN-γ、IL-17A含量明顯升高(P<0.05);與模型組相比,各用藥組大鼠TGF-β、IL-4水平明顯提高(P<0.05),IFN-γ、IL-17A顯著降低(P<0.05);與雷公藤多苷組相比,低劑量組對TGF-β含量的升高和IFN-γ的降低更為明顯(P<0.05),高劑量組對IL-17A水平的降低和IL-4的升高更為明顯(P<0.05)。如圖6所示。
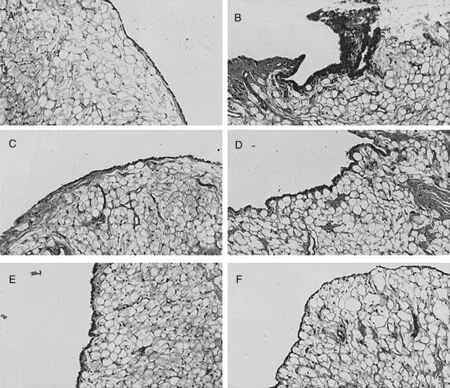
A.正常組;B.模型組;C.雷公藤多苷組;D.低劑量組;E.中劑量組;F.高劑量組圖5 CIA 大鼠膝關節滑膜 HE 染色切片(×20)
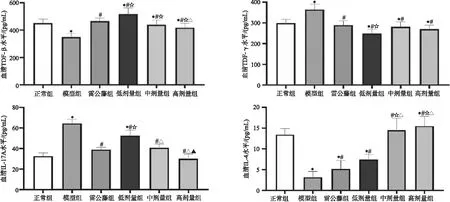
圖6 血清炎性因子含量變化注:與正常組相比較,*P<0.05;與模型組比較,#P<0.05;與雷公藤多苷組比較,☆P<0.05;與低劑量組比較,△P<0.05;與中劑量組比較,▲P<0.05。
3.7 楓楊水煎液對CIA模型大鼠凋亡相關蛋白表達的影響 與正常組相比,CIA大鼠TNFRⅡ、Bcl-xl的蛋白表達顯著增加(P<0.05),Caspase-8的表達顯著降低(P<0.05)。與模型組比較:雷公藤多苷組和楓楊低劑量組大鼠的TNFRⅡ表達明顯降低(P<0.05);楓楊中、高劑量組TNFRⅡ表達反而明顯升高(P<0.05);楓楊低、中、高劑量組Caspase-8蛋白表達顯著增加(P<0.05),且均顯著高于雷公藤多苷組(P<0.05);各用藥組Bcl-xl蛋白表達均降低,其中楓楊低劑量組差異有顯著性意義(P<0.05);楓楊低劑量組Bcl-xl表達水平顯著低于雷公藤多苷組(P<0.05)。如圖7所示。
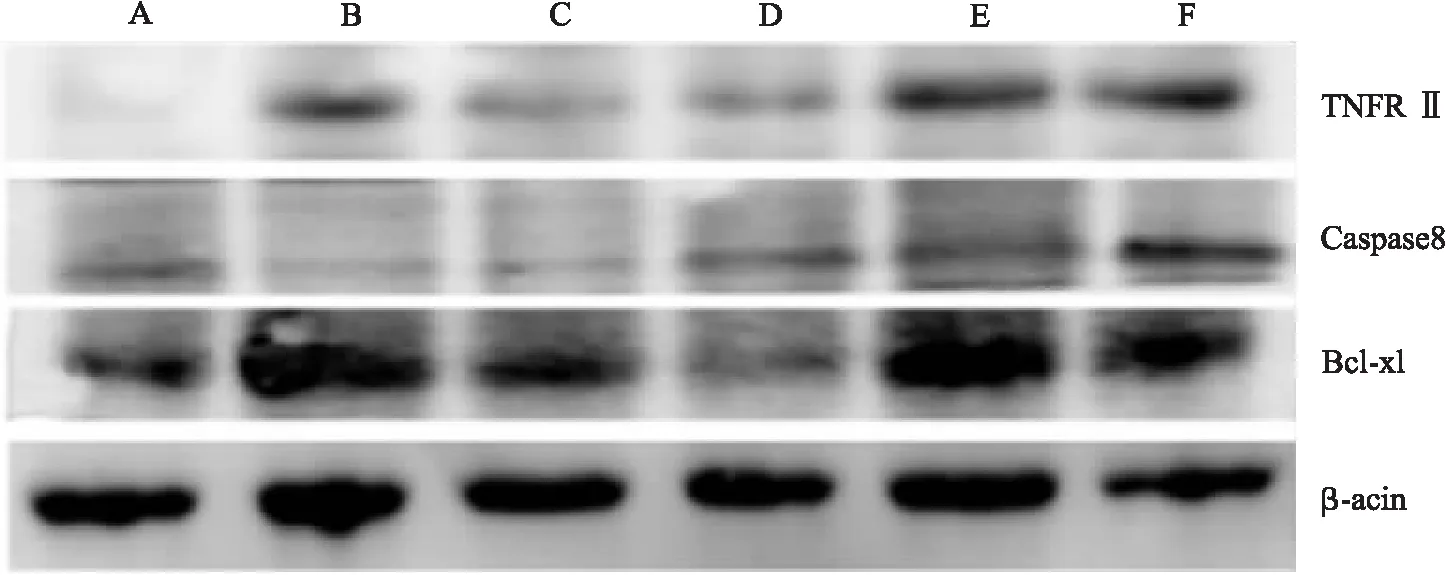
A.正常組;B.模型組;C.雷公藤多苷組;D.低劑量組;E.中劑量組;F.高劑量組
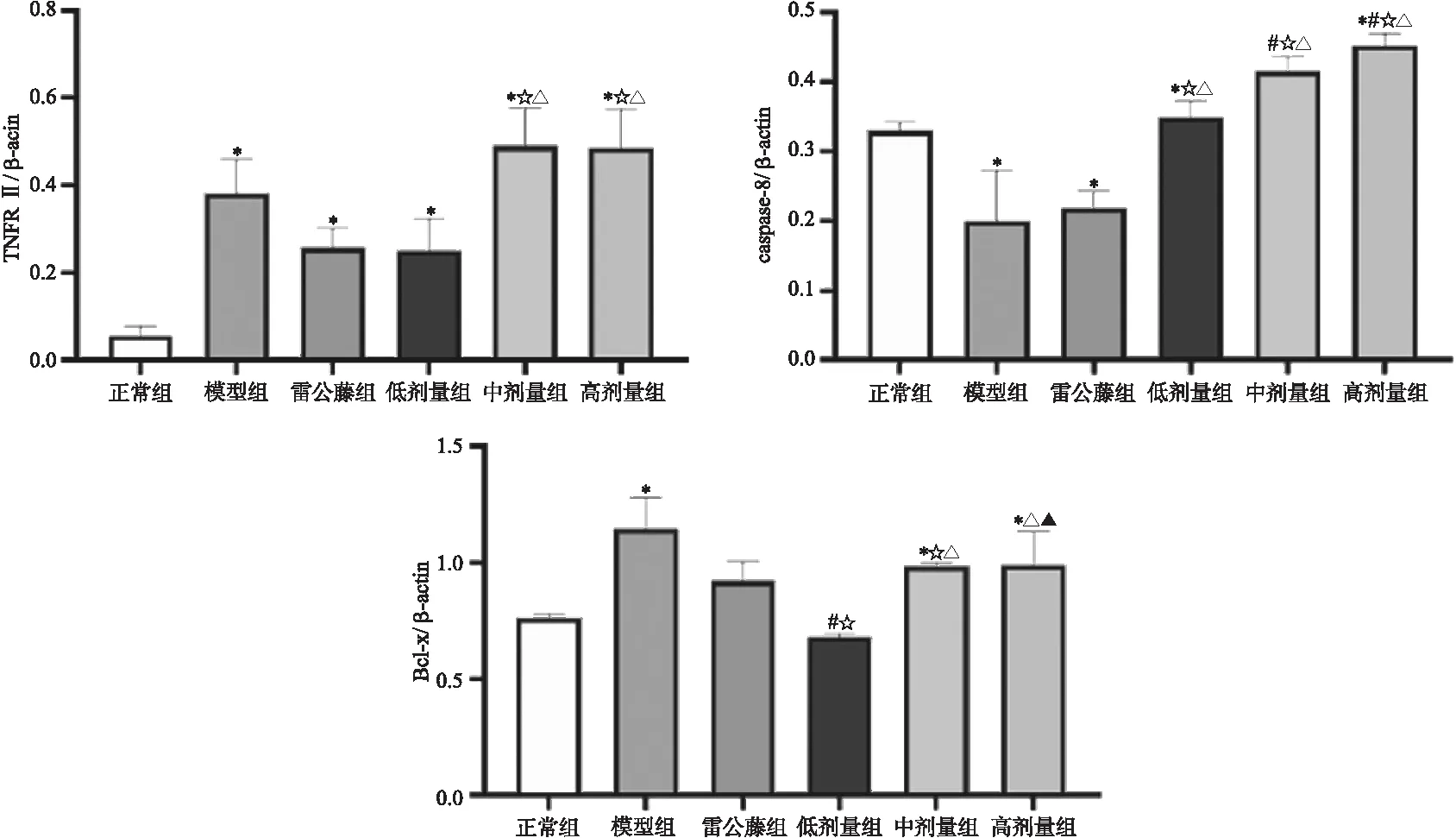
圖7 各組大鼠凋亡相關蛋白表達灰度比值注:與正常組比較,*P<0.05;與模型組比較,#P<0.05;與雷公藤多苷組比較,☆P<0.05;與低劑量組比較,△P<0.05;與中劑量組比較,▲P<0.05。
4 討論
細胞凋亡有兩個途徑:內源性途徑和外源性途徑[9]。線粒體是發生內源性途徑的重要細胞器,而細胞表面死亡受體是介導含半胱氨酸的天冬氨酸水解酶-8(Cysteinyl aspartate specific proteinase-8,caspase-8)激活的外源性途徑[10]。外源性途徑中,死亡受體激活的起始Caspase是Caspase-8,Caspase-8可通過激活Caspase-3執行凋亡。另外,還能夠切割細胞基質中的B細胞淋巴瘤(B-cell lymphoma-2,Bcl-2)蛋白家族成員Bid前體[11],形成截斷的Bid(tBid),tBid可進入線粒體中,并促使Bax等蛋白產生寡聚反應,誘導細胞色素C(Cytochrome C,Cyt-C),同時使凋亡誘導因子AIF及其他相關凋亡信號從線粒體釋放,進而誘導細胞凋亡[12]。研究發現楓楊水煎液可使大鼠滑膜組織凋亡誘導蛋白Caspase-8表達增加,凋亡抑制蛋白Bcl-xl表達降低。結合前期研究結果,說明楓楊能夠通過上調Capase-8并作用于Caspase-3和B細胞淋巴瘤-xl(B-cell lymphoma-xl,Bcl-xl)蛋白,引起Cyt-C和其他凋亡信號的釋放增加,從而促進滑膜細胞凋亡。
腫瘤壞死因子受體(Tumor necrosis factor receptor,TNFR)在免疫系統及相關疾病中發揮重要作用,包括Ι型(TNFRΙ)和Ⅱ型(TNFRⅡ)。腫瘤壞死因子-α(Tumor necrosis factor-α,TNF-α)可分別與TNFRΙ和TNFRⅡ結合,介導不同的生物學活性[13]。在正常生理情況下,TNF-TNFRs系統保持凋亡與增殖兩方面功能的平衡,病理條件下,介導兩條相反的信號通路,會破壞這種平衡,導致機體免疫環境與功能紊亂,引起滑膜組織增生與炎癥,發生疾病。體外分別培養RA患者與正常人的成纖維滑膜細胞[14],發現與健康人相比,RA患者的滑膜細胞增生是通過上調TNFRΙ,下調TNFRⅡ表達,來激活TNFR相關因子,導致核轉錄因子-κB(Nuclear factor-kappaB,NF-κB)進一步活化,阻礙細胞的正常凋亡,造成滑膜細胞過度增殖,組織增生。Blüml研究[15]發現,TNFRΙ是關節炎發生的主要原因,而同時存在的TNFRⅡ對關節炎有保護作用。TNFRⅡ胞內不存在死亡結構域[16],但是能夠募集腫瘤壞死因子受體相關因子2(TNF receeptor associated factor 2,TRAF2),激活絲裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)和NF-κB信號通路,發揮抗炎作用。
實驗結果顯示,楓楊干預CIA大鼠后,低劑量組下調TNFRII,與雷公藤多苷作用相似;而中、高劑量則對TNFRⅡ有上調作用,與雷公藤多苷完全相反。楓楊對TNFRII明顯的雙向調節現象的機制與意義尚不清楚,但值得進一步研究。考慮到TNFRII對關節炎癥的保護作用,推測中、高劑量楓楊通過上調TNFRⅡ表達,與TNFRΙ競爭TRAF2,從而促進滑膜細胞凋亡,同時抑制NF-κB信號通路上的炎癥因子的釋放,參與抗炎通路中的炎癥反應過程。這一發現對選擇楓楊治療劑量具有重要參考價值。前期細胞實驗結果顯示,湖北楓楊可通過調控相關蛋白的表達,影響線粒體凋亡途徑,從而誘導MH7A細胞凋亡。本研究對前期實驗進行了延伸,在動物水平進行研究,證實在湖北楓楊對CIA大鼠滑膜細胞的凋亡具有促進作用,其機理可能是通過調節凋亡相關蛋白TNFRⅡ、Bcl-xl和Caspase-8的表達實現的。

