兔骨折血腫細胞分離回植對骨折愈合的影響及機制的研究
馬震卓 郝 鑫 石光耀 張 霖 于淑紅 申國強 蔡成坤 張 新
對骨折愈合的研究隨著分子生物學技術的發展,已經從細胞生物學水平深化到分子生物學水平[1-3]。研究者[3-6]發現,在骨折血腫細胞中存在各種生長因子,包括血小板衍生生長因子(platelet derived growth factor,PDGF)、骨形態發生蛋白(bone morphogenetic protein,BMP)、轉 化 生 長 因 子?β(transforming growth factor?β,TGF?β)、血管內皮生長 因 子(vascular endothelial growth factor,VEGF)及骨保護素(osteoprotegerin,OPG)等。盡管各種生長因子在骨組織及血腫細胞中含量較少,但在骨折愈合過程的不同時期中,對調節骨細胞分裂、細胞黏附、細胞增殖、細胞遷移、細胞外基質合成及組織分化等起著不可替代的作用[7-10]。
方 法
1.實驗動物
選取雄性新西蘭大白兔36只(北華大學中心實驗室提供),體重2.5~3 kg,兔齡7~8個月。平均分成實驗組和對照組,每組18只動物。
2.骨折模型制備和分組處理
用25%烏拉坦麻醉劑對實驗兔進行麻醉,按4 ml/kg經耳緣靜脈緩慢推注,麻醉后固定于手術臺上,對實驗兔右下肢股骨髁上下5 cm范圍進行剪毛處理,局部碘伏消毒3遍,股骨髁上部周圍注射鹽酸利多卡因浸潤麻醉,用外骨折器在股骨髁上制作閉合骨折模型[7,11]。骨折兔放置2 h后,無菌操作,切開皮膚肌肉,分組進行相應處理。
實驗組:快速收集骨折斷端周圍血腫細胞液,無菌條件下制備并分離骨折血腫細胞,對骨折斷端行鋼針內固定。將可吸收性明膠海綿吸附分離后的血腫細胞液,放置于骨折斷端,使其緩慢釋放。對照組:按常規方法去除骨折斷端周圍血腫細胞液后行鋼針內固定。分別于術后第10、20、30天,每組各隨機選取6只動物處死,取材后進行影像學和組織學觀察。
3.X線檢查
觀察股骨髁骨折處骨痂形成數量,骨質密度情況。影像學評分標準:①0分,骨折斷端邊緣清晰,無骨膜反應;②1分,骨折斷端邊緣較模糊,輕微骨膜反應;③2分,骨折邊緣模糊,骨膜反應淺、少量骨痂、密度淡;④3分,骨折斷端接近消失,骨膜反應深、骨痂增多、密度深;⑤4分,骨折斷端邊緣完全消失,骨膜反應近似骨影、骨痂充滿缺損區、密度與骨皮質相同。
4.組織學觀察
在無菌條件下取骨,將股骨干周圍軟組織清除干凈,在距股骨髁骨折處兩端1 cm處整齊鋸下標本骨,將其放入10%中性甲醛溶液中,固定12 h后用磷酸鹽緩沖液(PBS)沖洗,再加入10%乙二胺四乙酸(EDTA)溶液中脫鈣5周后,經脫水-透明-浸蠟-包埋備用。
4.1 HE染色及觀察
制作石蠟切片,以5 mm厚度為標準。經脫蠟-水化-蘇木精染色-鹽酸酒精分化-伊紅染色-脫水透明,最后中性樹膠封片。光鏡下觀察HE染色切片,觀察骨痂生長的組織形態,以及HE染色骨組織切片中成骨細胞的數量。
4.2 免疫組織化學染色(SP法)
將標本分組,分別滴加蒸餾水稀釋后,加入1︰300的PDGF抗體、TGF?β抗體作為一抗。放置于4℃冰箱過夜12 h,在標本中分別滴加SP(鏈霉親和素?過氧化物酶),滴加已經先配制的二氨基聯苯胺(DAB)顯色溶液顯色,放入蘇木精溶液中復染。在顯微鏡下鏡檢觀察,同時記錄數據,照相、存盤。
5.統計學分析
采用spss19.0軟件進行數據處理和分析。計量資料以均數±標準差表示,符合正態分布者采用t檢驗。以P<0.05為差異有統計學意義。
結 果
1.一般情況
2組實驗兔術后1周進食恢復正常,活動恢復正常,切口無感染。術側肢體可自然活動。
2.X線表現
術后第10天,2組實驗兔均無明顯骨痂形成,實驗組骨折斷端輕度模糊征象。術后第20天,對照組骨折斷端邊緣模糊,多數均無明顯骨痂形成;實驗組骨折斷端見有少量骨痂形成,骨痂的密度低于正常的骨質的密度。術后第30天,對照組與實驗組骨折斷端均有骨痂出現,且骨痂密度均高于術后第20天,實驗組骨痂量明顯高于對照組,少數對照組骨折斷端局部可見低密度骨折線。2組影像學評分詳見表1。
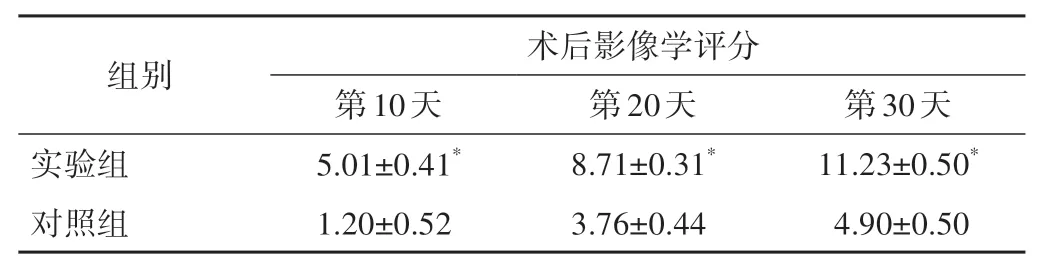
表1 實驗組與對照組術后不同時間影像學評分
3.HE染色結果
實驗兔術后不同時間骨折斷端標本HE染色結果見圖1。對HE染色切片中的細胞進行計數,結果(表2)顯示,術后第10、20、30天,實驗組中的成骨細胞數量均多于對照組。
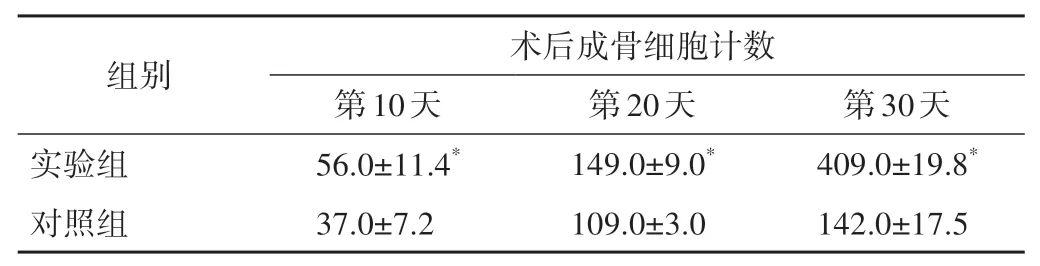
表2 實驗組與對照組成骨細胞數量對比
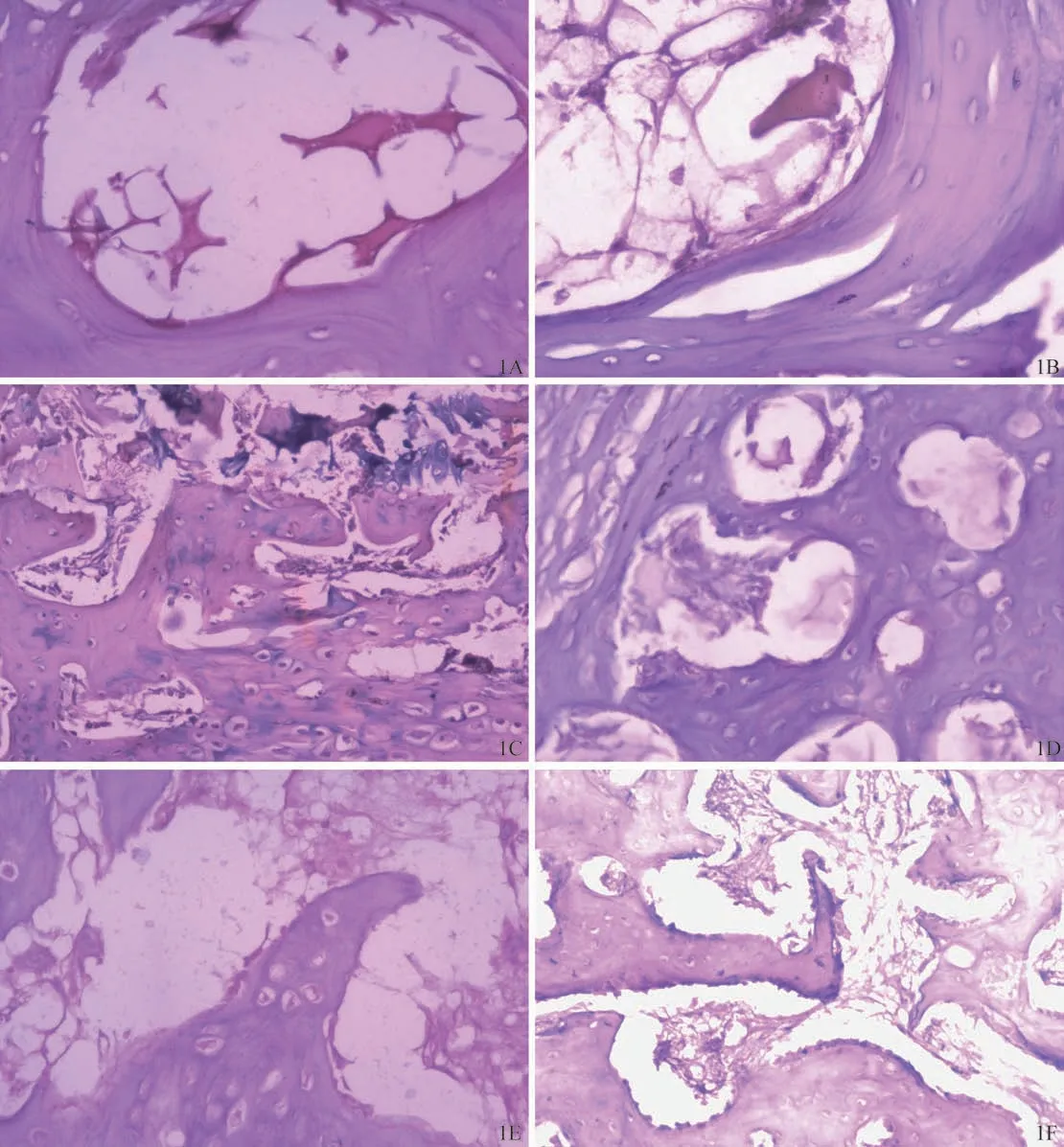
圖1 實驗組和對照組術后不同時間骨折斷端標本HE染色結果
4.免疫組織化學染色結果
4.1 PDGF在骨組織中的表達
實驗兔術后不同時間骨組織PDGF免疫組織化學染色結果見圖2。術后第10天,實驗組成骨細胞免疫表達弱陽性;對照組無陽性表達,僅見骨細胞存在。術后第20天,實驗組成骨細胞免疫表達為強陽性;對照組免疫弱陽性表達。術后第30天,實驗組骨細胞免疫表達強陽性,與術后第20天的表達強度相仿;對照組弱陽性表達。實驗兔術后不同時間骨組織PDGF表達強度詳見表3。
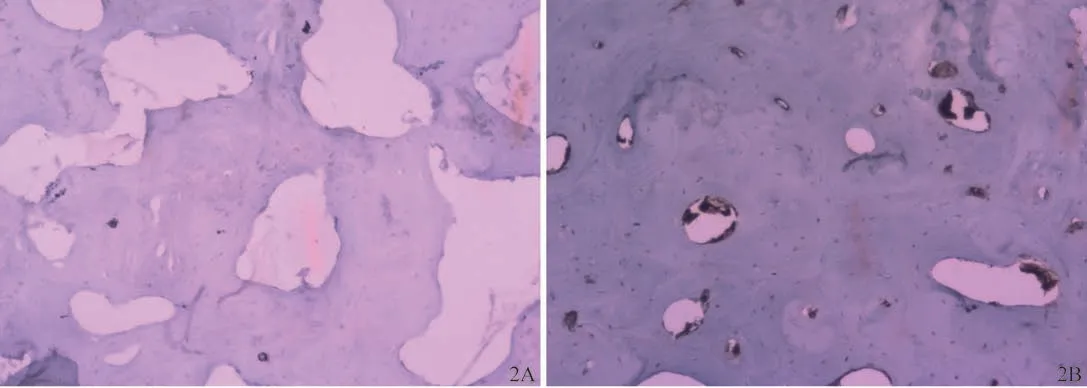
圖2 實驗組與對照組骨組織PDGF的表達(×40)
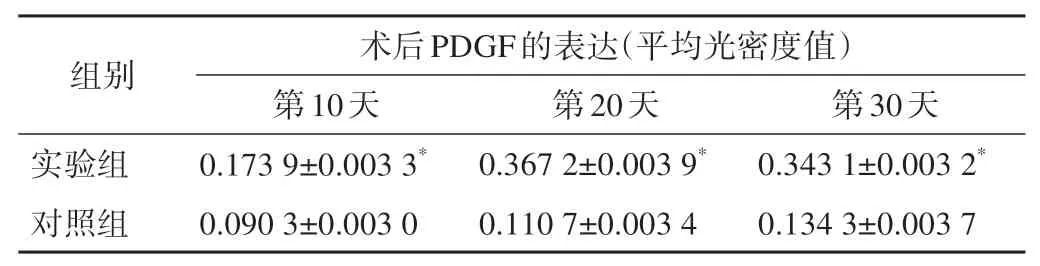
表3 骨折愈合不同時間成骨細胞PDGF的表達
4.2 TGF-β在骨組織中的表達
實驗兔術后不同時間骨組織TGF?β免疫組織化學染色結果見圖3。術后第10天,實驗組在骨組織骨小梁周圍見少量顏色較淺淡的棕黃色顆粒,為成骨細胞TGF?β的弱陽性表達;對照組沒有陽性表達,僅見骨細胞存在。術后第20天,實驗組骨組織骨小梁周圍見密集排列的成骨細胞,其顏色為深棕黃色顆粒改變,TGF?β呈強陽性表達;對照組仍沒有陽性表達。術后第30天,實驗組骨組織骨小梁周圍成骨細胞數量減少,TGF?β表達強度有所降低,但仍比術后第10天強;對照組骨組織周圍見少量淺淡的棕黃色顆粒,呈弱陽性表達。實驗兔術后不同時間骨組織TGF?β表達強度詳見表4。
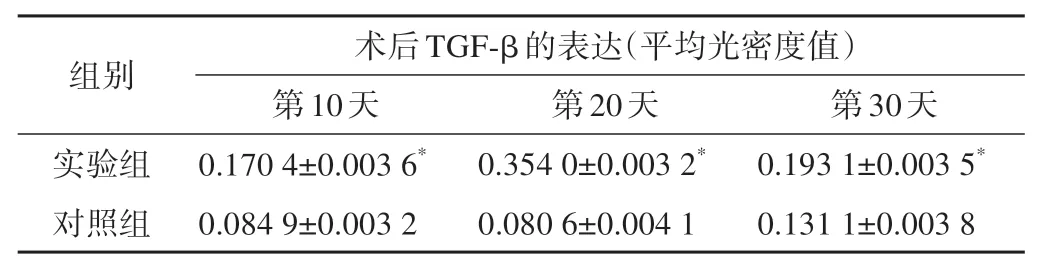
表4 骨折愈合不同時間成骨細胞TGF?β的表達
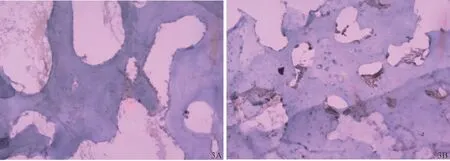
圖3 實驗組與對照組骨組織TGF?β的表達(×40)
討 論
骨折血腫能夠促進骨折愈合已經被人們所認知,國內外已經有大量的實驗及病例報道[12-15],骨折血腫在增加骨痂形成數量、加速骨痂形成、縮短骨折愈合時間方面有著顯著的促進作用[16]。
骨折愈合是復雜的修復再生過程,主要包括早期的損傷反應期,中期的膜內化成骨期、軟骨形成期和晚期的軟骨內化骨。機體出現骨折后,骨折斷端及周圍軟組織形成血腫,血腫細胞內富含多種生長因子及大量炎性細胞,促進骨折傷口愈合的同時清除壞死的炎性組織,為骨折愈合全過程起到良好的開始作用[17-20]。本研究結果提示,骨折血腫分離細胞回植后,骨組織表達的細胞因子在骨折愈合的不同時期發揮著重要作用。
本實驗結果表明,骨折血腫分離細胞回植后,骨折愈合無明顯感染及排斥反應,提示其可促進骨折愈合。在HE染色切片任選視野下觀察,可見成骨細胞規則排列在骨組織表面,呈棕黃色強陽性表達。在骨折愈合不同時期,成骨細胞數量有所不同。X線片骨折斷端骨痂定量分析證實,實驗組較對照組骨痂形成時間短,數量多。通過測定骨折愈合不同時間骨組織PDGF和TGF?β的表達,證實促進骨折愈合的分子機制可能部分與其中PDGF及TGF?β的表達增強有關。
骨折早期,PDGF表達逐漸增強,促進成骨細胞DNA合成,加速其復制潛能,誘導軟骨細胞分化為成骨細胞,以促進纖維骨痂的形成。骨折晚期,在骨折斷端骨痂形成較多,骨痂塑形開始,骨折處骨細胞的吸收與破壞是同時進行的,此時PDGF呈強陽性表達,同樣說明其加速骨折愈合,發揮雙向調節骨折愈合的作用。從分子水平上研究骨折修復的機制,已成為骨折愈合修復的前沿研究方向,將有助于骨折治療研究的開展及新策略的制訂,并指導臨床工作中對骨折后早期血腫處理,最終對促進骨折愈合、防止延遲愈合或不愈合等并發癥有重要意義。

