黃粉蟲蛋白對小鼠腦和肝Nrf2、HO-1、GCLC、NQO1基因表達的影響
劉永華,王秀君,閻 峰,許文元,付運星*
(1.漯河立蓓生物科技有限公司,河南 漯河 462300;2.河南牧業經濟學院;3.鄭州市農業行政綜合執法支隊)
1 材料與方法
1.1 試驗試劑
試驗飼料黃粉蟲蛋白飼料購自鄭州立蓓有限公司;D-半乳糖購自天津市凱通化學試劑有限公司;反轉錄試劑盒及Trizol試劑均購自賽默飛世爾科技(中國)有限公司;SuperReal熒光定量預混試劑購自天根生化科技有限公司。
1.2 試驗動物
75只30日齡的昆明小鼠。飼養環境:室溫(22±2)℃,濕度50%±10%,光照明暗各12 h,每日早8點晚6點投食換水,確保小鼠可以自由攝食和飲水,墊料每周更換兩次,保持衛生狀態,防止因衛生狀況出現疾病。
1.3 試驗分組
為防止小鼠出現應激,在適應性喂養小鼠3 d后,將75只昆明小鼠分為A、B、C、D、E五組。其中A組為對照組,B組為模型組,C、D、E組為試驗組,具體試驗方法見表1試驗小鼠的飼喂方案。分組后進行造模即每日對試驗組和模型組小鼠進行皮下注射濃度為0.15 g/ml的D-半乳糖溶液(生理鹽水溶解)0.05 ml,在造模一周時間后觀察小鼠無應激反應則加大D-半乳糖溶液注射量,由最初的每天每只0.05 ml每周遞加0.02 ml注射量,連續8周。

表1 試驗小鼠的飼喂方案
1.4 試驗設備與器材
試驗中使用到的設備與器材見表2。
表2 試驗中使用到的設備
1.5 熒光定量聚合酶鏈式反應(qPCR)檢測方法
造模給藥后,取各組小鼠的腦、肝組織,提取腦、肝組織中的總RNA,反轉錄合成cDNA,試劑盒擴增,qPCR法檢測小鼠肝臟組織中Nrf2、HO-1、GCLC和NQO1的mRNA相對表達水平,GAPDH為內參。具體引物序列見表3。
表3 檢測基因所用引物序列
1.5.1 Trizol法提取RNA
Trizol是一種總RNA抽提試劑,含有異硫氰酸胍等物質,能夠迅速破碎細胞,抑制細胞釋放出核酸酶。
①剪取1 mg冰凍組織放入1.5 ml離心管并加入300 ul Trizol試劑靜置1h。
②使用研磨棒將組織研碎后加入100 ul氯仿和500 ul Trizol試劑后搖勻并靜置5 min后放入離心機離心,以徹底分離核蛋白復合體。離心機設定條件為12,000×g,15 minutes,4℃。
③吸取離心后的上清液400 ul加入1.5 ml離心管中后再加入400 ul異丙醇搖勻后放入離心機離心設定條件為12,000×g,15 minutes,4℃。注意全程轉移樣品時應使用無RNA酶試驗器材。
④除去上清液留下離心管底部沉淀,加入1 000 ul濃度為75%乙醇(無RNA酶水配置)后放入冰箱-20℃保存。
1.5.2 RNA反轉錄合成cDNA
①存有RNA的離心管離心(12,000×g,5 minutes,4℃)后除去上清液并靜置5 min使酒精揮發,再向其中加入無RNA酶水20~100 ul(視沉淀數量酌情添加),吹打混合均勻,要求一樣品一個槍頭,防止樣品污染。
②根據表格4配制反應體系以除去樣品中的基因組DNA(gDNA)污染,混合均勻37℃孵育2 min,為預混樣1。

表4 預混樣1反應體系
③根據表5配制反應體系以進行RNA反轉錄,為預混樣2。之后將預混樣1和預混樣2進行混合。吹打混勻后進行水浴加熱。要求42℃加熱1 h接著80℃加熱10 min,-20℃保存。

表5 預混樣2反應體系
1.5.3 熒光定量PCR步驟
①配制反應液20 ul規格加入八聯管中,離心后放入ABI 7500 PCR儀器檢測。配制所需溶液如表6。

表6 檢測反應體系
②ABI 7500 PCR儀器程序的設定,如表7。
表7 儀器程序的設定
2 結果與分析
2.1 黃粉蟲蛋白對小鼠腦組織相關基因表達的影響
黃粉蟲蛋白對小鼠腦組織相關基因表達的影響結果見圖1,在檢測了各組小鼠腦組織中Nrf2、HO-1、GCLC和NQO1基因的mRNA表達水平后結果顯示,與正常組比較,模型組小鼠Nrf2、HO-1、GCLC和NQO1的mRNA表達明顯下調(P<0.05或P<0.01)。與模型組比較,除黃粉蟲蛋白低劑量組Nrf2、HO-1和黃粉蟲蛋白中劑量組HO-1 mRNA表達水平無統計學意義外,其余黃粉蟲蛋白低、中、高劑量組Nrf2、HO-1、GCLC和NQO1的表達均上調(P<0.05或P<0.01)。
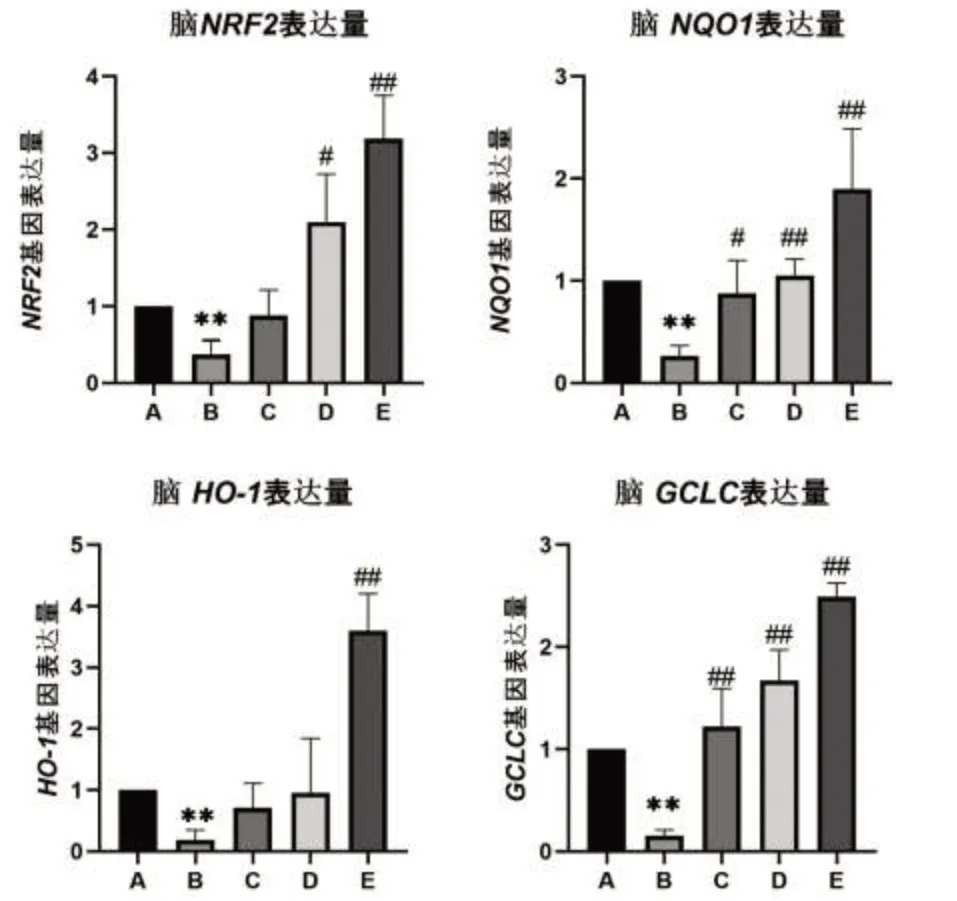
圖1 小鼠腦組織Nrf2、HO-1、GCLC、NQO1基因表達量
2.2 黃粉蟲蛋白對小鼠肝組織相關基因表達的影響
黃粉蟲蛋白對小鼠肝組織相關基因表達的影響結果見圖2,在檢測了各組小鼠肝組織中Nrf2、HO-1、GCLC和NQO1基因的mRNA表達水平后結果顯示,與正常組比較,模型組小鼠Nrf2、HO-1、Gclc和NQO1的mRNA表達明顯下調(P<0.05或P<0.01)。與模型組比較,除黃粉蟲蛋白低劑量組HO-1、Nrf2、NQO1表達水平無統計學意義外,其余黃粉蟲蛋白低、中、高劑量組Nrf2、HO-1、Gclc和NQO1的表達均上調(P<0.05或P<0.01)。
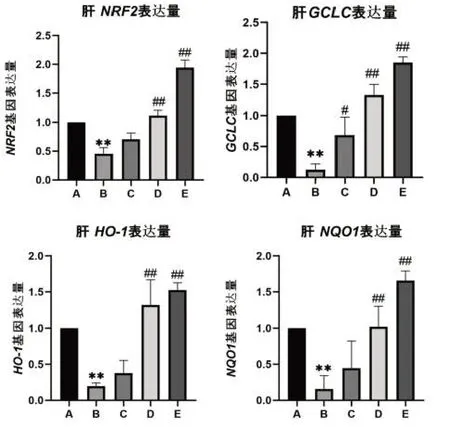
圖2 小鼠肝組織Nrf2、HO-1、GCLC、NQO1基因表達量
3 討論
氧化應激指機體內活性氧(reactive oxygen species,ROS)與抗氧化成分平衡發生崩壞后而引起的一系列適應性反應。ROS是在正常的生理過程中產生的,如果在無外界刺激源的條件下,機體內ROS的產生和消除是處于一種動態平衡的狀態下的。但是如果機體內的ROS含量相對升高而機體無法及時將其清除,這就會使得機體組織中的過氧化水平明顯升高引發一系列反應后導致機體受到損害。肝、腦的氧化應激是其發生損傷、發展為疾病的重要機制之一,因此,抑制氧化應激就成為防止肝腦損傷、疾病發生的一個有效途徑。
在對抗氧化的研究中,人們普遍認為最為重要的內源性抗氧化通路之一就是Nrf2-ARE信號通路。其中Nrf2是調節氧化應激反應的重要轉錄因子,其靶基因編碼的蛋白具有抗氧化、解毒和抗炎等廣泛的細胞保護作用。而ARE是一種能編碼啟動子區域的多種解毒酶和細胞保護蛋白基因的增強子序列。正常生理狀態下,Nrf2通過與ECH聯合蛋白1(Keap1)特異性結合于細胞質中,此時Nrf2的活性受到抑制,Nrf2蛋白是處于低水平的,這是因為Keap1是一個Nrf2的E3泛素連接酶底物接頭,可導致蛋白酶體的快速降解。更重要的是,Keap1是含有高活性的半胱氨酸,一旦被活性氧(ROS)或其他親電試劑刺激時,就會阻止對Nrf2進行蛋白酶體降解,從而導致Nrf2蛋白在氧化應激下迅速積累,激活后的Nrf2進入細胞核,并與小肌肉腱膜纖維肉瘤癌基因同源物(s MAF)蛋白結合形成二聚體,并與順式作用元件ARE相結合,啟動下游抗氧化保護性基因和Ⅱ相解毒酶基因的轉錄,包括血紅素氧化酶(HO-1)、NAD(P)H醌氧化還原酶(NQO1)、谷氨酸半胱氨酸連接酶(GCL)等。這些抗氧化物質能夠保護機體和細胞免受ROS及一些毒性物質(如致癌物、藥物活性代謝產物等)的侵害。
在對試驗數據及試驗結果進行處理分析后,從圖1中的四組柱狀圖里組A對照組和組B模型組的基因表達量對比中可以得出結論:GAL誘導小鼠成功建立衰老模型。并且,在與模型組的對照中可見Nrf2、HO-1低濃度黃粉蟲蛋白組和HO-1中濃度黃粉蟲蛋白組表達量水平無明顯差異。由此結合四組柱狀圖及結果可得出:低濃度黃粉蟲蛋白組對于腦Nrf2、HO-1、NQO1基因表達無明顯積極影響,對GCLC基因表達卻有明顯的積極影響,中濃度黃粉蟲蛋白組對腦HO-1基因表達無明顯積極影響,對腦Nrf2、NQO1、GCLC基因表達卻有著較為明顯的積極影響。高濃度黃粉蟲蛋白組則對腦Nrf2、HO-1、NQO1、GCLC基因表達均有著明顯的積極作用,其基因表達量均較大幅上調。
同理,在對試驗數據及試驗結果進行處理分析后,從圖2中的四組柱狀圖里組A對照組和組B模型組的基因表達量對比中可以得出結論:GAL誘導小鼠成功建立衰老模型。并且,在與模型組的對照中可見Nrf2、HO-1低濃度黃粉蟲蛋白組和HO-1中濃度黃粉蟲蛋白組表達量水平無明顯差異。由此結合四組柱狀圖及結果可得出:低濃度黃粉蟲蛋白組對于腦Nrf2、HO-1、NQO1基因表達無明顯積極影響,對GCLC基因表達卻有明顯的積極影響,中濃度黃粉蟲蛋白組和高濃度黃粉蟲蛋白組則對腦Nrf2、HO-1、NQO1、GCLC基因表達均有著明顯的積極作用,其基因表達量均較大幅上調。
4 結論
該試驗結果說明,一定濃度的黃粉蟲蛋白或許能提高Nrf2、HO-1、NQO1及GCLC基因表達量,從而緩解、抑制氧化應激反應,提示黃粉蟲蛋白可能是通過激活Nrf2-ARE信號通路來緩解D-半乳糖誘導的衰老模型小鼠的肝、腦衰老受損,可能為臨床黃粉蟲蛋白應用于緩解慢性肝腦損傷提供理論依據。□

