木犀草素對兔耳增生性瘢痕抑制作用機制的初步研究
李泰平 肖紅
[摘要]目的:初步研究木犀草素對兔耳增生性瘢痕的抑制作用及可能機制。方法:9只新西蘭兔隨機分為空白組、生理鹽水對照組和藥物干預組,每組3只,生理鹽水對照組和藥物干預組建立兔耳增生性瘢痕模型,每只兔左右耳各3個直徑約0.7cm瘢痕創面,相距約1cm。生理鹽水對照組給予生理鹽水,藥物干預組給予木犀草素乳膏,瘢痕組織于給藥前和給藥后40d取材,Masson染色后顯微鏡下觀察各組瘢痕組織的病理變化,ELISA法檢測瘢痕組織中轉化生長因子-β(TGF-β)、血小板衍化生長因子(PDGF-BB)、結締組織生長因子(CTGF)的含量,qRT-PCR和Western Blot法檢測TGF-β、Ⅰ型膠原蛋白(Collagen Ⅰ)和基質金屬蛋白酶-2(MMP-2)的表達水平。結果:Masson染色顯示木犀草素干預后瘢痕組織中膠原沉積減少,膠原纖維致密且排列規則。與生理鹽水對照組相比,藥物干預組瘢痕組織中TGF-β、PDGF-BB、CTGF的表達明顯減少,差異有統計學意義(P<0.05)。此外,qRT-PCR和Western Blot結果顯示,與生理鹽水對照組相比,藥物干預組MMP-2表達升高,而Collagen Ⅰ表達水平明顯降低,差異有統計學意義(P<0.05)。結論:木犀草素能夠抑制兔耳增生性瘢痕的形成,其作用機制可能與抑制TGF-β、PDGF-BB、CTGF的分泌、上調MMP-2、減少Collagen Ⅰ的表達有關。
[關鍵詞]木犀草素;增生性瘢痕;兔耳模型;機制研究
[中圖分類號]R619+.6? ? [文獻標志碼]A? ? [文章編號]1008-6455(2021)08-0091-04
Preliminary Study on the Inhibitory Mechanism of Luteolin on Hypertrophic Scar in Rabbit Ear
LI Tai-ping,XIAO Hong
(Neuro-Psychiatric Institute,Affiliated Brain Hospital,Nanjing Medical University,Nanjing 210029,Jiangsu,China)
Abstract: Objective? To reveal the inhibitory effect of luteolin and its mechanism on hypertrophic scar formation in rabbit ears. Methods? 9 New Zealand rabbits were randomly divided into 3 groups: the blank group, the normal saline control group and the drug intervention group, with 3 rabbits in each group. Hypertrophic scar model was established in rabbit ears in the normal saline control group and the drug intervention group. Before and forty days after treatment, the pathological changes of the scar tissues were examined, and the collagen fibers hyperplasia were observed with Masson staining. The expression levels of TGF-β, PDGF-BB, CTGF were quantified by ELISA. In addition, TGF-β, Collagen Ⅰand MMP-2 were separately detected by quantitative real-time PCR (qRT-PCR) assay and Western Blot. Results? Masson staining showed that collagen deposition was significantly reduced after luteolin treatment, collagen fibers were also dense and arranged regularly. ELISA results indicated that the expression levels of TGF-β, PDGF-BB and CTGF were obviously reduced in the drug intervention group compared to the the normal saline control group, the differences were statistically significant (P<0.05). In addition, the results of qRT-PCR and Western blot showed that compared with the normal saline control group, the expression of MMP-2 in the drug intervention group increased, while the expression level of Collagen Ⅰ decreased significantly (P<0.05). Conclusion? Luteolin could inhibit the formation of hypertrophic scar in rabbit ears, and its mechanism may be related to the inhibition of TGF-β、the secretion of PDGF-BB and CTGF was related to the up regulation of MMP-2 and the decrease of collagen Ⅰ expression in vivo.
Key words: luteolin; hypertrophic scar; rabbit ear model; mechanism research
增生性瘢痕是創傷后愈合過程中,組織過度修復而導致的病理產物,其發生機制至今尚未完全明確。最新研究已表明成纖維細胞(Fibroblast,FB)凋亡的減少和過度增殖在增生性瘢痕形成進程中起到非常重要的作用[1]。目前臨床治療主要采用整形外科手術、加壓、瘢痕內激素注射、冷凍、激光和應用硅制劑等療法,但效果均不太理想[2-3]。因此,抑制和治療增生性瘢痕的研究很有臨床意義。筆者前期研究發現加味小陷胸中藥配方顆粒能夠抑制兔耳增生性瘢痕的形成[4],該湯劑配方中的主要活性成分之一木犀草素是一種黃酮類中藥單體,存在于多種蔬菜和藥用植物中,具有多種藥理學作用,包括抗腫瘤、抗氧化、抗炎、保護神經系統等[5]。目前關于木犀草素抑制增生性瘢痕的研究還未見報道,本實驗初步探討了外用木犀草素乳膏對兔耳增生性瘢痕防治作用的機制,為其臨床應用提供理論和實踐依據。
1? 材料和方法
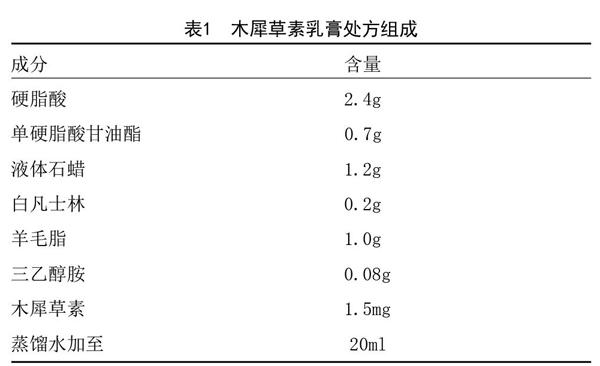
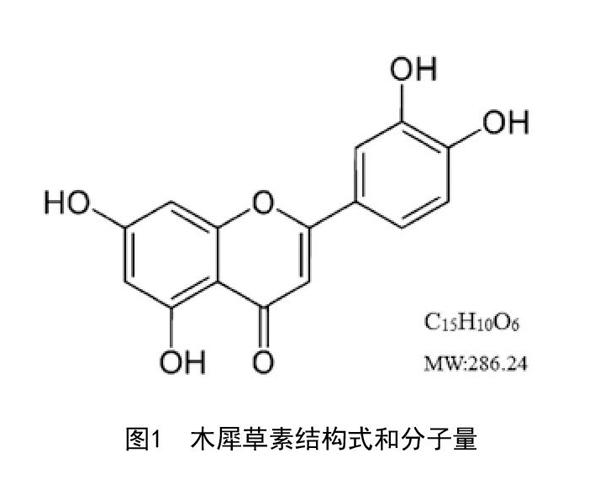
1.1 藥品和試劑:木犀草素乳膏(20ml:1.5mg,批號:20160131,處方組成見表1,木犀草素的結構式和分子量見圖1)由安徽醫科大學湯繼輝教授提供,冷藏保存在避光的容器中。兔子轉化生長因子β(Transforming growth factor-β,TGF-β)酶聯免疫分析試劑盒(批號:0028093)、兔結締組織生長因子(Connective tissue growth factor,CTGF)酶聯免疫分析試劑盒(批號:027940)、兔血小板衍生生長因子BB(Platelet-derived growth factor-BB,PDGF-BB)酶聯免疫分析試劑盒(批號:0023006)均購自南京迅貝生物科技有限公司。TGF-β(批號:21898-1)、Collagen I(批號:14695-1)、MMP-2(批號:10373-2)多克隆抗體均購自于美國Proteintech公司。QuantiFast SYBR? Green PCR Kit試劑盒(包含HotStart DNA Polymerase、SYBR Green I、dNTPs、Mg2+以及優化的緩沖體系,批號:204057)均購自德國Qiagen公司。
1.2 主要實驗儀器:光學顯微鏡(日本Olympus公司),超純水儀(美國Millpore公司),超低溫冰箱(日本Sanyo公司),多功能酶標儀(美國Bio-Tek公司),電泳槽(美國Bio-Rad公司),核酸蛋白分析儀(美國Beckman公司),qRT-PCR儀(美國Bio-Rad公司),凝膠成像分析系統(美國Bio-Rad公司),以及手術器械、兔專用固定箱和動物實驗操作臺。
1.3 實驗動物:新西蘭大耳朵白兔,清潔級,兔齡3~4個月,雌雄不限,共9只,體重(2.5±0.2)kg,購自南京市江寧區青龍山動物中心,許可證號:SCXK(蘇)2012-0008,動物合格證號:NO.201603875。所有兔均混合分籠人工飼養,環境溫度為20℃~22℃、相對濕度約為50%,人工混合飼料飼養1周后進行實驗。本實驗按南京醫科大學動物實驗倫理要求操作,批準編號:IACUC-1601056。
1.4 實驗方法
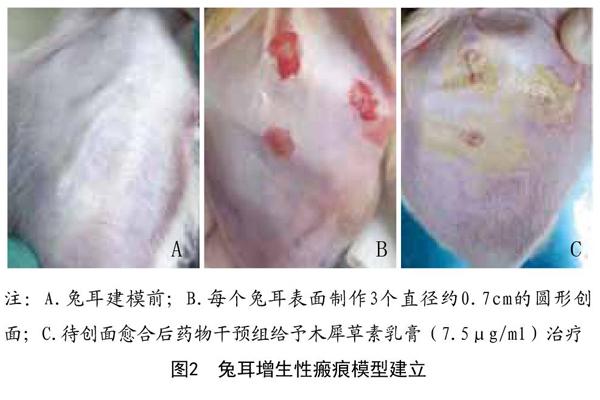
1.4.1 兔耳腹創面造模:將兔固定于專用固定箱,戊巴比妥耳緣靜脈麻醉后,在兔耳腹側沿長軸避開血管,制作直徑為0.7cm圓形創面,完整切除全層皮膚,徹底刮除軟骨膜,保留軟骨,創面不予任何處理,任其自然愈合(見圖2B)。每只兔左右耳腹側各制備3個創面,各創面間距約為1.0cm。術后自由進食、飲水,1周內注意觀察防止結痂造成兔子撕咬感染。若術后發現創面感染,局部及時給予碘伏消毒。待創面結痂后,碘酊消毒后將痂皮揭除,創面自然愈合,所有兔耳患區上皮化完成后兔耳增生性瘢痕模型建立。
1.4.2 分組與給藥:配制的木犀草素乳膏濃度為75μg/ml,張麗宏等[6]研究發現木犀草素在濃度20μM時對UVB照射成纖維細胞Ⅰ型膠原表達的逆轉作用最強,等量換算濃度約為5.7μg/ml。周宵楠等[7]應用木犀草素體外抗炎結果顯示木犀草素的藥物安全范圍為≤8μg/ml,因此本實驗用藥濃度設為7.5μg/ml,給藥量約0.2ml。
3只兔為空白組(不做任何處理),6只兔創面完全上皮化后隨機分為生理鹽水對照組和藥物干預組(給予木犀草素乳膏7.5μg/ml外涂約0.2ml治療,每個創面約1.5μg木犀草素的用藥量,一天兩次,見圖2C),每組3只兔、6只耳朵、18個創面。于術后第32天開始給藥,共給藥40d,分別在給藥前和給藥后40d取樣本組織,觀察各組瘢痕組織的外觀形態變化,切取各組瘢痕組織,將所取組織從頂部均分為兩份,一半作Masson染色,另一半作分子生物學檢測。
1.4.3 ELISA實驗:按照ELISA試劑盒說明書要求檢測兔耳組織中TGF-β、PDGF-BB、CTGF的含量。每50mg瘢痕組織中加入1ml PBS(pH=7.4),勻漿后4℃離心(12 000r/min)10min后收集上清液。取上清液與相應的免疫試劑孵育30min,洗滌孔5次。最后將底物溶液孵育30min,在450nm波長下測定其吸光度。
1.4.4 Western Blot實驗:兔耳瘢痕組織生理鹽水洗凈后粉碎成粉末。應用radioimmunoprecipitation assay(RIPA)裂解緩沖液提取蛋白后,加入phenylmethylsulfonyl fluoride (PMSF),0℃下孵育30min,然后離心(12 000r/min,4℃,20min),收集上層清液。蛋白電泳使用十二烷基硫酸鈉-聚丙烯酰胺凝膠進行,用5%脫脂牛奶稀釋兔抗體溶液后置搖床搖1h。加入一抗(anti-TGF-β,anti-Collagen Ⅰ,anti-MMP-2,anti-β-actin)4℃孵育過夜。取出PVDF膜Tris Buffered saline Tween (TBST)洗凈后加入用5%脫脂牛奶稀釋后的二抗溶液,孵育1h,用TBST洗滌3次后使用ECL混合溶液曝光,Molecular Imager Gel DocXR成像。
1.4.5 qRT-PCR實驗:應用實時熒光定量PCR檢測TGF-β、Collagen Ⅰ和MMP-2表達。按照試劑說明書提取各組細胞總RNA。引物設計原始序列來自Primer Bank (https://pga.mgh.harvard.edu/primerbank/index.html),序列為:TGF-β:正向引物5'-CTCCCGTGGCTTCTAGTGC-3',反向引物5'-GCCTTAGTTTGGACAGGATCTG-3';Collagen Ⅰ:正向引物5'-GCTCCTCTTAGGGGCCACT-3',反向引物5'-CCACGTCTCACCATTGGGG-3';MMP-2:正向引物5'-TGTGTCTTCCCCTTCACTTTTC-3',反向引物5'-CATCATCGTAGTTGGTTGTGGT-3';β-actin:正向引物5'-TGACATCAAGAAGGTGGTGA-3',反向引物5'-TCATACCAGGAAATGAGCT-3',均由武漢谷歌生物科技有限公司提供。采用β-actin作為內參,根據每個樣本擴增曲線的Ct值進行相對定量,對照組設為1,n為擴增反應的循環次數,△Ctn=Ct目的基因(n)-Ct內參基因(n),△△CTn=△Ctn-△Ct1,采用2-△△CT方法對數據進行分析[8-9]。
1.5 統計學分析:使用SAS軟件(9.0版)進行統計分析。計量資料以x?±s表示,組間差異比較采用t檢驗。P<0.05為差異具有統計學意義;P<0.01為差異極顯著。
2? 結果
2.1 兔耳瘢痕組織外觀:兔耳創面于術后約30d完全愈合并完成上皮化。給藥40d后,生理鹽水對照組瘢痕增厚明顯,相比鄰近皮膚中間突出明顯,顏色也呈暗紅色;藥物干預組瘢痕增厚不明顯,質軟平滑,顏色與鄰近皮膚也較接近。見圖3。
2.2 Masson染色結果:通過組織切片Masson染色觀察,與生理鹽水對照組相比,藥物干預組的膠原纖維致密,排列規則。與空白組相比,生理鹽水對照組和藥物干預組微血管數目均明顯減少。見圖4。
2.3 ELISA、qRT-PCR和Western Blot檢測結果:ELISA結果顯示,與空白組比較,生理鹽水對照組兔耳瘢痕組織中TGF-β、PDGF-BB、CTGF的含量明顯升高,而藥物干預組瘢痕組織中上述因子的含量顯著降低,見圖5。qRT-PCR和Western Blot檢測結果顯示,與空白組比較,生理鹽水對照組中TGF-β、Collagen Ⅰ的mRNA和蛋白表達顯著升高,MMP-2的mRNA和蛋白的表達明顯降低;與生理鹽水對照組相比,藥物干預組TGF-β、Collagen Ⅰ的mRNA和蛋白表達顯著降低,而MMP-2的mRNA和蛋白表達明顯升高。因此,木犀草素能夠促進MMP-2的表達,而抑制瘢痕組織中TGF-β、Collagen Ⅰ的表達。見圖6~7。
3? 討論
皮膚組織損傷后在愈合過程中由于過度修復造成的增生性瘢痕始終是臨床上一大難題。傷口愈合是一個復雜的過程,涉及炎癥反應、細胞增殖、基質沉積和組織重塑等,其中TGF-β、PDGF-BB、CTGF等細胞因子在瘢痕形成過程中發揮著非常重要的作用[10]。本研究發現兔耳瘢痕組織中TGF-β、PDGF-BB和CTGF含量明顯升高,證實增生性瘢痕的形成與上述三種生長因子密切相關,也與相關研究結論一致[11-13]。傷口愈合時組織軟化過程中膠原降解與MMP-2等密切相關,MMP-2活性的增加可導致Ⅰ型膠原蛋白的減少[14-15]。TGF-β還可通過上調MMP-2、TIMP-1和TIMP-2等路徑影響纖維化進程,進而進一步分解Ⅰ型膠原[16]。既往研究表明,5,7,3',4'羥基取代的黃酮類化合物包括木犀草素、槲皮素、楊梅素等,可明顯降低膠原蛋白的表達,還可通過與激活素受體樣激酶5(ALK5)結合,選擇性地下調TGF-β/Smads信號通路中Smad2/3的磷酸化水平并降低ALK5催化活性,進而抑制成纖維細胞的增殖[17]。在本研究中,木犀草素是否通過MMPs/Collagen和(或)TGF-β/Smads信號通路發揮抑制瘢痕形成還需實驗進一步證實。
總之,木犀草素是一種很有前途的抗瘢痕藥,發現能顯著抑制兔耳增生性瘢痕組織中TGF-β、PDGF-BB和CTGF的分泌,可上調MMP-2、降低I型膠原的表達,其調控的具體機制還需進一步研究。
[參考文獻]
[1]Xiao YQ,Xu DY,Song HY,et al.Cuprous oxide nanoparticles reduces hypertrophic scarring by inducing fibroblast apoptosis[J].Int J Nanomedicine,2019,14:5989-6000.
[2]Zhang H,Wang HY,Wang DL,et al.Effect of pressure therapy for treatment of hypertrophic scar[J].Medicine,2019,98(26):e16263.
[3]Lin SQ,Quan GL,Hou AL,et al.Strategy for hypertrophic scar therapy: Improved delivery of triamcinolone acetonide using mechanically robust tip-concentrated dissolving microneedle array[J].J Control Release,2019,306:69-82.
[4]陳玲,李泰平,連娜琦,等.加味小陷胸中藥配方顆粒對兔耳增生性瘢痕的抑制作用及其機制研究[J].中國現代應用藥學,2019,36(3):307-311.
[5]孫燕,連娜琦,李泰平.抗病理性瘢痕中藥單體的應用研究進展[J].中國美容醫學,2017,26(6):133-136.
[6]張麗宏,張寧,劉國良,等.金銀花有效成分木犀草素對UVB輻射致皮膚光老化保護作用研究[J].中醫藥學報,2016,44(3):27-29.
[7]周霄楠,韓超,宋鵬琰,等.木犀草素和槲皮素體外抗炎作用研究[J].動物醫學進展,2017,38(10):56-61.
[8]Morer A,Chae W,Henegariu O,et al.Elevated expression of MCP-1, IL-2 and PTPR-N in basal ganglia of Tourette syndrome cases[J].Brain Behav Immun,2010,24(7):1069-1073.
[9]Wohlfahrtova M,Tycova I,Honsova E,et al.Molecular patterns of subclinical and clinical rejection of kidney allograft: quantity matters[J].Kidney Blood Press Res,2015,40(3):244-257.
[10]Lian NQ,Li TP.Growth factor pathways in hypertrophic scars: Molecular pathogenesis and therapeutic implications[J].Biomed Pharmacother,2016,84:42-50.
[11]Jensen J,Gentzkow G,Berman G,et al.Anti-CTGF oligonucleotide reduces severity of postsurgical hypertrophic scars in a randomized, double-blind, within-subject, placebo-controlled study[J].Plast Reconstr Surg,2018,142:192e-201e.
[12]Sun GF,Li HC,Zhan YP,et al.SnoN residue (1-366) attenuates hypertrophic scars through resistance to transforming growth factor-β1-induced degradation[J].Lab Invest,2019,99:1861-1873.
[13]Feng Y,Wu JJ,Sun ZL,et al.Targeted apoptosis of myofibroblasts by elesclomol inhibits hypertrophic scar formation[J].EBioMedicine,2020,54:102715.
[14]Kanno E,Tanno H,Masaki A,et al.Defect of interferon γ leads to impaired wound healing through prolonged neutrophilic inflammatory response and enhanced MMP-2 activation[J].Int J Mol Sci,2019,20(22):5657.
[15]Silva-Bertani DCTD,Vileigas DF,Mota GAF,et al.Decreased collagen type Ⅰ is associated with increased Metalloproteinase-2 activity and protein expression of leptin in the myocardium of obese rats[J].Arq Bras Cardiol,2020,115(1):61-67.
[16]Phaosri M,Jantrapirom S,Takuathung MN,et al.Stem Extract exerts antifibrotic effects on human hepatic stellate cells through the inhibition of the TGF-β1-induced SMAD2/3 signaling pathway[J].Int J Mol Sci,2019,20(24):6314.
[17]Zhang YF,Wang J,Zhou SZ,et al.Flavones hydroxylated at 5, 7, 3' and 4' ameliorate skin fibrosis via inhibiting activin receptor-like kinase 5 kinase activity[J].Cell Death Dis,2019,10(2):124-128.
[收稿日期]2020-11-12
本文引用格式:李泰平,肖紅.木犀草素對兔耳增生性瘢痕抑制作用機制的初步研究[J].中國美容醫學,2021,30(8):91-94.

