基于氧感知通路探討早發(fā)性卵巢功能不全發(fā)生機(jī)制的研究進(jìn)展
朱軼軒 董曉英
1.首都醫(yī)科大學(xué)口腔醫(yī)學(xué)院,北京 100069;2.首都醫(yī)科大學(xué)中醫(yī)藥學(xué)院,北京 100069
早發(fā)性卵巢功能不全(premature ovarian insufficiency,POI)的發(fā)病機(jī)制復(fù)雜,是醫(yī)學(xué)界持續(xù)探索的重點(diǎn)領(lǐng)域之一。近年來(lái),隨著有關(guān)領(lǐng)域研究的開展,學(xué)者對(duì)POI 有了更加全面、客觀的認(rèn)識(shí)。William G.Kaelin,Peter J.Ratcliffe 和Gregg L.Semenza 教授因其在理解細(xì)胞感知和適應(yīng)氧氣變化機(jī)制中的貢獻(xiàn)而被授予2019 年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng),他們從分子水平上探索了人體細(xì)胞感受氧濃度的基本原理,與之相關(guān)的信號(hào)通路被統(tǒng)稱為氧感知通路。氧感知通路中的元件對(duì)POI 的發(fā)生有著重要影響。本文旨在通過(guò)探討POI 與氧感知通路的聯(lián)系,為POI 發(fā)生機(jī)制的研究及治療提供新思路。
1 POI 及其發(fā)生機(jī)制簡(jiǎn)述
POI 是指女性在40 歲之前由于卵巢功能減退引發(fā)的一系列異常表現(xiàn)的臨床綜合征[1]。其通常特征為低雌激素水平導(dǎo)致的月經(jīng)異常(閉經(jīng)或月經(jīng)稀發(fā))[2],并伴有高水平的卵泡刺激素(>25 U/L)(follicle-stimulating hormone,F(xiàn)SH)、促黃體生成素(luteinizing hormone,LH)和低水平的雌二醇(estradiol,E2)[3]。POI 發(fā)病機(jī)制的復(fù)雜性以及它帶來(lái)的生育率下降等問題使其治療成為當(dāng)代醫(yī)學(xué)的一大挑戰(zhàn)[4]。
顆粒細(xì)胞凋亡是POI 的重要發(fā)病原因。卵泡是卵巢的基本結(jié)構(gòu)和功能單位,在卵泡發(fā)育成熟過(guò)程中,顆粒細(xì)胞的增殖、分化對(duì)卵母細(xì)胞的發(fā)育成熟有著重要的作用。顆粒細(xì)胞與卵母細(xì)胞之間存在著大量縫隙連接,并通過(guò)縫隙連接輸送營(yíng)養(yǎng)物質(zhì)和信號(hào)分子進(jìn)入卵母細(xì)胞,以促進(jìn)卵母細(xì)胞胞核與胞質(zhì)成熟。顆粒細(xì)胞的凋亡可抑制卵母細(xì)胞及卵泡的發(fā)育,促進(jìn)卵泡閉鎖引發(fā)POI[5]。
2 氧感知通路與POI
2.1 氧感知通路概述
氧感知通路的核心是細(xì)胞如何在低氧環(huán)境下通過(guò)調(diào)節(jié)一系列信號(hào)通路以避免缺氧損傷,維持細(xì)胞內(nèi)環(huán)境穩(wěn)定[6]。
Wang 等[7]首先從慢性缺氧細(xì)胞中分離得到一種在常氧下降解而在缺氧條件下穩(wěn)定的DNA 結(jié)合蛋白,并將之命名為低氧誘導(dǎo)因子1(hypoxia-inducible factor 1,HIF-1)。隨后HIF-1 被發(fā)現(xiàn)由HIF-1α 和HIF-1β 兩個(gè)亞單位組成[8]。Ivan 等[9]發(fā)現(xiàn)常氧狀態(tài)下HIF-1α 在脯氨酰羥化酶(prolyl hydroxylase,PHD)作用下發(fā)生羥基化。羥基化的HIF-1α 立即與腫瘤抑制基因結(jié)合,并通過(guò)泛素-蛋白酶途徑降解,阻斷缺氧相關(guān)基因的表達(dá)。而在缺氧條件下,PHD 羥基化抑制HIF 的降解。HIF-1α 在細(xì)胞質(zhì)中積累,轉(zhuǎn)移到細(xì)胞核中與HIF-1β 聚合形成異源二聚體,再與下游的缺氧反應(yīng)元件(hypoxia response element,HRE)結(jié)合,促進(jìn)相關(guān)基因的轉(zhuǎn)錄,并使促紅細(xì)胞生成素和血管內(nèi)皮生長(zhǎng)因子的表達(dá)增加,見圖1。
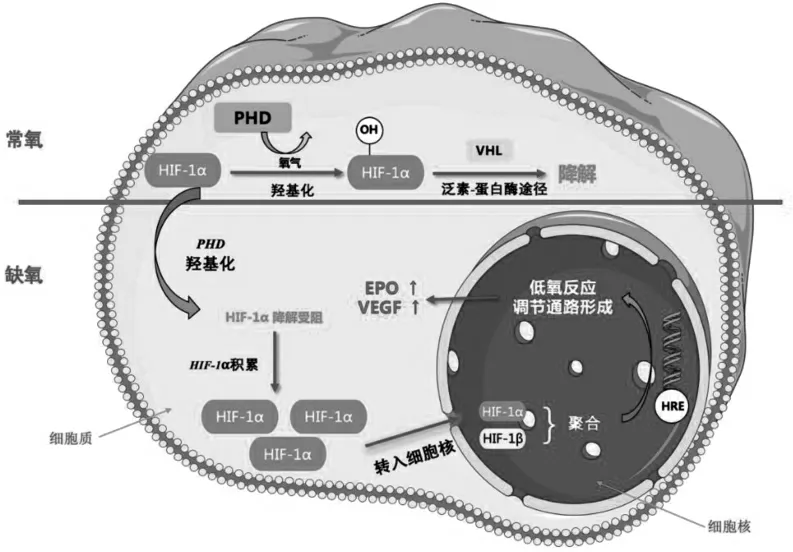
圖1 氧感知通路示意圖
哺乳動(dòng)物的卵巢是一種代謝活躍的器官,會(huì)產(chǎn)生大量的活性氧。由于卵泡較大,卵泡卵母細(xì)胞更容易缺氧[10]。因此,氧感知通路在卵泡的生理過(guò)程中起著重要的調(diào)控作用。其中,HIF-1α 作為氧感知通路的核心元件,與調(diào)節(jié)卵巢功能相關(guān)的信號(hào)通路息息相關(guān),對(duì)POI的發(fā)生也有一定的影響。
2.2 HIF-1α 誘導(dǎo)顆粒細(xì)胞凋亡引發(fā)的POI
細(xì)胞凋亡,又稱Ⅰ型細(xì)胞程序化死亡,是由活化半胱天冬酶(Caspase)所執(zhí)行的細(xì)胞行為[11]。細(xì)胞凋亡有利于維持細(xì)胞數(shù)量的動(dòng)態(tài)平衡,然而,凋亡過(guò)度或不足會(huì)引起許多疾病[12]。
HIF-1α 可通過(guò)BNIP3 介導(dǎo)的一系列信號(hào)通路引發(fā)顆粒細(xì)胞的凋亡。
BNIP3 是一種屬于Bcl-2 家族的促凋亡蛋白[13]。低氧狀態(tài)下細(xì)胞內(nèi)過(guò)表達(dá)的HIF-1α 可以上調(diào)BNIP3的表達(dá)[14]。BNIP3 具有低氧應(yīng)答能力,且受HIF-1 的直接調(diào)控,其啟動(dòng)子區(qū)含有一個(gè)缺氧反應(yīng)元件,在低氧條件下可與HIF-1 緊密結(jié)合。在卵巢中,卵泡顆粒細(xì)胞和卵泡液的激增會(huì)使得卵泡腔內(nèi)血管分布密度減小,相應(yīng)地,單位顆粒細(xì)胞的血供和氧水平降低,可能導(dǎo)致顆粒細(xì)胞缺氧[15]。低氧環(huán)境下,胞漿內(nèi)HIF-1α積聚增多,引起卵泡顆粒細(xì)胞內(nèi)HIF-1α 過(guò)表達(dá),HIF-1α 與BNIP3 啟動(dòng)子區(qū)的缺氧反應(yīng)元件結(jié)合,上調(diào)BNIP3 的表達(dá)。Bcl-2 家族成員可與BNIP3 的C 末端結(jié)構(gòu)域相互作用形成異二聚體,從而抑制Bcl-2 的抗凋亡作用[16]。因此,卵巢內(nèi)的低氧環(huán)境可能引發(fā)BNIP3 介導(dǎo)的顆粒細(xì)胞凋亡。顆粒細(xì)胞的凋亡是促進(jìn)卵泡閉鎖的關(guān)鍵性因素[17]。因此,BNIP3 介導(dǎo)的大量顆粒細(xì)胞凋亡可能導(dǎo)致卵泡閉鎖,從而誘發(fā)POI。
2.3 HIF-1α 誘導(dǎo)顆粒細(xì)胞自噬引發(fā)的POI
自噬,又稱為Ⅱ型細(xì)胞程序化死亡,是一種高度自我調(diào)節(jié)的過(guò)程,可以通過(guò)溶酶體活性消除受損、有害或多余的亞細(xì)胞蛋白質(zhì)和細(xì)胞器[18]。正常水平的自噬可以減輕各種類型細(xì)胞應(yīng)激帶來(lái)的損害,利于細(xì)胞生存[19]。然而,當(dāng)細(xì)胞自噬過(guò)分激活時(shí)可能引起疾病[20]。
顆粒細(xì)胞自噬的機(jī)制可能與PI3K/Akt/mTOR 通路以及氧感知通路有關(guān)。其中,mTOR 是該通路的重要下游調(diào)節(jié)元件,其很多區(qū)域可以參與蛋白質(zhì)之間的交互作用,是生長(zhǎng)因子、營(yíng)養(yǎng)狀況、能量狀態(tài)的中樞傳感器[21]。
FSH 可以激活PI3K,引起cAMP 途徑介導(dǎo)的mTOR活化,并通過(guò)PI3K/Akt/mTOR 通路增加顆粒細(xì)胞中下游HIF-1α 活性[22]。mTOR 存在mTORC1 和mTORC2兩種不同形式的復(fù)合物。自噬主要受mTORC1 調(diào)控。活化的mTORC1 可以使延伸起始因子4E 結(jié)合蛋白1(4E-birding protein 1,4E-BP1)和核糖體蛋白S6 激酶1 磷酸化,并分別與真核翻譯起始因子-4E(eukaryotic initiation factor 4E,eIF-4E)和eIF-3 結(jié)合,在結(jié)合狀態(tài)下抑制翻譯起始復(fù)合物的形成。當(dāng)mTOR 磷酸化4E-BP1 后,4E-BP1 被激活,并與eIF-4E 分離,解除對(duì)依賴于eIF-4E 的翻譯過(guò)程的抑制作用[23]。mTOR 能磷酸化p70S6K,從而刺激p70S6K 核糖體蛋白和其他翻譯機(jī)制的組成部分,包括eIF4B 和eEF2K[24],還可能通過(guò)5’末端寡聚嘧啶核苷酸序列來(lái)增加mRNA的翻譯速率從而促進(jìn)HIF-1α 表達(dá)[25]。在卵巢中,促性腺激素會(huì)促進(jìn)過(guò)度的顆粒細(xì)胞增殖,引起缺氧和HIF-1α 的積累[26]。
上述通路導(dǎo)致的HIF-1α 過(guò)表達(dá)會(huì)強(qiáng)化細(xì)胞自噬。HIF-1α 的積累被證明可以誘導(dǎo)BNIP3 表達(dá)上調(diào),除了促進(jìn)細(xì)胞凋亡,BNIP3 還能調(diào)控自噬相關(guān)基因的表達(dá),包括Beclin1 和Atg5[27]。研究發(fā)現(xiàn),Bcl-2 家族抗凋亡蛋白Bcl 2、Bcl-XL 等可通過(guò)與Beclin 1 相互作用負(fù)性調(diào)控自噬,BNIP3 的BH3 結(jié)構(gòu)域會(huì)取代Bcl-2-或Bcl-XL-Beclin1 復(fù)合物中的Beclin1,引起B(yǎng)cl-2/Beclin1 或Bcl-XL/Beclin1 復(fù)合物的解離,導(dǎo)致能夠觸發(fā)自噬的Beclin1 釋放[28]。自噬體的積累會(huì)降低顆粒細(xì)胞內(nèi)Bcl-2 的表達(dá)水平[29],進(jìn)一步加劇BNIP3 對(duì)抗凋亡蛋白功能的抑制作用。
2.4 細(xì)胞自噬與凋亡交聯(lián)共同影響POI
細(xì)胞自噬和細(xì)胞凋亡是兩個(gè)相互分離又相互聯(lián)系的過(guò)程,其交聯(lián)機(jī)制見圖2。BNIP3 是缺氧誘導(dǎo)的關(guān)鍵分子,并參與自噬轉(zhuǎn)換,使細(xì)胞得以存活并避免凋亡[29]。正常水平的自噬對(duì)顆粒細(xì)胞增殖和卵泡發(fā)育起到保護(hù)作用。然而,過(guò)度的細(xì)胞自噬可以通過(guò)改變細(xì)胞中Bax 與Bcl-2 表達(dá)的比例引起細(xì)胞凋亡,過(guò)表達(dá)的Bax 可以加速細(xì)胞凋亡性死亡,也能抑制Bcl-2的死亡抑制因子活性[28]。實(shí)驗(yàn)顯示,自噬體的積累可以在Bax 表達(dá)水平幾乎沒有變化的情況下,減少顆粒細(xì)胞Bcl-2 的表達(dá),使得Bax 相對(duì)過(guò)表達(dá)而促進(jìn)顆粒細(xì)胞死亡和凋亡[30]。

圖2 缺氧誘導(dǎo)因子-1 細(xì)胞對(duì)細(xì)胞凋亡和自噬的調(diào)控示意圖
在卵巢中,活化的PI3K/Akt/mTOR 通路可以增強(qiáng)HIF-1α 轉(zhuǎn)錄活性,引起HIF-1α 過(guò)表達(dá)。過(guò)表達(dá)的HIF-1α 可以通過(guò)上調(diào)BNIP3 水平,一方面直接促進(jìn)顆粒細(xì)胞凋亡,另一方面經(jīng)上述信號(hào)通路強(qiáng)化細(xì)胞自噬。細(xì)胞自噬過(guò)程中自噬體的積累又能通過(guò)改變Bax與Bcl-2 表達(dá)的比例加速顆粒細(xì)胞的凋亡與死亡。無(wú)論是顆粒細(xì)胞的過(guò)度自噬、直接凋亡還是自噬引發(fā)的凋亡和死亡均會(huì)抑制卵母細(xì)胞及卵泡的發(fā)育,促進(jìn)卵泡閉鎖,引發(fā)POI。
3 討論
氧感知通路是人體最重要的信號(hào)通路之一,越來(lái)越多的醫(yī)學(xué)研究發(fā)現(xiàn)氧感知通路與許多難以治療的疾病有著密切聯(lián)系。在卵巢內(nèi),HIF-1α 可以通過(guò)誘導(dǎo)促凋亡蛋白、調(diào)節(jié)信號(hào)通路等途徑促進(jìn)顆粒細(xì)胞自噬和凋亡引發(fā)POI。迄今為止,基于氧感知通路探討POI發(fā)病機(jī)制的研究仍缺少相關(guān)動(dòng)物模型和臨床試驗(yàn)的支持。目前也少有以氧感知通路為靶點(diǎn)的POI 治療方案。在未來(lái)的研究中,除了完善相關(guān)實(shí)驗(yàn)外,還可以試著從氧感知通路與顆粒細(xì)胞相關(guān)通路的交聯(lián)信號(hào)入手,通過(guò)更多方面的實(shí)驗(yàn)探索針對(duì)氧感知通路異常引發(fā)的POI 治療方案,填補(bǔ)POI 治療領(lǐng)域的相關(guān)空白。
 中國(guó)醫(yī)藥導(dǎo)報(bào)2021年22期
中國(guó)醫(yī)藥導(dǎo)報(bào)2021年22期
- 中國(guó)醫(yī)藥導(dǎo)報(bào)的其它文章
- 我院頭孢菌素皮試情況及經(jīng)濟(jì)學(xué)分析
- 基于WCPT 指南要求設(shè)計(jì)的帶教模式在康復(fù)專業(yè)脊髓損傷臨床教學(xué)中的實(shí)踐研究
- miR-9-5p 通過(guò)靶向UBE4B 調(diào)節(jié)缺氧誘導(dǎo)轉(zhuǎn)錄因子1α 泛素化介導(dǎo)瓦博格效應(yīng)在膠質(zhì)瘤細(xì)胞中的應(yīng)用
- 基于網(wǎng)絡(luò)藥理學(xué)的宮外孕Ⅰ號(hào)方治療異位妊娠的作用機(jī)制研究
- 基于全媒體理念的多元化健康教育對(duì)心外科手術(shù)患者呼吸功能訓(xùn)練效果的影響
- 基于人文關(guān)懷理念的舒適護(hù)理在麻醉恢復(fù)室留觀患者中的應(yīng)用
