馬藍染色體制片技術優化
趙云青 黃穎楨 劉保財 陳菁瑛 張武君 俞靜

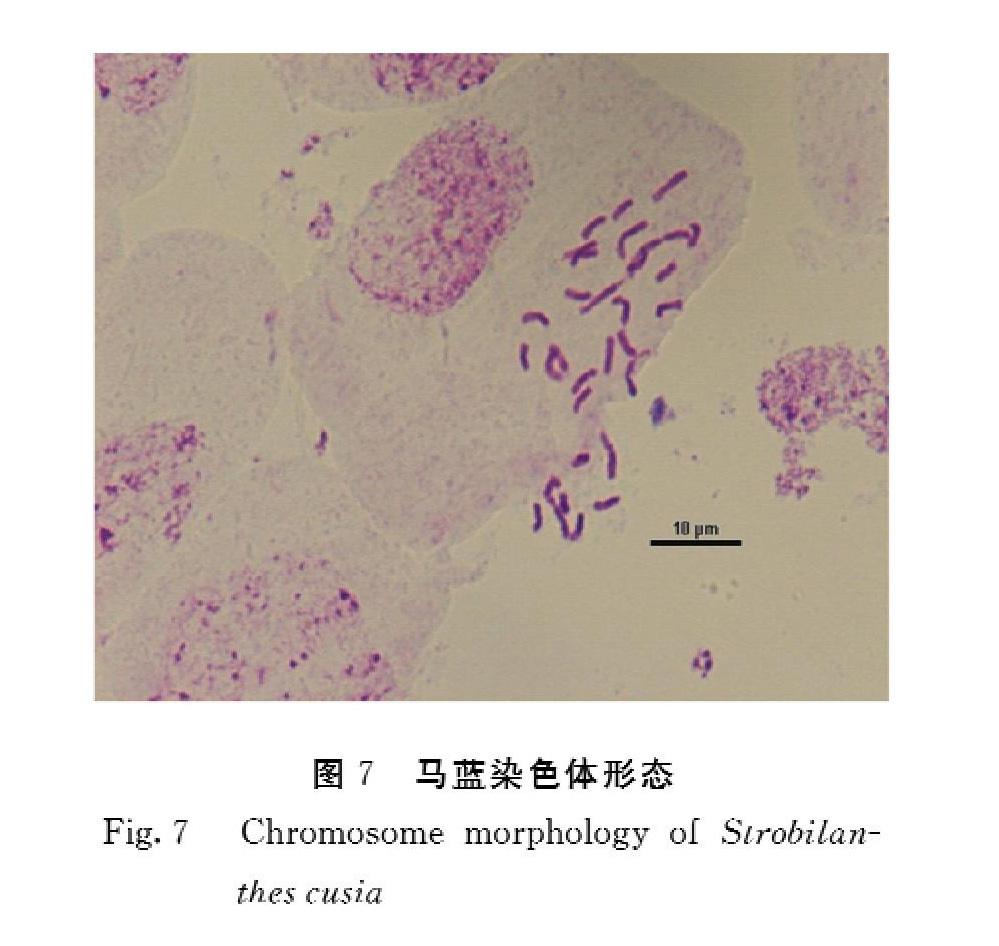
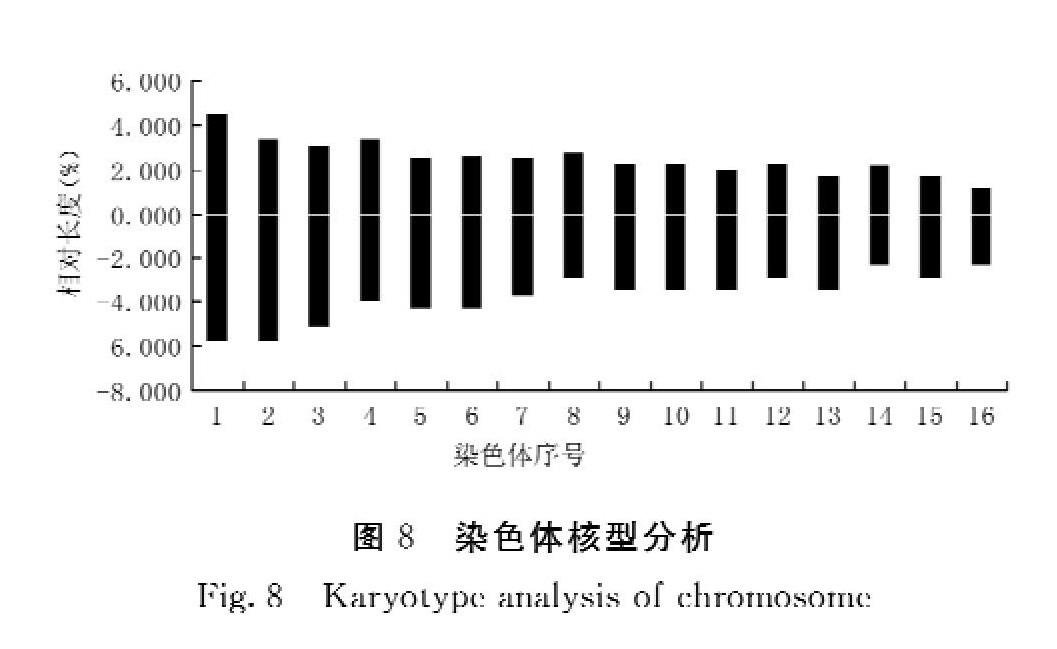
摘 要:以莆田地區馬藍分生組織為材料,采用壓片技術,探討馬藍不同取材部位、不同取材時間、不同預處理試劑處理、不同解離時間等對馬藍染色體制片的影響,并進行核型分析。結果表明:以根尖分生組織為材料,在上午8:00、8:30取材,用0.1%秋水仙素溶液室溫預處理0.5 h,用卡諾液固定4 h,然后用1 mol·L-1鹽酸在60℃水浴8 min,卡寶品紅染色8 min,可獲得分散良好,形態清晰的染色體。核型分析表明,馬藍染色體為32條,馬藍的核型公式是2x=2n=32=4sm+28m,核型類型為1 B,不對稱系數為59.54%。說明莆田地區馬藍在相對穩定的自然環境中進化速度緩慢。
關鍵詞:馬藍;常規制片;染色體;核型分析
中圖分類號:S 567.239? 文獻標志碼:A? 文章編號:0253-2301(2021)07-0001-09
DOI: 10.13651/j.cnki.fjnykj.2021.07.001
Technology Optimization of the Preparation of Chromosomes in ?Strobilanthes Cusia
ZHAO Yunqing1,2, HUANG Yingzhen1,2, LIU Baocai1,2, CHEN Jingying1,2*, ZHANG Wujun1,2, YU Jing1,2
(1. Institute of Agricultural Biological Resources, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China;
2. Medicinal Plant Research Center, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China)
Abstract: By taking the meristem of ?Strobilanthes cusia ?cultivated in Putian as the material and using the conventional method, the effects of different sampling sites, sampling time, pretreatment with different reagents and dissociation time on the preparation of chromosomes in ?Strobilanthes cusia ?were studied, and the karyotype was analyzed. The results showed that: by taking the root apical meristem as the material, the root apical meristem was sampled at 8:00 and 8:30 a.m., pretreated with 0.1% colchicine solution at room temperature for 0.5 h, fixed with Carnoy for 4 h, and then bathed with 1 mol·L-1 hydrochloric acid at 60℃ for 8 min, and stained with carbol fuchsin for 8 min, thus the chromosomes with good dispersion and clear shape could be obtained. The karyotype analysis showed that there were 32 chromosomes in ?Strobilanthes cusia. ?The karyotype formula of ?Strobilanthes cusia ?was 2x=2n=32=4sm+28m, the karyotype was 1 B, and the asymmetry coefficient was 59.54%. It indicated that the evolution rate of ?Strobilanthes cusia ?cultivated in Putian was slow in the relatively stable natural environment.
Key words: ?Strobilanthes cusia ; Conventional preparation; Chromosome; Karyotype analysis
馬藍 Baphicacanthus cusia (Nees)Bremek又稱板藍,為爵床科板藍屬草本植物,主產地為福建、四川、云南、湖南、江西、貴州、廣東、廣西等。馬藍根、莖、葉均可入藥,在我國各個地區廣泛應用。葉或莖葉經加工制得的干燥粉末、團塊稱為青黛,青黛為福建省道地藥材,具有清熱解毒、涼血消斑、清肝瀉火、定驚的功效,主治溫毒發斑、血熱吐衄、咽痛口瘡、火毒瘡瘍、咳嗽胸痛,痰中帶血、暑熱驚癇、驚風抽搐等。馬藍干燥根和根莖稱為南板藍根,具有清熱解毒、涼血消斑的功效,用于溫疫時毒、發熱咽痛、溫毒發斑、丹毒。其干燥莖葉稱為南板藍葉,具有清熱解毒、涼血止血的功效,主治溫熱病、高熱頭痛、發斑、肺熱咳嗽、濕熱瀉痢、黃疸、淋巴結炎、肝癰、腸癰等[1]。
前人在馬藍人工栽培[2-4]、藥用成分、加工炮制[5]等方面進行了較多研究,研究證明馬藍主要含有生物堿、萜類、香豆素酚類、甾類、黃酮類、多炔類、皂苷、木脂素等植物次生代謝產物[6]。馬藍含有的大黃酚具有平喘、止咳、縮短血液凝固時間、興奮神經、麻痹肌肉、利膽、保肝、利尿[7]、抗菌和抗癌的作用,以及免疫抑制、抗炎、降血脂、瀉下[8]及改善糖代謝異常等作用。馬藍研究中發現的生物堿類包括吲哚類生物堿(靛玉紅、靛藍、異靛藍等)、喹唑酮類生物堿和其他類型生物堿等。生物堿藥理活性多樣[9-10],靛玉紅具有抗腫瘤作用[11],是抗白血病的有效成分,對多種動物移植性腫瘤有較強的抑制作用[12],對慢性粒細胞白血病有較好的療效[13]。靛藍可作為著色劑用于染色,還具有抗炎、殺菌作用。國內外學者對靛藍、靛玉紅的物質形成機理等進行了相關研究[14-16]。
近年來馬藍越來越受到關注,馬藍市場需求越來越大,但存在馬藍產量低、野生資源緊缺、栽培馬藍種質退化、成分不穩定等問題。染色體是生物遺傳物質的載體,獲得的染色體數目和核型在物種系統分類、起源與鑒定、親緣關系分析等方面具有重要的應用價值。高質量的染色體制片是進行核型分析和原位雜交的保障[17],染色體核型分析技術可識別各個染色體的特征,有助于基因定位的研究,是細胞遺傳學的一項基本技術,此技術還可用于染色體工程、細胞分類學和植物育種學、基因組研究等[18-19],植物基因組研究可闡述物種分類地位、起源進化,解析次生代謝物的合成通路,解析環境適應性,闡明重要、特殊表型的調控和形成機制,研究結構變異、基因分型等。
染色體制片技術是指顯示染色體的一般形態和結構的技術,染色體制片技術主要有壓片法和去壁低滲干燥法等。壓片法對去壁要求較低且材料不易丟失,該法適用于大量材料的倍性鑒定、染色體計數、初步的染色體形態觀察[20-21]。染色體制片技術成功的關鍵是獲得大量染色體縮短適宜的分裂細胞,壓片法還存在壓片力度較難把握,染色體不易分散等難點。目前,馬藍染色體壓片技術優化僅有吳瑞霞[22]對常規壓片技術中的取材部位、取材時間、預處理液、預處理時間、解離方法進行了優化,并對4個地點的馬藍的核型進行分析。本試驗在此基礎上對馬藍染色體壓片技術進行了取材部位、取樣時間、預處理液、鹽酸解離時間、染色液及染色時間的優化,進一步精細優化了馬藍染色體壓片技術,獲得清晰、分散度良好的染色體制片,并進行了核型分析,為馬藍后續研究提供支持。
1 材料與方法
1.1 試驗材料
供試材料馬藍 Strobilanthes (Nees)Bremek采集自福建莆田仙游,扦插在福建省農業科學院藥用植物資源圃,經本課題組鑒定為爵床科板藍屬植物馬藍 Strobilanthes cusia (Nees)Bremek。
1.2 試驗方法
1.2.1 不同取材部位選擇 取馬藍半木質化枝條采用育苗基質進行扦插,取樣前,將生根的馬藍置適當低溫(4~10℃)暗培養12 h后轉25℃下處理12 h,重復2次,提高細胞分裂指數。于上午8:00分別取馬藍植物根尖、莖尖、嫩葉放入預處理液0.1%秋水仙素中處理0.5 h,取出材料沖洗干凈,置于卡諾氏固定液(乙醇∶冰醋酸=3∶1,V/V)中4℃固定4 h。將固定后的材料投入1 mol·L-1鹽酸溶液中60℃水浴解離8 min[13-15]。解離完后清洗材料3~5次,將材料置于載玻片上,滴清水,用鑷子將材料搗碎后去掉全部大塊組織,在帶有細小組織的清水上直接滴加卡寶品紅溶液[16]染色8 min。蓋上蓋玻片,濾紙從蓋玻片兩側吸掉過剩的卡寶品紅溶液后,手指在濾紙外固定住蓋玻片,用鉛筆橡皮頭的先沿著蓋玻片對角線敲擊,后再細細敲擊整個蓋玻片(1~2 min),使材料成分散均勻,在顯微鏡下觀察拍照。
1.2.2 不同取樣時間優化 于上午6:00至11:30每隔0.5 h取1次根尖,約2 mm,放入預處理液0.1%秋水仙素中處理0.5 h。預處理完后續操作同1.2.1。
1.2.3 不同預處理液處理 于上午8:00取馬藍植物根尖放入表1預處理液中進行預處理,預處理完后續操作同1.2.1。
1.2.4 解離時間優化 于上午8:00取馬藍植物根尖放入預處理液0.1%秋水仙素中處理0.5 h,取出材料沖洗干凈,置于卡諾氏固定液(乙醇∶冰醋酸=3∶1,V/V)中4℃固定4 h。將固定后的材料投入1 mol·L-1鹽酸溶液中60℃水浴解離4、6、8、10 min[23-25]。解離完后續操作同1.2.1。
1.2.5 染色液及染色時間優化 于上午8:00分別取馬藍植物根尖放入預處理液0.1%秋水仙素中處理0.5 h,取出材料沖洗干凈,置于卡諾氏固定液(乙醇∶冰醋酸=3∶1,V/V)中4℃固定4 h。將固定后的材料投入1 mol·L-1鹽酸溶液中60℃水浴解離8 min[23-25]。解離完后清洗材料3~5次,將材料置于載玻片上,滴清水,用鑷子將材料搗碎后去掉全部大塊組織,在帶有細小組織的清水上滴加醋酸洋紅或卡寶品紅溶液[26]染色6 min,后續操作同1.2.1。選取效果佳的染色液分別染色4、6、8、10 min,后續操作同1.2.1。
1.2.6 馬藍染色體核型分析的方法 用NIKON NiUF2正置顯微鏡觀察,NISElements D版軟件拍照系統拍照,在顯微鏡下對處于分裂中期的細胞進行計數。選擇30個染色體分散且形態較好的細胞進行染色體數目統計,其中85%以上細胞具有恒定一致的染色體數,即可認為是該植物的染色體數目[17]。核型分析方法根據李懋學等[17]的標準劃分。
臂比 (r)=長臂(S)/短臂(L); 染色體相對長度=染色體長度/染色體組總度×100%;
按Arano[27]的方法,核型不對稱系數=長臂總長/全組染色體總長×100%,比值越大越不對稱。按Levan等[28]方法根據臂比值確定著絲點的命名。
核型分類:按Stebbins[29]的方法,根據臂比值大于2的染色體百分比和最長染色體與最短染色體之比來判定核型類型。
2 結果與分析
2.1 馬藍染色體制片壓片法技術優化
2.1.1 不同取材部位對馬藍染色體制片效果的影響 于上午8:00取馬藍的根尖、莖尖及嫩葉,從圖1可知,不同取材部位對馬藍染色體制片效果影響較大,3種材料細胞核區最大的為根尖,其次為莖尖及嫩葉。根尖可獲得較多的分裂相,嫩葉及尖分裂相細胞較少,染色質濃縮,未見可用于染色體分析的制片。從細胞形態來看,根尖細胞背景干凈,染色體較分散,利于染色體計數及后期核型分析,可作為最佳染色體核型處理部位。取樣前,將生根的馬藍扦插秒置適當低溫(4~10℃)暗培養12 h后轉25℃下培養12 h,重復2次,此方法可顯著提高細胞分裂指數。
2.1.2 不同取材時間對馬藍染色體制片效果的影響 以根尖為材料,于6:00~11:30每隔0.5 h取樣1次,共取樣12次,不同取樣時間獲得的染色體制片效果見圖2。由圖2可知,6:00(A1)取樣材料未獲得分裂相,染色體計數及觀察。6:30(B2)、7:30(C2)取樣可獲得較多分裂相,但染色體有重疊,雖然可用于染色體計數,但不利于后期染色體核型分析。8:00(E2)、8:30(E2)取樣獲得的染色體分散,形態清晰,可用于染色體計數及后期形態觀察。取樣時間為9:00、9:30、10:00、11:00時獲得的染色體制片見圖G2~I2,取材細胞處于分裂期后期,可以進行染色體計數等觀察,但染色體較密集、濃縮,不利于核型分析。10:30(I2)、11:30(J2)取樣獲得的染色體制片可獲得分裂相,但染色體較聚集,有重疊,不利于核型分析。綜合分析適宜進行馬藍染色體分析的根尖取樣時間為上午8:00(E2)、8:30(F2),可獲得染色體分散良好、清晰的制片。
2.1.3 不同預處理試劑對馬藍染色體效果的影響 預處理是否適宜是染色體制片技術最關鍵的操作步驟。試驗采用6種不同預處理液對馬藍根尖進行預處理,不同預處理液對染色體制片效果影響見圖3,結果表明0.1%秋水仙素溶液中室溫預處理0.5 h效果最好,見圖B3,細胞背景干凈,染色體縮縊程度合適,分散適宜且清晰,易于統計染色體數及進行核型分析;0.2%秋水仙素溶液(C3)中室溫預處理0.5 h及0.1%秋水仙素與8羥基喹啉混合液(D3)室溫處理0.5 h效果較好,細胞背景較干凈,染色體較清晰,可用于染色體計數,但有重疊,不利于后期染色體形態觀察及核型分析;飽和對二氯苯溶液處理后制片效果見圖E3,細胞背景較干凈,染色體有分散,但重疊部分較多;8羥基喹啉處理后的制片效果如圖F3,細胞背景干凈,可見分裂相,但是染色體濃縮,無法進行后續觀察;0.05%秋水仙素處理后未觀察到分裂中期染色體,無法進行染色體后續觀察。本研究還在前期預試驗中先用0.05%秋水仙素溶液4℃處理24 h,再用冰水混合物處理24 h,未觀察到分裂相,單獨用冰水混合物處理24 h也未得到分裂相。綜上所述試驗中篩選出最適合的預處理液為0.1%秋水仙素溶液,在室溫下對馬藍根尖預處理0.5 h可獲得染色體形態清晰、易于計數及觀察的制片。
2.1.4 不同解離時間對馬藍染色體制片效果的影響 壓片中組織的解離主要用鹽酸,使細胞壁之間的中層果膠物質以及部分細胞質分散,而使細胞易于分散,同時也可使細胞壁軟化而易于壓片。試驗采用1 mol·L-1鹽酸溶液60℃水浴解離4、6、8及10 min,比較不同解離時間對馬藍細胞染色體制片的影響。結果如圖4,解離浴4、6 min后獲得的制片細胞未分散,染色體較小,無法進行染色體計數及后期染色體觀察,而解離10 min時細胞分散,但細胞壁破裂,出現2~3個細胞染色體混合的現象,解離8 min后獲得的制片細胞分散程度適宜,細胞壁完整,染色體清晰,觀察效果最佳。因此,馬藍染色體制片最佳解離方式為1 mol·L-1鹽酸溶液在60℃水浴中解離8 min,可獲得細胞分散適宜,染色體清晰,易于觀察及計數的制片。
2.1.5 不同染色液及卡寶品紅染色時間對馬藍染色體染色效果的影響 本研究先采用醋酸洋紅和卡寶品紅溶液兩種染色液分別染色4、6、8及10 min,然后進行染色效果比較結果見圖5。由圖5可知,卡寶品紅染色液可將染色體染為紅色,利于進行染色體觀察,而醋酸洋紅未獲得理想染色效果,總之卡寶品紅染色液染色效果優于醋酸洋紅染色液。因醋酸洋紅進行染色后染色體顏色均不明顯,獲得的制片雜質較多,不利于觀察,故后期未進行不同染色時間的比較,僅進行卡寶品紅不同染色時間的效果比較。卡寶品紅不同染色時間效果見圖6、由圖6可知,卡寶品紅溶液染色6 min時獲得的染色體顏色偏淡,個別染色體尾部不明顯,不利于染色體核型分析;卡寶品紅溶液染色8 min后獲得的染色體較清晰,易于分辨,利于染色體觀察;染色10 min獲得的染色體顏色偏深,雖然染色體也較清晰,但整體視覺效果略差。綜上馬藍染色體制片最佳染色處理為卡寶品紅染色8 min,可節約時間,同時獲得染色體清晰、利于觀察的制片。
2.2 馬藍染色體核型分析
2.2.1 染色體數目 核型分析主要以染色體相對長度、臂比等為依據。選擇30個細胞進行染色體計數,選擇形態清晰、分散良好的染色體進行核型分析。結果表明馬藍染色體數目為28~32條,其中27個細胞的染色體數為32條,超過總數的85%,綜上馬藍染色體的數目為2n=32。
2.2.2 染色體核型特征 獲得的馬藍染色體核型參數及形態如表2及圖7,結果表明,馬藍染色體核型公式為2x=2n=32=4sm+28m,其中包含了4個亞中部著絲點染色體(sm),28個中部著絲粒染色體(m)。染色體相對總臂長3.428%~10.285%,最長與最短染色體長度比值為3.00,臂比值范圍為1.013~1.988,沒有臂比值大于2的染色體,核型不對稱系數為1B型。核型不對稱系數為59.54%。
3 討論與結論
本試驗從馬藍染色體制片壓片法的優化著手,對馬藍染色體制片取材的選擇、預處理方法、預處理時間、解離時間、染色液選擇與染色時間等方面進行篩選,獲得馬藍染色體制片壓片技術。結果表明上午08:00、08:30取馬藍根尖0.1%秋水仙素室溫預處理0.5 h,然后用1 mol·L-1鹽酸溶液在60℃水浴中解離8 min,卡寶品紅染液染色8 min,可獲得染色體清晰、分散度良好的制片。制片過程中預處理時間影響染色體的形態,處理時間過短會出現染色體拖尾現象,而時間過長染色體會凝縮過度。在取材方面李懋學等[17]認為凡能進行細胞分裂的植物組織或單個細胞都可用于染色體觀察,但在植物生長發育的過程中,其分生組織或細胞分裂活動,除有自身發育的階段性外,還受外界環境條件的影響,需要充分掌握其機構及生長發育規律,了解具體植物的生長發育特性,創造適宜的環境條件才能準確獲得制備優良染色體的材料。本試驗通過變溫處理[22]及不同取材部位分析,確認獲得馬藍染色體優良染色體的取材部位為根尖。壓片時蒿若超等[30]改良的壓片技術是先用鑷子將材料搗碎后,再將蓋玻片放置于上方,筆者在制片過程中將材料壓碎后去除全部大塊組織,可減少雜質,獲得的染色體更清晰。
吳瑞霞[22]研究中對不同地點的馬藍進行核型分析,其中福州本地栽培馬藍的核型類型為3B,染色體數量為32條,南平茫蕩山馬藍的核型類型為2B,染色體數量為32條。本試驗中材料取自福建莆田的馬藍核型類型為1B,染色體數量為32條。Arano[28]認為,當核型不對稱系數低于60%時,核型對稱性較高;反之則較低。一般來講核型進化的基本趨勢是由對稱向不對稱發展的,系統演化上處于比較古老和原始的植物,大多具有較對稱的核型,而不對稱的核型常見于衍生、特化以及比較進化的植物類群中[31]。對稱程度越高,其染色體變異越小,進化程度越低,相反則染色體變異越大,進化程度越高,由此莆田的馬藍類型偏原始。但馬藍核型類型不同可能因為選用的品種、生長環境而形成差異,而染色體數量受品種、生長環境影響較小,形成差異的可能性也小。
致謝:本試驗中得到福建農林大學潘大仁老師的悉心指導,在此表示衷心感謝。
參考文獻:
[1]國家藥委員會.中華人民共和國藥典2020版一部[M].北京:化學工業出版社,2020:208.
[2]陳曉慶.南板藍(馬藍)栽培的關鍵技術研究[D].廣州:廣州中醫藥大學,2011.
[3]李秋菊.冬季栽培馬藍正當時[J].特種經濟動植物,2006(11):30-31.
[4]姚洪源,莫禮龍,田華林,等.馬藍高產栽培技術[J].林業實用技術,2010(6):45-46.
[5]黃玉香.馬藍藥效物質形成關鍵基因的挖掘與功能研究[D].泉州:華僑大學,2017.
[6]曾美娟,刁勇.馬藍次生代謝產物研究進展[J].中國農學通報,2016,32(32):30-34.
[7]馬燕如,趙肖玉,徐正.大黃酚和大黃酸的合成[J].合成化學,2007,15(2):244-246.
[8]李鋒,王勝春,王新,等.大黃瀉下效應的藥理學新解釋[J].中國中藥雜志,2008,33(4):481-483.
[9]李振濤,朱奇,紀宇.植物生物堿抗腫瘤作用機制的研究進展[J].藥學進展,2005,29(5):193-197.
[10]沈以紅,朱見,李競.植物生物堿在醫藥領域的研究與應用[J],蠶學通訊,2008,1(28):25-31.
[11]BARARA C S,MIRZA M H,BARBARA H K,et a1.Transinet induction of cytohromes P450 1A1 and 1B1 in MCF7 human breast cancer cells by indirubin[J]. Biochemical Pharmacol, 2003,66:2313-2321.
[12]NAI K M,CHUNG Y L,XIAO Y W,et al.Inhibtion of RANTES expression by in influenza virusinfected humanbronchial epithelial cell[J]. Biochemical Pharmacol, 2004,67(1):167-174.
[13]吳蓮明,楊堯平,朱傳先,等.青黛治療慢性粒細胞白血病有效成分的研究(I)報[J].中草藥通訊,1978,4:5-8.
[14]黃以鐘,潘大仁,王占成,等.不同生長時期對馬藍藥效成分的影響[J].中國農學通報,2009,25(16):75-78.
[15]向小亮,寧書菊,黃延齡,等.外源水楊酸對馬藍葉片中蛋白水平表達的影響[J].應用生態學報,2010,21(3):689-693.
[16]王金坤,成美林,徐藝瑋,等.植物靛藍染料的生物制備[J]. 針織工業,2020(3):40-44.
[17]李懋學,張杶方.植物染色體研究技術[M].哈爾濱:東北林業大學出版社,1991.
[18]楊漢民.細胞生物學實驗[M].北京: 高等教育出版社,1997: 208.
[19]王麗平.黃楊屬五種植物的核型分析[D].南京:南京林業大學, 2010.
[20]陳瑞陽,宋文芹,李秀蘭.植物染色體標本制備的去壁、低滲法及其在高胞遺傳學中的意義[J].遺傳學報,1982,9(2):151-159.
[21]葉勝海,李春壽,阮關海,等.作物單倍體二倍化及其染色體倍性鑒定研究進展[J].浙江農業學報,2003,15(5):323-326.
[22]吳瑞霞.馬藍的形態組織觀察與細胞核型分析[D].福州:福建農林大學,2010.
[23]任琛,孫景景,袁瓊.蟛蜞菊屬和孿花菊屬(菊科-向日葵族)的細胞學研究[J].熱帶亞熱帶植物學報,2012,20(2):107-113.
[24]李娟娟,王蕾,賈俊忠,等.黃瓜正常品種及一個芽黃突變體的核型分析[J].湖北農業科學, 2011, 50(2):296-300.
[25]鄭金雙,張蜀寧,孫成振,等.不結球白菜根尖體細胞染色體制片及其二倍體和四倍體有絲分裂過程觀察[J].植物資源與環境學報,2011,20(4):58-63.
[26]丁鴻,邱東萍,陳少雄.植物染色體標本的制備和染色體核型分析研究進展[J].南方農業學報,2012,43(12):1958-1962.
[27]ARANO H.Cytological studies in subfamily Carduoideae(compoitae) of Japan[J]. IX Bot Mag Tokyo, 1963,76:32.
[28]LEVAN A, FREDGA K, SANDBERG A.Nomenclature for centromeric position on chromosomes[J]. Hereditas Band, 1964,52:197-202.
[29]STEBBINS G L I.Chromosome evolution in higher plants[M].London:Adward Arnold,1971:88.
[30]蒿若超,武美燕.一種植物染色體制片改良方法[J].長江大學學報(自然科學版),2011,8(2):236-238,289.
[31]陳盈盈,官錦燕,譚嘉娜,等.辣木的染色體制片優化及核型分析[J].熱帶作物學報,2020,41(6):1174-1178.
(責任編輯:柯文輝)

