一例鴨甲肝病毒與多殺性巴氏桿菌混合感染的診斷報告
李坤林 趙蕾


摘要:2021年4月,山東省博興縣某鴨場雛鴨發生一起以精神沉郁、發病急、病程短、發病率和死亡率高為主要臨床特征的疫病,根據臨床和實驗室診斷結果確診為基因C型鴨甲肝病毒和莢膜A型多殺性巴氏桿菌混合感染,為及時準確采取針對性治療措施提供了參考。
關鍵詞:雛鴨;鴨甲肝病毒;多殺性巴氏桿菌;混合感染;診斷
鴨病毒性肝炎是雛鴨的一種急性、致死性傳染病,具有傳播快、病程短、發病急、病死率高等流行特點,其主要致病原為鴨甲肝病毒,以3周齡內雛鴨易感,且雛鴨日齡越小,死亡率越高,是當前危害雛鴨健康最嚴重的傳染病[1]。鴨巴氏桿菌病是由多殺性巴氏桿菌引起的一種急性、敗血性、高度接觸性傳染病,該病在我國鴨群中的流行較為普遍,每年都給我國養鴨產業造成巨大的經濟損失[2]。鴨甲肝病毒和多殺性巴氏桿菌均是當前威脅鴨群健康的主要疫病,2021年4月,山東省博興縣某鴨場雛鴨發生一起疑似鴨甲肝病毒和多殺性巴氏桿菌混合感染病例,現將整個診斷過程匯報如下。
1 發病情況
2021年4月初,該鴨場飼養的7日齡肉鴨開始發病,發病雛鴨食欲下降、精神沉郁,發病急,發病率在80%以上,病程短,發病后48h內死亡,剛開始發病時死亡率較低,但發病后期死亡率較高,整體死亡率在60%以上。
2 臨床癥狀
發病雛鴨精神沉郁,食欲廢絕,羽毛松亂,搖頭,喜臥,死亡前大多數會發生抽搐,表現出明顯的神經癥狀,死后呈角弓反張姿勢。
3 剖檢特征
解剖死亡雛鴨可見肝臟腫大、有出血點和出血斑、表面具有白色黏膜,脾臟腫大、壞死,腎臟腫大、有出血點,心內外膜斑點狀出血,肺臟水腫、出血。無菌采集死亡雛鴨的肝臟、脾臟作為臨床病料樣品,在實驗室進行病毒PCR檢測和細菌分離鑒定。
4 病毒PCR檢測
4.1 設計合成引物
參照黃秋雪等[3]建立的基因A型和C型鴨甲肝病毒雙重RT-PCR鑒別檢測方法分別設計合成基因A型和C型鴨甲肝病毒特異性檢測引物(引物信息如表1所示)。
4.2 一步法RT-PCR擴增
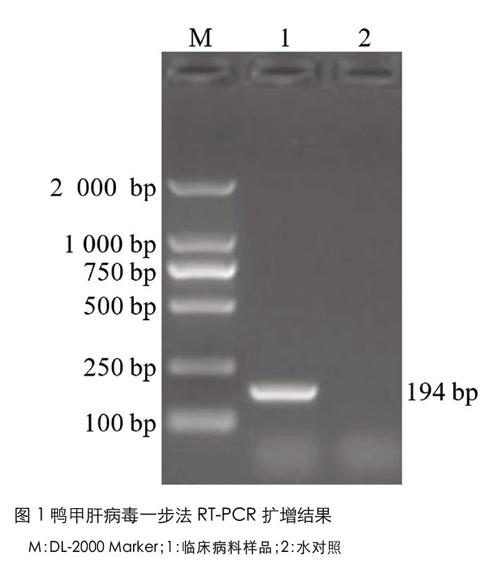
按照病毒基因組RNA提取試劑盒(購自北京百泰克生物科技有限公司)使用說明書提取臨床病料樣品的基因組RNA,利用設計合成的鑒別檢測引物對提取的病料樣品基因組RNA進行一步法RT-PCR擴增。一步法RT-PCR擴增體系為:2×One step Buffer 12.5μL、One step Enzyme Mix 0.5μL、引物F1/R1/F2/R2各0.5μL、RNA 4.0μL、H2O 6.0μL。一步法RT-PCR擴增程序為:50℃ 30min;95℃ 5min;95℃ 30s,60℃ 30s,72℃ 30s,30個循環;72℃ 10min。一步法RT-PCR擴增結束后,取5μL擴增產物進行瓊脂糖凝膠電泳,結果如圖1所示,擴增產物在194bp處具有一條特異性擴增條帶,與基因C型鴨甲肝病毒預期擴增片段大小一致,表明臨床病例為基因C型鴨甲肝病毒陽性。
5 細菌分離鑒定
5.1 細菌分離培養
將無菌采集死亡雛鴨的肝臟、脾臟等臨床病料樣品劃線接種于鮮血瓊脂平板,37℃培養24h后,血平板上生長出邊緣整齊、表面光滑、圓形隆起、灰白色、露珠狀的單菌落,將單菌落涂片、革蘭氏染色、鏡檢可見革蘭氏陰性菌、短桿狀,符合多殺性巴氏桿菌的培養特征。
5.2 生化鑒定試驗
對分離菌株進行常規生化鑒定試驗,結果表明分離菌株能夠發酵蔗糖、葡萄糖、果糖,不能發酵麥芽糖、乳糖、鼠李糖,氧化酶、吲哚試驗均為陽性,甲基紅、硫化氫試驗均為陰性,符合多殺性巴氏桿菌的生化特性。
5.3 莢膜基因型鑒定試驗
5.3.1 設計合成引物 參照Townsend K M等[4]建立的多殺性巴氏桿菌不同莢膜基因型多重PCR鑒別檢測方法分別設計合成莢膜A型、B型、D型、E型、F型特異性檢測引物(引物信息如表2所示)。
5.3.2 PCR擴增 按照細菌基因組DNA提取試劑盒(購自北京百泰克生物科技有限公司)使用說明書提取分離菌株的基因組DNA,利用設計合成的鑒別檢測引物對提取的DNA進行PCR擴增。PCR擴增體系為:2×Taq PCR Master Mix 12.5μL、DNA 4μL、引物F3/R3/F4/R4/F5/R5/F6/R6/F7/R7各0.5μL、水3.5μL。PCR擴增條件為:95℃ 5min;95℃ 45s,55℃ 45s,72℃ 45s,30個循環;72℃ 10min。PCR擴增結束后,取5μL擴增產物進行瓊脂糖凝膠電泳,結果如圖2所示,擴增產物在1,044bp處具有一條特異性擴增條帶,與莢膜A型多殺性巴氏桿菌預期擴增片段大小一致,表明分離菌株為莢膜A型多殺性巴氏桿菌。
6 綜合診斷結果
根據發病情況、臨床癥狀、剖檢特征等臨床診斷結果和病毒PCR檢測、細菌分離鑒定等實驗室診斷結果,綜合判定臨床病例為基因C型鴨甲肝病毒和莢膜A型多殺性巴氏桿菌混合感染。
7 討論
鴨甲肝病毒具有三種基因型(A型、B型和C型),各基因型之間無交叉保護作用,基因A型為我國傳統的流行毒株,基因B型為2007年開始出現的新毒株,我國內陸地區尚未發現基因B型的流行。過去我國鴨甲肝病毒的流行優勢基因型為A型,但近年來隨著基因A型疫苗和卵黃抗體的廣泛應用,A型的發病率逐步降低,但由于基因A型疫苗和卵黃抗體無法保護基因C型的感染,導致近年來基因C型的發病率迅速增加,管飄萍等[5]采用PCR方法對從山東省分離出的22株鴨甲肝病毒進行了基因分型,基因A型占36.36%(8/22),基因C型占63.63%(14/22)。本研究采用RT-PCR方法對臨床病例進行了基因分型檢測,結果顯示為基因C型,與管飄萍等[5]的研究結果表現出了一致性,說明當前山東地區鴨群中流行的鴨甲肝病毒以基因C型為主要流行基因型,以預防基因A型為主的防控措施已不能滿足臨床疫病的防控需要,應逐步加強基因C型的防控。
根據多殺性巴氏桿菌莢膜抗原不同,將其分為5個莢膜基因型(A型、B型、D型、E型、F型),我國主要流行A型、B型、D型。Townsend K M等[4]通過比較分析多殺性巴氏桿菌莢膜基因特異性位點,建立了檢測多殺性巴氏桿菌莢膜分型的多重PCR鑒別檢測方法,該方法操作簡單、準確、快速,在多殺性巴氏桿菌基因型分析中得到了廣泛應用。仇桂玲等[6]采用多重PCR方法對20株禽源多殺性巴氏桿菌進行了莢膜基因型分型,莢膜A型為18株,占90%。本研究采用多重PCR方法對臨床病例進行了基因分型檢測,結果顯示為莢膜基因A型,與仇桂玲等[6]的研究結果表現出了一致性,說明當前我國禽源多殺性巴氏桿菌的流行菌株以莢膜A型為主要基因型,臨床應合理選擇和使用疫苗,確保疫苗的免疫效果。
混合感染病例不僅使疫病的危害程度加劇,經濟損失增加,也使疫病的診斷和治療更加困難。由于混合感染病例的臨床癥狀十分復雜,僅通過臨床診斷很難確診致病原,一般均需要借助實驗室診斷方法。PCR方法作為最常用的分子生物學檢測技術,能夠檢測到不同基因型致病原的特異性核苷酸序列,具有常規免疫學檢測技術無法比擬的準確性,故本病例采用PCR技術分別對病毒和細菌均進行了分子水平上的鑒定,使診斷結果準確可靠。總之,本研究綜合臨床和實驗室診斷結果判定為此次疫病由基因C型鴨甲肝病毒和莢膜A型多殺性巴氏桿菌兩種致病原混合感染所致,但尚不能確定是哪種致病原在雛鴨發病過程中起主導作用,推測有兩種可能,一種可能是雛鴨先感染了鴨甲肝病毒,導致雛鴨抵抗力降低,此時環境中的條件性致病菌(多殺性巴氏桿菌)迅速生長繁殖,加劇了疫病危害程度,使發病率和死亡率增加;另一種可能是雛鴨先感染了多殺性巴氏桿菌,導致雛鴨體質下降,引起鴨甲肝病毒的感染。無論是哪種可能,都與鴨場的日常飼養管理和生物安全防控技術密切相關,本次疫病發生的鴨場為連續飼養多年的老場,場內致病原逐年累積,一旦鴨群受到環境應激(如溫差較大、多雨潮濕、驚嚇、疫苗免疫等),鴨群免疫力下降后就會增加致病原混合感染的風險。故只有加強日常飼養管理和生物安全防控措施,使鴨群保持健康體質,才能有效避免混合感染的發生。
參考文獻:
[1] 張大丙.鴨甲肝病毒的分子生物學研究進展[J].中國獸醫雜志,2010,46(3):59-61.
[2] 李潤楠.一株由鴨頭分離的巴氏桿菌鑒定與分析[J].中國動物保健,2020,22(10):82+84.
[3] 黃秋雪,湯承,聶培婷,等. 鴨甲肝病毒基因A型和C型雙重RT-PCR檢測方法的建立[J].中國預防獸醫學報,2012,34(2):120-123.
[4] Townsend K M, Boyce J D, Chung J Y, et al. Genetic organization of Pasteurella multocida cap Loci and development of a multiplex capsular PCR typing system[J]. J Clin Microbiol, 2001, 39(3): 924-929.
[5] 管飄萍,Enkhbayar Munkhbayar,黃紫貝,等. 22株鴨甲型肝炎病毒的分離鑒定及其VP1基因的序列分析[J]. 中國家禽,2021,43(1):105-109.
[6] 仇桂玲,鐘嘉誠,譚結敏,等.20株禽多殺性巴氏桿菌的分離及莢膜與脂多糖的分型鑒定[J].廣東畜牧獸醫科技,2021,46(1):43-49+52.
作者簡介:李坤林(1976— ),山東成武人,助理研究員,本科,主要從事動物營養與動物疫苗研制工作,E-mail:15865218222@163.com
通訊作者:趙蕾(1977— ),副研究員,主要從事預防獸醫學研究工作,E-mail:zhaolei77718@163.com

