紅螯光殼螯蝦Hsp70基因的特征及其在熱應激下的表達
姚成杰,劉佳珺,林振烔,王藝磊
(集美大學水產學院,福建省水產生物育種與健康養殖工程研究中心,福建 廈門 361021)
0 引言
紅螯光殼螯蝦(Cheraxquadricarinatus),原產于澳大利亞,屬于甲殼綱(Crustacea)十足目(Decapoda)擬河蝦科(Parastacidae),為我國20世紀90年代引進的淡水蝦類。由于食性廣、生長快、肉質細嫩、味道鮮美、營養豐富,深受養殖戶和消費者的喜愛[1]。已有研究表明,導致養殖生物免疫抗病能力降低的主要原因是環境因子變化[2]。其中,水溫作為影響蝦蟹等甲殼類動物生存最重要的環境因子之一,不僅直接影響其代謝、生長、蛻殼和存活等[3-5],而且還會影響鹽度、溶氧量等環境因子。
熱休克蛋白(heat shock protein,HSP)是一類高度保守的細胞蛋白家族[6]。按分子質量大小可分為HSP110、HSP90、HSP70、HSP60及小分子HSP和泛素等6個家族[7]。其在環境脅迫因子(高溫、重金屬和微生物感染等)刺激下表達量顯著升高[8-10]。HSP70是HSP家族蛋白中含量最多的熱應激蛋白,該蛋白廣泛存在于動植物和微生物中,并扮演著“守衛者”的角色,其功能主要是參與和調控蛋白質的折疊修飾[11],在應激等不利條件下,提高細胞的抵抗力,起到應激保護作用。研究表明,HSP70可通過降解異常蛋白促進蛋白的正確重折疊而在應對熱脅迫時發揮重要調節作用[12-13]。
研究熱應激本質及HSPs的作用機理,對于動物生產和繁殖有著非常深遠的現實意義。近年來,水生動物體在熱應激過程中HSPs的表達變化相繼被報道,例如有西伯利亞鱘(Acipenserbaeri)[14]、虹鱒(Oncorhynchusmykiss)[15]、銀鯽(Carassiusauratusgibelio)[16]。相較于克氏原螯蝦(Procambarusclarkia)[17]和鋸緣青蟹(Scyllaserrata)[18]等水生無脊椎動物,紅螯光殼螯蝦的相關研究較少。
本實驗以紅螯光殼螯蝦為研究對象,在NCBI上獲取Hsp70(KR058821.1)基因序列的基礎上,分析其結構特征,研究其在高溫應激下鰓、肝胰腺和血淋巴中的表達變化,以期為研究紅螯光殼螯蝦熱應激過程中的生理機制奠定基礎,有助于螯蝦養殖者理解熱應激的生理變化、評估熱應激的不利影響并做好熱應激預防。
1 材料與方法
1.1 材料
紅螯光殼螯蝦取自廈門市紀雄水產有限公司,體長(13.03±0.43)cm,體重(80.69±0.56)g,于本實驗室28 ℃的淡水養殖缸中暫養7 d后用于實驗。
1.2 實驗方法
1.2.1 高溫應激實驗
對照組以紅螯光殼螯蝦生長溫度(26~30 ℃)的中間溫度(28 ℃)進行實驗,高溫組設定為34 ℃和36 ℃。觀察到紅螯光殼螯蝦的生長狀況為:28 ℃下20尾蝦生長均良好,活力較好;34℃應激下,20尾蝦在初始一段時間反應大,躲避反應較為頻繁,24 h之后活力有所恢復,48 h有30%的蝦死亡;36 ℃應激下,20尾蝦在24 h內全部死亡。根據數據統計及活力觀察,最終確定以34 ℃進行高溫應激實驗。
將28 ℃下暫養的紅螯光殼螯蝦分為2組,分別設為對照組和實驗組。對照組水溫為28 ℃,于0 h 取樣。實驗組水溫為34 ℃,于6 h、12 h、48 h和72 h取樣。每個時間點各取6尾蝦,共24尾。每尾蝦取其血細胞、鰓和肝胰腺,放入RNA later溶液后保存于-80 ℃超低溫冰箱中,用于RNA的提取。
1.2.2 熱休克及免疫相關基因定量引物設計
本實驗所用的Hsp70基因和內參基因β-actin定量引物通過Primer 5.0軟件設計,所有引物依托廈門鉑瑞生物科技有限公司合成。各引物及其序列如表1所示。
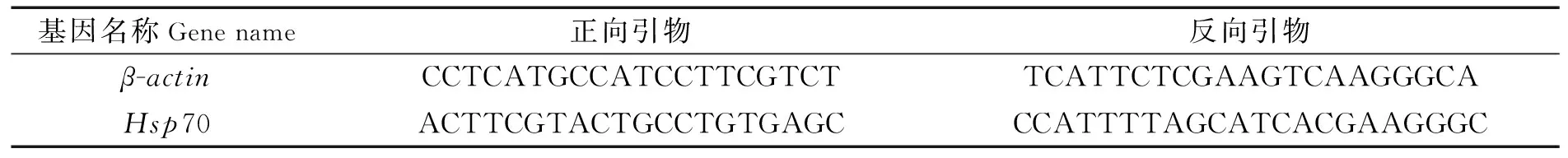
表1 實時定量PCR引物序列
1.2.3 總RNA的提取及cDNA模板制備
用EastepTMSuper總RNA試劑盒提取紅螯光殼螯蝦鰓、肝胰腺和血淋巴3個組織5個時相(對照組0 h;實驗組6,12,48,72 h)的RNA,利用紫外分光光度計和1%(質量分數)瓊脂糖凝膠電泳來驗證RNA的質量及完整性。采用Promega公司提供的M-MLV酶進行逆轉錄,制備定量用cDNA模板。
1.2.4 目的基因的生物信息學分析
用Compute pI/Mw tool(http://www.expasy.org/tools/pi_tool.html)預測等電點和分子質量;用NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)查找磷酸化位點;采用SignalP 5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)尋找信號肽;用BioEdit軟件(http://www.mbio.ncsu.edu/BioEdit/bioedit.html)進行序列多重比較;用MEGA X軟件(http://www.megasoftware.net/)中的鄰接法構建系統進化樹。
1.2.5 實時定量PCR體系及條件
以紅螯光殼螯蝦的β-actin作為內參基因,以逆轉錄獲得的cDNA第一條鏈為模板。反應體系如下:cDNA模板4.5 μL,SYBR Green Real-time PCR Master Mix 5 μL,正/反向定量引物各0.25 μL。包括對照組在內的5個時相,每個時相做6個樣品。PCR反應條件:95 ℃變性15s,60℃退火1 min,40個循環。
數據分析:根據儀器自動給出樣品的RQ值(即2-△△Ct,其中△CT=“樣品目的基因的CT值”減“內參基因β-actin的CT值”,△△CT=“每一個樣品的△CT值”減“基準樣品的△CT值”),記錄下RQ值。用RQ的平均值±標準誤(mean±standard error,M±SE)表示基因表達水平。
使用SPSS 20.0統計軟件對數據進行t-檢驗和單因素方差分析,以P<0.05為顯著水平,P<0.01為極顯著水平。
2 結果
2.1 CqHsp70序列分析
紅螯光殼螯蝦CqHsp70基因Genbank數據庫登錄號為KR058821.1。其核苷酸序列及推導的氨基酸序列見圖1。CqHsp70的開放閱讀框(open reading frame,ORF)1932 bp,編碼氨基酸643個。使用Compute pI/Mw tool預測得到理論等電點為5.27,分子質量為70.3 ku,5’ UTR 37 bp,3’ UTR 549 bp。該序列預測含有32個絲氨酸(Ser)磷酸化位點,39個蘇氨酸(Thr)磷酸化位點和12個酪氨酸(Tyr)磷酸化位點。此外,4—598aa為HSP70結構域,序列中并沒有發現信號肽。

2.2 序列多重比對
多重比對發現HSP70在不同物種中保守性高(見圖2)。比對中所用的物種和氨基酸序列信息見表2。
2.3 HSP70的系統進化樹構建
從NCBI數據庫中獲取了16個不同物種的HSP70氨基酸序列(見表2)。使用MEGA X軟件分析HSP70的進化樹。根據構建后得到的HSP70進化樹可見:HSP70主要分為脊椎動物和無脊椎動物兩支,脊椎動物分支中包含哺乳動物和魚類,無脊椎動物分支中包括蝦蟹類和貝類等。紅螯光殼螯蝦HSP70與美洲螯龍蝦(Homarusamericanus)、鋸緣青蟹(Scyllaserrata)及三疣梭子蟹(Portunustrituberculatus)等蝦蟹類的HSP70聚為一支,其與美洲螯龍蝦一致性最高,達到99%。
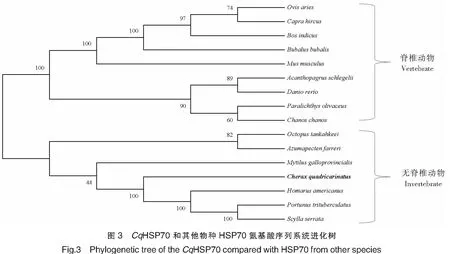
表2 HSP70的物種名稱和GenBank登錄號
2.4 CqHsp70在熱應激下的表達
采用實時熒光定量PCR方法,對紅螯光殼螯蝦在34 ℃高溫應激下的鰓、肝胰腺和血細胞中的CqHsp70基因表達量進行分析。結果表明:紅螯光殼螯蝦鰓中CqHsp70基因表達量在6 h時最低,與對照組差異不顯著;12 h時該基因表達量最高,與對照組形成極顯著差異(P<0.01);之后回落至正常水平(見圖4a)。
在34 ℃高溫應激下,紅螯光殼螯蝦肝胰腺中CqHsp70基因表達量變化趨勢與鰓相同。6 h時,該基因的表達量與對照組差異不顯著;12 h時該基因表達量最高,與對照組形成顯著差異(P<0.05);48 h時已回復正常表達水平(見圖4b)。
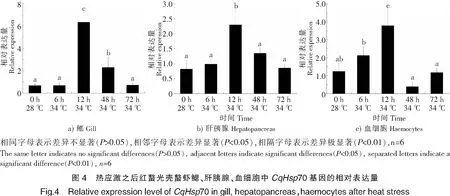
在34 ℃高溫應激下,紅螯光殼螯蝦血細胞中CqHsp70基因表達量在6 h時已開始上升,但與對照組沒有顯著性差異;12 h時該基因表達量最高,與對照組形成極顯著差異;48 h之后表達量與對照組差異不顯著,已恢復至正常水平(見圖4c)。
3 討論
3.1 CqHsp70基因的結構特征
HSP70家族在進化上是高度保守的,是目前研究最深入的HSP之一,適量HSP70的存在對維持動物正常生長發育是必需的,在提高細胞對應激的耐受性及維護細胞自穩等方面具有重要的生物學作用[19]。紅螯光殼螯蝦CqHsp70的cDNA全長2231 bp,5’ UTR 37 bp,3’ UTR 549 bp,可編碼643個氨基酸,4—598aa為HSP70結構域。CqHsp70預測含有83個磷酸化位點,序列含有39個絲氨酸(Ser)磷酸化位點,32個蘇氨酸(Thr)磷酸化位點和12個酪氨酸(Tyr)磷酸化位點。在序列中沒有發現信號肽,與擬穴青蟹(Scyllaparamamosain)的HSP70分析結果一致[20]。HSP70結構域可再分為三個結構域,N端兩個結構域(ATP酶結構域和底物結合結構域)和C端結構域,且具有谷氨酸—谷氨酸—纈氨酸—天冬氨酸(EEVD)的末端特征序列[21]。多重序列比較結果顯示,紅螯光殼螯蝦HSP70與其他物種蛋白序列在N端ATP酶結構域和底物肽結合結構域相似性很高,在C端結構域保守性有所降低,這符合HSP70的保守性和結構特征[22]。
HSP70在動物中廣泛存在。進化樹分析結果表明,HSP70分為兩大支,一大支由脊椎動物組成,一大支由無脊椎動物組成,與其進化地位較一致。紅螯光殼螯蝦的CqHSP70與蝦蟹類的HSP70聚為一支,且相似度較高,并與美洲螯龍蝦的HSP70相似性最高,這表明HSP70蛋白在甲殼動物中高度保守。
3.2 CqHsp70基因的表達
熱應激是指當環境溫度超過動物舒適溫度(產熱最低點與蒸發散熱急劇增加起始點之間的溫度)時,動物體為保護其正常的代謝作用和各種生理機制所必須做出的各種反應的總和[6]。生物體在正常生理條件下有少量的熱休克蛋白存在且表達量低,其表達量在受到熱應激后會被強烈誘導[23]。
作為一種重要的內源性細胞保護因子,HSP70具有修復應激給機體帶來損害的功能[24]。在大多數的器官中,應激誘導的HSP70是熱休克蛋白中重要成員之一,當受到熱應激誘導之后其表達量會增加[25]。對大西洋無眼裂縫蝦(Rimicarisexoculata)轉錄組分析結果表明,兩個Hsp70亞型基因表達量在熱應激后分別增加261倍和154倍[26]。擬穴青蟹(Scyllaparamamosain)的Hsp70基因表達量在熱應激后顯著提高[27]。另外,甲殼類動物在熱應激后,Hsp70表達量的升高對保護機體起著重要作用。研究表明,短期高溫暫養斑節對蝦(Penaeusmonodon)可增加Hsp70的表達,減少鰓相關病毒的復制[28]。非致死熱休克誘導凡納濱對蝦(Penaeusvannamei)Hsp70的合成,促進其對熱、氨和金屬的耐受性[29]。而采用RNAi技術敲除Hsp70,會降低方斑鹵蟲(Artemiafranciscana)幼體對熱和細菌感染的耐受性[30]。
本實驗選擇鰓、肝胰腺和血液這三個蝦蟹重要免疫器官對Hsp70基因表達量變化進行分析,實時定量PCR結果表明,CqHsp70基因在紅螯光殼螯蝦的鰓、肝胰腺、血細胞中均有表達。尤其是在血細胞中表達水平最高,其次是在肝胰腺中,而在鰓中表達水平最低。這說明紅螯光殼螯蝦血細胞是CqHsp70發揮其抗應激作用的重要部位。
高溫應激初始階段(6 h內),紅螯光殼螯蝦血細胞中CqHsp70基因表達上調,這可能是因為血細胞中的CqHsp70基因作為重要細胞保護因子較早發揮作用。隨著應激時間的延長,血細胞、肝胰腺和鰓中的CqHsp70基因的表達在12 h達到高峰。說明此時CqHsp70在應激防御中起著不可替代的重要作用,也說明高溫應激后的12 h是紅螯光殼螯蝦調控熱應激的關鍵點,在夏天高溫季節的養殖過程中應特別加以注意。

