精胺對輻射所致氧化損傷H9c2心肌細胞的影響研究
杜霄,許超,涂彧,周菊英*
機體的電離輻射損傷一直是放療科醫生非常關注的問題。輻射可直接作用于細胞關鍵靶點,導致DNA單鏈或者雙鏈發生斷裂;亦可作用于水分子,產生大量自由基,直接攻擊細胞膜和細胞核內的DNA,造成DNA的間接損傷,引發不飽和脂肪酸脂質過氧化進而使細胞膜損傷、各種亞細胞結構破壞、酶活性降低和消失,如何避免或者減少這種損傷是目前研究的重點。精胺是一類廣泛分布的多胺,具有抗氧化、抗衰老、抗癌、調節細胞增殖以及維持細胞膜、核酸和離子通道等細胞結構穩定性的功能[1-3]。有研究表明,外源性精胺可使大鼠離體胸主動脈環收縮,并在一定范圍內呈濃度依賴性[4];細胞內精胺濃度變化可影響細胞的生長代謝過程。目前,精胺和放射導致的心肌氧化損傷之間的關系并不明確,相關研究甚少。因此本研究旨在探討精胺類藥物對輻射所致氧化損傷的心肌細胞是否具有保護作用。
1 材料與方法
1.1 研究時間 2018年12月至2020年12月。
1.2 實驗材料 spermine(美國sigma公司),H9c2細胞系(中科院上海細胞庫),DMEM培養基(美國corning公司),新生胎牛血清(美國gibco公司),胰蛋白酶(美國gibco公司),青霉素-鏈霉素溶液(上海碧云天科技有限公司),PBS(上海源培生物科技有限公司),CCK8試劑盒(日本同仁公司),超氧化物歧化酶(SOD)試劑盒(南京建成生物工程研究所,貨號:A001-1-1,生產批號:20190628),丙二醛(MDA)試劑盒(南京建成生物研究所,貨號:A003-1-1,生產批號:20190629),Annexin V-FITC/PI細胞凋亡檢測試劑盒(大連美倫生物技術有限公司:100T,貨號:MAO220-2,批號:Feb-28E)。
1.3 實驗儀器 MCO-18AC CO2細胞培養箱(日本松下健康醫療器械株式會社),倒置熒光顯微鏡(日本奧林巴斯公司),酶標儀(MK3型,美國Thermo公司),DK-500電熱恒溫水浴箱(上海精宏實驗設備有限公司),DK-S22電熱恒溫水鍋(上海精宏實驗設備有限公司),BY-G20型醫用離心機(北京白洋醫療器械有限公司),西門子primus醫用直線加速器,流式細胞儀(美國BD公司)。
1.4 H9c2心肌細胞的培養 將H9c2心肌細胞置于含10%胎牛血清、1%雙抗的DMEM高糖培養液,37 ℃、5% CO2、飽和濕度的培養箱中培養。
1.5 細胞存活率 取對數生長期的H9c2心肌細胞接種于96孔板,104個細胞/孔,24 h后加入精胺并分為100 μmol/L組、200 μmol/L組、400 μmol/L組,空白對照組為加等量不含藥物的培養液,每組設3個復孔。放置于CO2細胞培養箱中培養12、24、48 h后,在每孔內加入100 μl含10 μl新型細胞增殖及細胞毒性檢測溶液——CCK8溶液的細胞培養基,37 ℃下繼續在培養箱中培養4 h,于450 nm波長處測定每孔的光密度(OD)值,計算細胞存活率,細胞存活率=(加藥細胞OD值/對照細胞OD值)×100%,上述所有實驗步驟重復3次,取平均值。
1.6 細胞凋亡檢測 選取對數生長期的H9c2心肌細胞并調整細胞的數量為105/孔,接種于6孔板,24 h后分別加入精胺,根據細胞存活率的檢驗結果將細胞分為空白對照組、單純輻射組和輻射+100 μmol/L精胺組、輻射+200 μmol/L精胺組,培養24 h,對單純輻射組和輻射+100 μmol/L精胺組、輻射+200 μmol/L精胺組進行X線照射,輻射源為醫用直線加速器(西門子primus)6 MV X線照射,照射劑量6 Gy,劑量率200 MU/min,輻射視野10 cm×10 cm,用1.5 cm組織等效材料,消除建成區,機頭轉180°,空白對照組含等量的DMEM高糖培養基且不予X線照射,于照射后0、12、24、48 h進行如下操作:胰蛋白酶消化后,收集細胞,離心棄上清,用預冷PBS洗滌細胞2次,細胞沉淀中加入1×Bing buffer工作液,重懸后吸取細胞懸液至新管,加入5 μl Annexin V-FITC和5 μl碘化丙啶(PI)染色液,輕輕混勻。室溫避光孵育15 min,染色孵育后,每管加入400 μl 1×Binding Buffer工作液,混勻后使用流式細胞儀(美國BD公司)檢測,Annexin V-FITC為綠色熒光,PI為紅色熒光。細胞凋亡率=(早期凋亡率+晚期凋亡率)。Annexin V FITC/PI流式細胞術將實驗樣本中正常、壞死、凋亡細胞區分開。以FITC和PI熒光做雙參數點圖,細胞分為4個區,1區:機械損傷細胞(Annexin V FITC-/PI+);2區:凋亡晚期或壞死細胞(Annexin V FITC+/PI+);3區:活細胞(Annexin V FITC-/PI-);4區:早期凋亡細胞(Annexin V FITC+/PI-)。記錄4個區細胞比例并對各組不同時間的凋亡率進行比較。
1.7 MDA、SOD測定 選取對數生長期的H9c2心肌細胞,并調整細胞的數量為104/孔,接種于96孔板,24 h后分別加入精胺,處理條件同1.6,參照試劑盒說明書測定細胞培養液中MDA、SOD。
1.8 熒光顯微鏡下觀察H9c2心肌細胞的形態變化 選取處于對數生長期的H9c2心肌細胞并調整細胞的數量為105/孔,接種于6孔板中,24 h后分別加入精胺,處理條件同1.6,然后進行如下操作:預冷PBS溶液洗滌2次,在細胞中加1×Binding buffer工作液,再加入5 μl Annexin V-FITC和5 μl PI,輕輕混勻,室溫避光孵育15 min后熒光顯微鏡下觀察細胞形態學變化。使用顯微鏡上的藍光和綠光通道分別觀察FITC和PI。被Annexin V-FITC結合的細胞顯示漿膜上有綠色光環。喪失細胞膜完整性的細胞,細胞核呈現紅色,膜上有綠色光環。
1.9 統計學方法 采用SPSS 22.0統計學軟件進行數據分析。計量資料以(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 心肌細胞存活率 空白對照組不同時間點細胞存活率比較,差異無統計學意義(P>0.05)。100 μmol/L組、200 μmol/L組、400 μmol/L組不同時間點細胞存活率比較,差異有統計學意義(P<0.05);其中24 h細胞存活率高于12、48 h,差異有統計學意義(P<0.05);12 h及48 h細胞存活率比較,差異無統計學意義(P>0.05)。處理時間12 h:四組細胞存活率比較,差異有統計學意義(P<0.05);空白對照組細胞存活率高于100 μmol/L組、200 μmol/L組及400 μmol/L組,差異有統計學意義(P<0.05);100 μmol/L組細胞存活率與200 μmol/L組比較,差異無統計學意義(P>0.05);100 μmol/L組、200 μmol/L組細胞存活率高于400 μmol/L組,差異有統計學意義(P<0.05)。處理時間24 h:四組細胞存活率比較,差異有統計學意義(P<0.05);空白對照組與200 μmol/L組細胞存活率比較,差異無統計學意義(P>0.05);空白對照組細胞存活率高于100 μmol/L組、400 μmol/L組,差異有統計學意義(P<0.05);100 μmol/L組細胞存活率低于200 μmol/L組,高于400 μmol/L組,差異有統計學意義(P<0.05);200 μmol/L組細胞存活率高于400 μmol/L組,差異有統計學意義(P<0.05)。處理時間48 h:四組細胞存活率比較,差異有統計學意義(P<0.05);空白對照組細胞存活率高于100 μmol/L組、200 μmol/L組及400 μmol/L組,差異有統計學意義(P<0.05);100 μmol/L組細胞存活率低于200 μmol/L組,高于400 μmol/L組,差異有統計學意義(P<0.05);200 μmol/L組細胞存活率高于400 μmol/L組,差異有統計學意義(P<0.05),見表1。
表1 四組不同時間的細胞存活率比較(±s,n=3)Table 1 Comparison of cell survival rates in four groups at three different treatment times
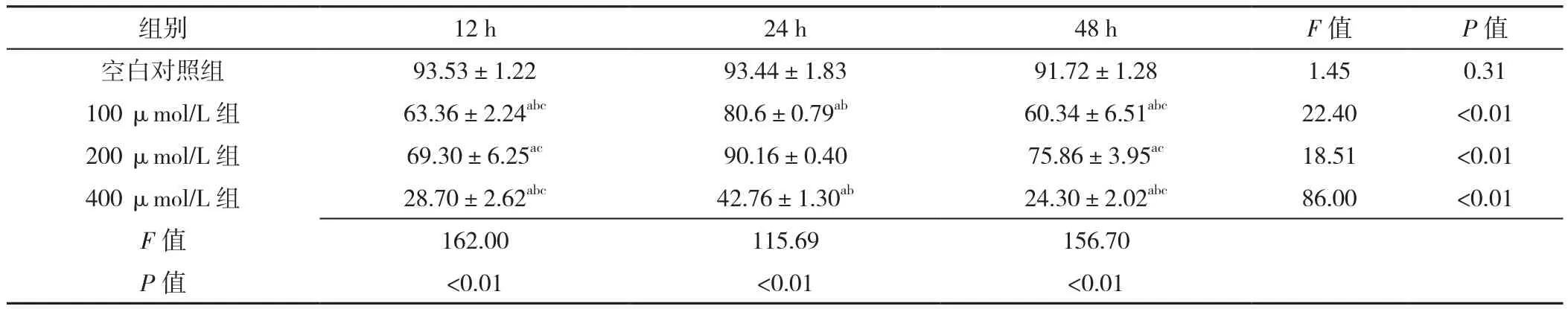
表1 四組不同時間的細胞存活率比較(±s,n=3)Table 1 Comparison of cell survival rates in four groups at three different treatment times
注:與空白對照組比較,aP<0.05;與200 μmol/L組比較,bP<0.05;與處理時間24 h比較,cP<0.05
組別 12 h 24 h 48 h F值 P值空白對照組 93.53±1.22 93.44±1.83 91.72±1.28 1.45 0.31 100 μmol/L 組 63.36±2.24abc 80.6±0.79ab 60.34±6.51abc 22.40 <0.01 200 μmol/L 組 69.30±6.25ac 90.16±0.40 75.86±3.95ac 18.51 <0.01 400 μmol/L 組 28.70±2.62abc 42.76±1.30ab 24.30±2.02abc 86.00 <0.01 F值 162.00 115.69 156.70 P值 <0.01 <0.01 <0.01
2.2 心肌細胞凋亡率 處理時間0 h:四組細胞凋亡率比較,差異有統計學意義(P<0.05);輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組細胞凋亡率高于空白對照組,差異有統計學意義(P<0.05);輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組細胞凋亡率高于單純輻射組,差異有統計學意義(P<0.05);輻射+200 μmol/L精胺組細胞凋亡率低于輻射+100 μmol/L精胺組,差異有統計學意義(P<0.05);處理時間為12 h組、24 h組、48 h組細胞凋亡情況同處理時間為0 h組。空白對照組不同時間點細胞凋亡率比較,差異有統計學意義(P<0.05);其中0 h細胞凋亡率低于12 h、48 h,差異有統計學意義(P<0.05);0 h細胞凋亡率與24 h比較,差異無統計學意義(P>0.05);12 h細胞凋亡率低于24 h,差異有統計學意義(P<0.05);12 h細胞凋亡率與48 h比較,差異無統計學意義(P>0.05);24 h細胞凋亡率低于48 h,差異有統計學意義(P<0.05)。輻射+200 μmol/L精胺組不同時間點細胞凋亡率比較,差異有統計學意義(P<0.05);其中24 h細胞凋亡率低于0 h、12 h和48 h,差異有統計學意義(P<0.05);12 h細胞凋亡率低于0、48 h,差異有統計學意義(P<0.05);24 h細胞凋亡率低于48 h,差異有統計學意義(P<0.05)。輻射+100 μmol/L精胺組不同時間點細胞凋亡率比較,差異有統計學意義(P<0.05);其中24 h細胞凋亡率低于0、48 h,差異有統計學意義(P<0.05);24 h細胞凋亡率與12 h比較,差異無統計學意義(P>0.05);12 h細胞凋亡率低于0、48 h,差異有統計學意義(P<0.05);0 h細胞凋亡率與48 h比較,差異無統計學意義(P>0.05)。單純輻射組不同時間點細胞凋亡率比較,差異有統計學意義(P<0.05);其中0 h細胞凋亡率低于12、24、48 h,差異有統計學意義(P<0.05);12 h細胞凋亡率低于24、48 h,差異有統計學意義(P<0.05);24 h細胞凋亡率低于48 h,差異有統計學意義(P<0.05),見表2。
表2 四組不同時間的細胞凋亡率比較(±s,n=3)Table 2 Comparison of apoptosis rate in four groups at four different treatment times

表2 四組不同時間的細胞凋亡率比較(±s,n=3)Table 2 Comparison of apoptosis rate in four groups at four different treatment times
注:與空白對照組比較,aP<0.05;與單純輻射組比較,bP<0.05;與輻射+100 μmol/L組比較,cP<0.05
組別 0 h 12 h 24 h 48 h F值 P值空白對照組 0.075±0.014 0.116±0.006 0.094±0.009 0.136±0.013 17.44 <0.01輻射 +200 μmol/L 精胺組 0.224±0.003abc 0.160±0.013abc 0.131±0.004abc 0.200±0.025abc 17.44 <0.01輻射 +100 μmol/L 精胺組 0.262±0.022ab 0.187±0.016ab 0.158±0.010ab 0.236±0.027ab 16.37 <0.01單純輻射組 0.187±0.003a 0.312±0.014a 0.362±0.009a 0.425±0.034a 86.42 <0.01 F值 111.03 129.34 603.87 69.26 P值 <0.01 <0.01 <0.01 <0.01
2.3 MDA水平及SOD活性 處理時間為12 h時:四組MDA水平比較,差異有統計學意義(P<0.05);空白對照組MDA水平低于輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組、單純輻射組,差異有統計學意義(P<0.05);單純輻射組MDA水平低于輻射+100 μmol/L精胺組,差異有統計學意義(P<0.05);單純輻射組與輻射+200 μmol/L精胺組MDA水平比較,差異無統計學意義(P>0.05);輻射+100 μmol/L精胺組MDA水平高于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05)。處理時間為24 h時:四組MDA水平比較,差異有統計學意義(P<0.05);空白對照組MDA水平低于輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組、單純輻射組,差異有統計學意義(P<0.05);單純輻射組MDA水平與輻射+100 μmol/L精胺組比較,差異無統計學意義(P>0.05);單純輻射組MDA水平高于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05);輻射+100 μmol/L精胺組MDA水平高于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05)。處理時間為48 h時:四組MDA水平比較,差異有統計學意義(P<0.05);空白對照組MDA水平低于輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組、單純輻射組,差異有統計學意義(P<0.05);單純輻射組MDA水平與輻射+100 μmol/L精胺組比較,差異無統計學意義(P>0.05);單純輻射組MDA水平高于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05);輻射+100 μmol/L精胺組MDA水平高于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05)。
處理時間為12 h時:4組SOD活性比較,差異有統計學意義(P<0.05);空白對照組SOD活性高于輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組、單純輻射組,差異有統計學意義(P<0.05);單純輻射組SOD活性高于輻射+100 μmol/L精胺組,差異有統計學意義(P<0.05);單純輻射組SOD活性高于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05);輻射+100 μmol/L精胺組SOD活性低于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05)。處理時間為24 h時:四組SOD活性比較,差異有統計學意義(P<0.05);空白對照組SOD活性高于輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組、單純輻射組,差異有統計學意義(P<0.05);單純輻射組SOD活性低于輻射+100 μmol/L精胺組、輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05);輻射+100 μmol/L精胺組SOD活性低于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05)。處理時間為48 h時:4組SOD活性比較,差異有統計學意義(P<0.05);空白對照組SOD活性高于輻射+200 μmol/L精胺組、輻射+100 μmol/L精胺組、單純輻射組,差異有統計學意義(P<0.05);單純輻射組SOD活性與輻射+100 μmol/L精胺組比較,差異無統計學意義(P>0.05);單純輻射組SOD活性低于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05);輻射+100 μmol/L精胺組SOD活性低于輻射+200 μmol/L精胺組,差異有統計學意義(P<0.05),見表3。
表3 四組不同時間SOD、MDA比較(±s,n=3)Table 3 Comparison of SOD and MDA levels in four groups at three different treatment times
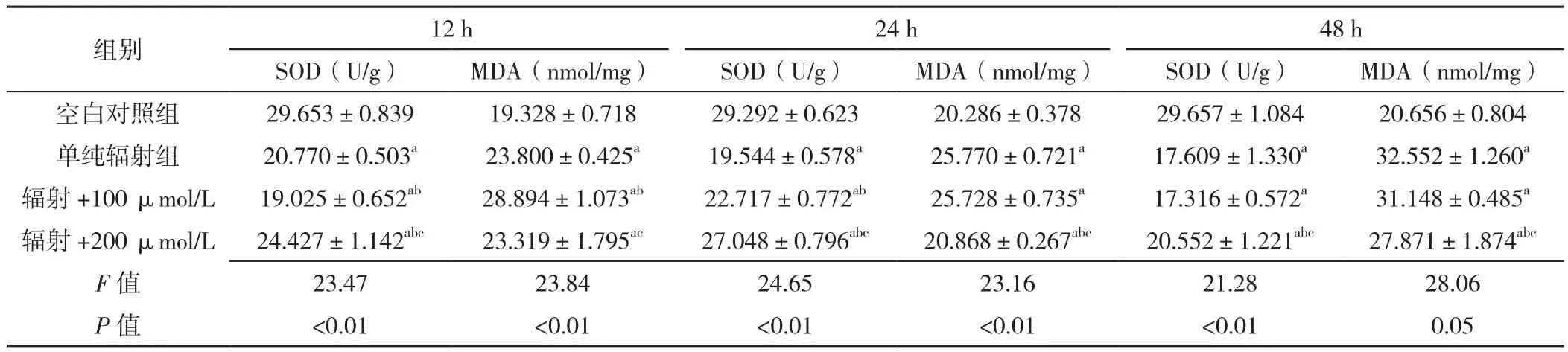
表3 四組不同時間SOD、MDA比較(±s,n=3)Table 3 Comparison of SOD and MDA levels in four groups at three different treatment times
注:SOD=超氧化物歧化酶,MDA=丙二醛;與空白對照組比較,aP<0.05;與單純輻射組比較,bP<0.05;與輻射+100 μmol/L組比較,cP<0.05
組別 12 h 24 h 48 h SOD(U/g) MDA(nmol/mg) SOD(U/g) MDA(nmol/mg) SOD(U/g) MDA(nmol/mg)空白對照組 29.653±0.839 19.328±0.718 29.292±0.623 20.286±0.378 29.657±1.084 20.656±0.804單純輻射組 20.770±0.503a 23.800±0.425a 19.544±0.578a 25.770±0.721a 17.609±1.330a 32.552±1.260a輻射 +100 μmol/L 19.025±0.652ab 28.894±1.073ab 22.717±0.772ab 25.728±0.735a 17.316±0.572a 31.148±0.485a輻射 +200 μmol/L 24.427±1.142abc 23.319±1.795ac 27.048±0.796abc 20.868±0.267abc 20.552±1.221abc 27.871±1.874abc F值 23.47 23.84 24.65 23.16 21.28 28.06 P值 <0.01 <0.01 <0.01 <0.01 <0.01 0.05
2.4 熒光顯微鏡觀察細胞形態的變化 給予X線照射24 h后,空白對照組H9c2心肌細胞形態呈長梭形,細胞核形態完整,染色均勻;B為輻射+200 μmol/L精胺組、C為輻射+100 μmol/L精胺組、D為單純輻射組的H9c2心肌細胞出現不同程度的變化,如細胞形態變圓,細胞核碎裂,染色不均勻等,其中200 μmol/L精胺組的細胞形態最接近空白對照組細胞,變化程度較輕,見圖1。
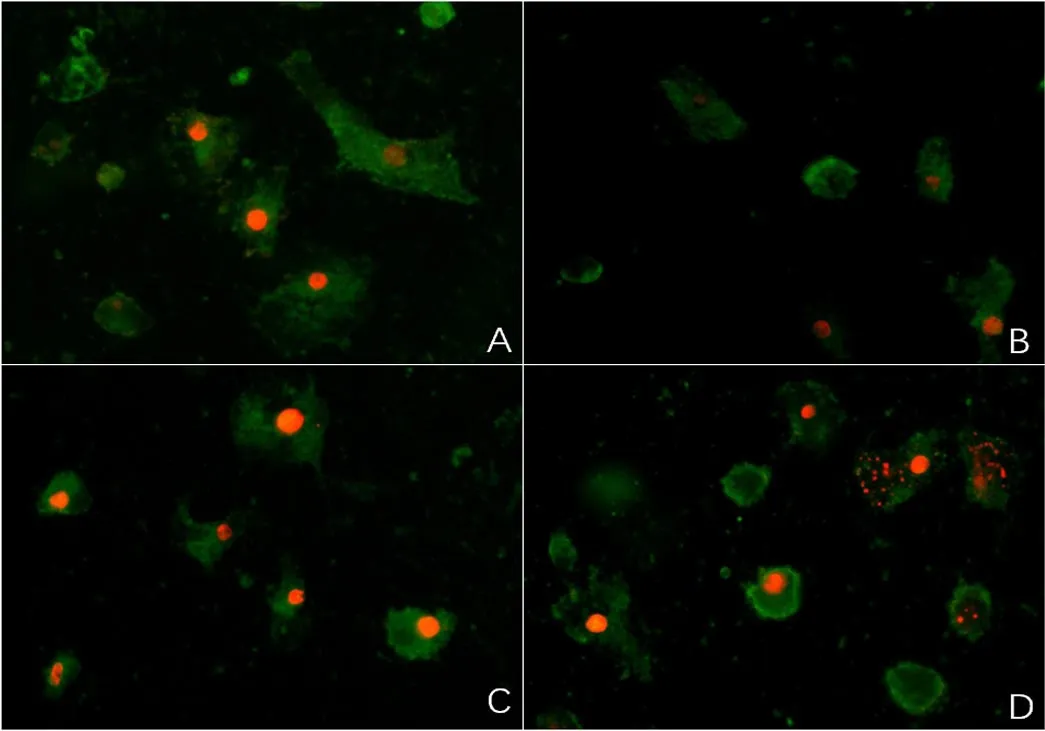
圖1 各組細胞雙染熒光圖(×200)Figure 1 Morphology of cells stained with double immunofluorescence in four groups
3 討論
放射治療被越來越多地應用到惡性腫瘤的治療中,并且成了治療惡性腫瘤的重要方式。但在治療過程中,由于射線沒有精確的選擇性,在通過一系列物理、化學甚至生物過程作用于腫瘤細胞導致其死亡的同時也會對腫瘤周圍正常組織細胞造成損傷甚至凋亡,引起病變周圍、病變以外的器官和組織的放射損傷,產生各種放療并發癥和毒副作用,即靶外放射損傷。惡性腫瘤的治愈率不斷提高,隨著腫瘤患者的遠期生存時間不斷延長,對腫瘤患者的關注由延長患者的生存期向患者的遠期生活質量上傾斜,由放射治療導致的靶外器官的放射損傷開始成為醫學上亟待解決的問題。
精胺(天然多胺的一種)是一類帶高密度正電荷的脂肪族的小分子化合物,主要參與多胺的代謝,具有調控細胞的生長、分化和凋亡的功能,在調節染色質狀態、維持核酸、基因表達和離子通道的穩定性等方面也具有重要作用[5]。精胺普遍存在于人體細胞中,其代謝異常會導致一些細胞的病理變化[6-7],影響多種疾病的演變[8-11]。在活細胞內,外源性精胺可以通過拮抗氧化應激、誘導自噬等途徑保護細胞免受氧化應激損傷[12-15]。放射線作用于心肌細胞可產生大量的自由基[16],從而觸發氧化應激反應[17],導致心肌細胞損傷。有研究表明,外源性精胺可通過降低輻射誘導的DNA-蛋白質交聯產物,來增強對DNA的保護,從而減少輻射給細胞帶來的氧化損傷[18]。也有研究表明,精胺可以減弱P38/JNK等激酶的磷酸化形式表達,從而減少ROS積累和降低氧化應激反應[19],進而減少細胞的凋亡。精胺是否可以保護正常心肌細胞免受或降低輻射所致氧化損傷,目前相關報道甚少。
本研究結果顯示,精胺對心肌細胞具有放射防護作用。對于正常細胞,精胺濃度可影響細胞的代謝過程,對細胞產生不同作用。不同濃度的外源性精胺亦會產生不同的效應,如血管環收縮、內皮細胞損傷、心肌細胞保護或損傷等生理或病理變化[20]。CCK8實驗結果顯示,精胺濃度為200 μmol/L且處理時間為24 h時,心肌細胞的存活率達到90%以上,與空白對照組相比心肌細胞的存活率無明顯差異,可知200 μmol/L是心肌細胞生長的安全藥物濃度。基于精胺濃度200 μmol/L是細胞的安全藥物濃度,100 μmol/L組細胞存活率較空白對照組及200 μmol/L組低,但24 h時也達到了80.6%,而精胺濃度為400 μmol/L時心肌細胞損傷嚴重,12 h及48 h時存活率不到30%,即使在24 h時存活率也僅有42.8%。以上結果說明,不同濃度的外源性精胺對心肌細胞的效應是不同的,而且作用的時間不同效應也不同。因此為探究不同濃度外源性精胺對輻射損傷心肌細胞的作用,在后續試驗中選用精胺藥物濃度為100 μmol/L 和 200 μmol/L。
細胞凋亡是受到嚴格調控的細胞死亡方式,相關研究證實細胞凋亡的異常對心血管疾病的發生具有重要影響[21]。本研究結果顯示,X線照射對于H9c2心肌細胞具有明確的損傷作用,精胺處理細胞后其凋亡率顯著降低,輻射防護作用與濃度及時間有關。濃度為200 μmol/L精胺處理組的細胞凋亡率較100 μmol/L精胺處理組低。不同精胺濃度處理的細胞凋亡率均在24 h達到最低,24 h后細胞凋亡率增高,可能與時間有關。精胺對于輻射損傷的心肌細胞的保護作用可能與其對細胞凋亡機制的影響有關。近年來國內外相關報道提示,精胺可通過上調抗凋亡蛋白B淋巴細胞瘤-2(Bcl-2)基因的表達,下調 Bax、 Caspase-3、Caspase-9等細胞凋亡關鍵酶的表達,來降低各種病理因素導致的心肌細胞的凋亡[22-23],但精胺對輻射所致氧化損傷心肌細胞凋亡的具體機制還有待進一步研究。
自由基和活性氧是電離輻射重要產物,而氧化應激在輻射損傷的發生中起重要作用[24]。MDA是脂質過氧化的主要產物,MDA水平的高低可以反映機體脂質過氧化速率和程度,也能間接反映出細胞過氧化損傷的程度。SOD是機體的抗氧化酶,對機體的氧化和抗氧化平衡起著至關重要的作用,能清除超氧陰離子自由基(O2-)、保護細胞免受損傷。SOD活力高低間接反映了機體清除氧自由基的能力,而MDA水平的高低又間接反映了機體細胞受自由基攻擊的嚴重程度。在本研究中,輻射+200 μmol/L組SOD活力明顯下降,而MDA水平顯著升高,其作用效果可能與精胺能夠抑制自由基的產生、脂質過氧化,提高內源性抗氧化酶的活力,阻止活性氧對細胞膜的損傷,同時提高細胞內鈉鉀泵活力、降低心肌細胞內鈣超載等機制有關[25-26]。
熒光顯微鏡以核碎裂、核濃縮為凋亡特征定性觀察細胞。本研究結果顯示,空白對照組細胞核形態規整,染色均勻;在X線處理24 h時,單純輻射組細胞可見明顯的細胞核濃縮及碎裂、染色質染色不均。200 μmol/L精胺處理后的心肌細胞細胞核形態較規整、部分碎裂,染色較均勻,其細胞形態比100 μmol/L精胺處理組的細胞更接近正常細胞。
綜上所述,精胺對心肌細胞的輻射損傷具有保護作用,其保護作用與藥物作用時間及濃度有關。其保護作用可能與精胺影響細胞凋亡過程、抑制脂質過氧化程度、提高內源性抗氧化酶的活力、減輕活性氧對細胞的損傷等機制相關。
本實驗僅觀察了一定濃度的精胺對輻射致損傷的心肌細胞存在保護作用,但未探究其中具體保護機制,也未對其他正常組織細胞進行觀察,但為對正常細胞的輻射防護提供了新思路,后期將進行進一步探索。
作者貢獻:許超進行論文的構思與設計,文章的可行性分析;杜霄負責文獻/資料收集、數據整理、論文撰寫;涂彧負責論文的修訂,英文的修訂;周菊英負責文章的質量控制及審校,對文章整體負責,監督管理。
本文無利益沖突。

