生物工程角膜移植術后排斥反應的臨床及免疫病理觀察:附5例報告
程 燕,吳 潔,朱海峰,惠 玲,郝 咪
0引言
角膜病是我國主要致盲眼病之一,其中角膜盲占盲人總數的1/4,而感染性角膜炎是角膜盲的主要原因[1-2]。發展中國家每年由角膜感染引起的單眼盲患者約150萬例,主要病原體包括細菌、真菌、病毒和棘阿米巴原蟲[3]。角膜移植仍然是治療感染性角膜炎的最有效的方法,能夠治愈80%以上的角膜炎患者。近年來,因為同種異體角膜供體的缺乏,所以豬來源的生物角膜因在去細胞和去抗原處理后可降低其免疫原性并保留角膜的三維立體結構,具有良好的生物相容性而應用于臨床,解決了部分角膜供體來源缺乏的窘境。然而生物角膜作為異種材料在移植到人眼后是否有免疫排斥反應的發生,免疫排斥反應的臨床表現和病理機制等一系列問題目前較少報道。本研究在此方面進行了探索,對生物工程角膜移植術后排斥反應的臨床表現、體征、激光共焦顯微鏡及免疫組織化學染色等方面進行了一系列的觀察,對生物工程角膜移植排斥發生機制進行初步的探究,為進一步的臨床治療提供依據。
1對象和方法
1.1對象采用回顧性系列病例觀察研究,收集2018-09/2019-12在西安市第一醫院就診并確診為感染性角膜炎患者180例180眼中術后發生免疫排斥患者5例5眼。納入標準:(1) 診斷為感染性角膜炎患者,行生物工程角膜移植手術并發生免疫排斥反應,判斷標準參照Holland評分(表1)[4]方法,以角膜混濁、水腫、新生血管3項評分之和定義為角膜免疫排斥反應指數(rejection index,RI),當RI≥6時即認為發生免疫排斥反應。(2)術前接受規范的抗免疫排斥治療病情無明顯好轉者。(3)角膜植片嚴重混濁或者基質溶解,須行同種異體角膜移植。排除標準:(1)既往原發及繼發干燥綜合征、糖尿病及其他自身免疫性疾病。(2)上皮型、基質型及內皮型等各型病毒性角膜炎。(3)對側眼有角膜炎、青光眼、高度近視等眼部疾病者。本試驗通過西安市第一醫院倫理委員會批準和國家食品藥品監督局(國家藥品監督管理局)醫療器械技術審評中心備案,患者入組前均簽署知情同意書。

表1 角膜移植各項觀察指標評分標準
1.2方法
1.2.1手術步驟手術均由同一位經驗豐富的醫師完成。術眼使用2%的布比卡因和0.75%的利多卡因1∶1混合劑行球后麻醉,置開瞼器,固定上、下直肌,用妥布霉素稀釋液充分沖洗結膜囊,根據病灶直徑選擇合適的角膜環鉆制作角膜植床,用手術刀片逐層剖切病變角膜,至病灶完全清除,選擇與病灶角膜直徑等大的環鉆制作植片,采用10-0尼龍線將生物工程角膜植片間斷對位縫合于角膜植床,線結轉埋。
1.2.2術后治療所有患者均在術后1、3、6、9、12mo進行隨訪觀察。參照Holland評分方法,以角膜混濁、水腫、新生血管3項評分之和定義為免疫排斥反應指數(rejection index,RI),當RI≥6時即認為發生免疫排斥反應,應用1%醋酸潑尼松龍滴眼液、0.1%他克莫司滴眼液、0.1%玻璃酸鈉滴眼液點眼,均每日4次,妥布霉素地塞米松眼膏睡前點眼1次,給予靜脈滴注地塞米松10mg并逐漸減量治療。觀察2wk患者病情無緩解,再行同種異體穿透角膜移植手術,并對生物工程角膜組織進行免疫病理檢查。RI≤6患者給予1%醋酸潑尼松龍滴眼液、0.1%他克莫司滴眼液、0.1%玻璃酸鈉滴眼液點眼,均每日3次,角膜植片逐漸透明。
1.2.3激光共焦顯微鏡檢查應用HRT3激光共焦顯微鏡(分辨率為1μm,放大倍數為800倍)對所有生物工程角膜移植術后出現免疫排斥反應患者術眼及對側眼進行檢查,應用0.4%鹽酸奧布卡因滴眼液點眼2次進行表面麻醉,囑咐患者下頜放于顯微鏡托架上,保持頭正位,移動手柄,使角膜接觸帽定位在受檢者角膜中央部位,調節成像焦點平面,使角膜各層圖像通過計算機屏幕同步顯示,采集各層角膜圖片并保存。利用NAVIS軟件對角膜各層細胞形態、組織結構進行綜合分析,尤其是角膜上皮下朗格罕氏細胞的活化程度[又名樹突狀細胞(dendritic cells,DCs),靜止期形態為短棒狀,活化期有明顯突起]和基質層內炎癥細胞(表現為圓形或橢圓形細胞,體積較角膜基質細胞略小)密度。
1.2.4免疫組織化學染色及HE染色實驗石蠟切片免疫組化染色采用S-P法。以正常羊血清孵育替代一抗孵育,作為陰性對照;以PBS孵育替代一抗孵育,作為空白對照。采用Olympus-BX43光學顯微鏡觀察并攝片。試劑:CD4、CD8單克隆抗體(即用型),即用型免疫組化UltraSensitiveTMplus廣譜試劑盒,抗原修復液(EDTA法),正常羊血清,DAB顯色液。以上試劑均購自福州邁新生物技術開發有限公司。HE染色步驟如下:脫蠟,脫蠟二甲苯Ⅰ、Ⅱ各10min,事先準備好蓋玻片;覆水,100%(Ⅰ、Ⅱ)、90%、80%、70%酒精各5min,自來水沖洗5min×3;蘇木精染色5min,流水沖洗;5%乙酸分化1min,流水沖洗,用吸管滴加乙酸,布滿玻片上的組織即可,分化后顏色變淺了一些,成為藍色;伊紅染色1min,流水沖洗;脫水:70%、80%、90%、100%酒精各10s,二甲苯1min,可以在通風櫥自然晾干再封片,約5min;滴上中性樹膠,封片,用吸管滴上一滴即可,盡量少滴,但壓片后要將組織全部覆蓋完,避免中間有氣泡。
統計學分析:采用SPSS17.0統計學軟件進行統計分析。術眼與對側眼出現角膜上皮下活化的朗格罕氏細胞比例的比較采用卡方檢驗。角膜基質中炎細胞密度術眼與對側眼比較采用配對樣本t檢驗,以P<0.05為差異有統計學意義。
2結果
2.1納入患者一般資料情況本研究共收集生物工程角膜移植術后患者180眼,其中發生免疫排斥反應患者5眼,免疫排斥反應發生率為2.8%。其中男4例,女1例,年齡45~61歲。5眼中細菌性角膜炎2眼(1眼因角膜異物導致細菌性角膜炎,1眼為眼部堿燒傷后繼發細菌性角膜炎);真菌性角膜炎3眼。
2.2裂隙燈及激光共焦顯微鏡檢查病例1,男,61歲,術前BCVA:數指/40cm,臨床診斷為右眼細菌性角膜炎,行生物工程角膜板層移植術,術后6mo角膜植片高度水腫,可見角膜上皮缺損,鼻側新生血管長入,RI評分12分;激光共焦顯微鏡檢查顯示上皮下及淺基質層存在大量活化的朗格罕氏細胞(具有短樹突或長樹突的細胞),基質層可見大量圓形高反光的炎癥細胞,見圖1。病例2,女,50歲,術前BCVA:手動/30cm,右眼真菌性角膜炎,角膜移植術后5mo發生免疫排斥反應,RI評分10分;激光共焦顯微鏡檢查顯示淺基質層活化的朗格罕氏細胞及炎癥細胞。病例3,男,45歲,術前BCVA:數指/50cm,右眼堿燒傷繼發細菌性角膜炎,角膜移植術后9mo發生免疫排斥反應,RI評分9分;激光共焦顯微鏡檢查亦可見活化的朗格罕氏細胞和炎癥細胞。病例4,男,56歲,術前BCVA:手動/20cm,左眼真菌性角膜炎,術后6mo發生排斥反應,RI評分9分;角膜基質層可見朗格罕氏細胞和炎癥細胞。病例5,男,53歲,術前BCVA:0.1,左眼真菌性角膜炎,術后7mo發生免疫排斥反應,RI評分10分;激光共焦顯微鏡可見朗格罕氏細胞和炎細胞,見圖2。
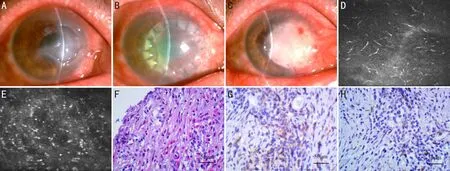
圖1 病例1術眼前節和激光共焦顯微鏡照片及免疫病理圖片 A~C:眼前節照片;D、E:激光共焦顯微鏡照片;F:HE染色;G、H:S-P染色。
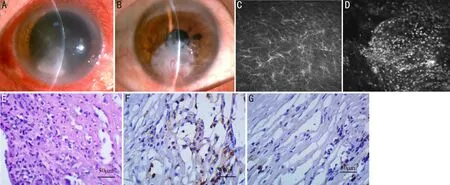
圖2 病例5術眼前節和激光共焦顯微鏡照片及免疫病理圖片 A、B:眼前節照片;C、D:激光共焦顯微鏡照片;E:HE染色;F、G:S-P染色。
術眼的RI為9~12(平均10±1.1)分。激光共焦顯微鏡檢查顯示術眼角膜上皮下可見活化郎格罕氏細胞,其活化比例74.2%,與對側眼15.2%比較差異有統計學意義(χ2=38.29,P<0.001)。基質層大量炎癥細胞1641±160/mm2,與對側眼78±23/mm2比較差異有統計學意義(t=32.5,P<0.05)。
2.3免疫病理檢查結果病例1在角膜全層HE染色均可見炎癥細胞及嗜酸性粒細胞(圖1F),在角膜基質深層及淺層均可見CD4+細胞的表達(圖1G),同樣可見CD8+細胞的表達(圖1H)。病例2、3、4及5的患者HE染色角膜基質全層可見炎癥細胞,未見嗜酸性粒細胞,在角膜基質層可見CD4+細胞的表達,亦可見CD8+細胞的表達,病例5免疫病理圖片見圖2。
3討論
目前臨床主要應用的生物工程角膜是豬角膜脫細胞基質,這是一種基于細胞組織工程學的角膜替代材料,在同種異體角膜供體材料缺乏的今天,在一定程度上緩解了角膜供體匱乏的局面,為臨床感染性角膜患者保留了眼球,并恢復部分患者視力。然而即使是脫細胞的角膜基質降低了移植術后的免疫排斥反應[5-7],我們在臨床應用中仍可見免疫排斥反應的發生。本研究收集我院生物工程角膜移植術后發生免疫排斥反應患者作為研究對象,對其進行裂隙燈檢查、激光共焦顯微鏡和免疫組織病理研究,以期從臨床體征、活體細胞觀察、免疫病理等方面深入揭示生物工程角膜移植免疫排斥反應發生的機制,為臨床治療提供依據,提高手術的成功率。
本研究發現生物工程角膜移植術后免疫排斥反應表現為角膜植片的水腫、混濁、新生血管的長入,早期還存在角膜上皮缺損。如果此時未能得到及時診治,角膜植片的溶解和混濁加重,會嚴重影響患者術后視力。同時,角膜植片溶解進展的后果是嚴重的,可能會發生角膜穿孔等并發癥。因此,對于行生物工程角膜移植術的患者需要更加嚴密的隨訪與觀察。另外,除了術后糖皮質激素和免疫抑制劑的應用外,術前對生物工程角膜移植適應證的選擇、術中植床植片的對合良好及術后及時拆除縫線等對預防術后免疫排斥反應亦是至關重要的影響因素。術前患者角膜潰瘍直徑較大、潰瘍偏位、潰瘍深度達到角膜厚度的1/2以上、瞼板腺功能障礙及瞼緣炎等均會導致術后免疫排斥反應率增加。根據生物工程角膜移植術后免疫排斥反應機制的觀察及研究,治療仍以糖皮質激素及免疫抑制劑等藥物治療為主[8],若進行性進展,則須再次行同種異體角膜移植手術。
激光共焦顯微鏡是一種高分辨率、高放大倍數并且無創的顯微鏡,為我們進一步了解生物工程角膜移植術后免疫排斥反應發生時角膜的細胞形態和結構變化的動態評估提供了重要的工具[9]。本研究對患眼的共焦顯微鏡檢查發現,角膜上皮下及基質層可見大量活化的朗格罕氏細胞及炎癥細胞,這點與同種異體角膜移植排斥相同[10],推測是由于細胞免疫在角膜移植免疫排斥反應中的作用,多種細胞參與其中,如輔助性T細胞、細胞毒性T細胞及巨噬細胞等重要的免疫活性細胞和效應細胞。同樣在生物工程角膜移植術后免疫排斥反應中,角膜上皮下及基質層活化的樹突狀細胞仍然是重要的抗原呈遞細胞,能夠介導細胞免疫的發生。DCs是目前已知的功能最強的抗原呈遞細胞,也是活化初始T細胞最有效的細胞,未成熟的DCs刺激初始T細胞活化的能力很弱,但成熟的DCs能有效刺激活化初始T細胞,對免疫反應進行啟動、調控及應答[8]。
為進一步證實在共焦顯微鏡下炎癥細胞的性質,我們對所有患者再次手術時取下的生物工程角膜組織進行免疫組化和HE染色,研究發現所有生物工程角膜移植術后排斥反應患者角膜基質淺層、深層及全層均有不同程度的CD4+細胞和CD8+細胞的表達,由此推斷細胞免疫參與生物工程角膜移植術后免疫排斥反應,多種細胞因子介導下的CD4+細胞引起的遲發型超敏反應和CD8+細胞所致的細胞毒作用會對移植片造成組織損傷。這與以往文獻報道的生物工程角膜移植動物試驗中結果一致[11]。另外,在我們的研究中有1眼角膜組織經HE染色后發現了大量的嗜酸性粒細胞。嗜酸性粒細胞是淋巴細胞活化因子RANTES與IL-16的主要來源,通過上調黏附分子的表面表達增強跨內皮移動,從而刺激細胞脫顆粒,進而參與免疫反應;同時,RANTES與IL-16對淋巴細胞、單核細胞、嗜酸性粒細胞有很強的趨化作用,會進一步加重組織的炎癥和損傷[12]。在生物工程角膜移植免疫排斥中發現的大量嗜酸性粒細胞,可能是因為異種抗原移植而誘發的超敏反應,進一步機制有待探索和研究。
生物工程角膜應用于板層角膜移植治療感染性角膜炎,不僅可以有效控制感染,提高患者視力,而且其免疫排斥反應與同種異體人角膜移植機制類似,但術后糖皮質激素和免疫抑制劑等藥物的應用對于減少免疫排斥反應仍屬必要。生物工程角膜移植術后的免疫排斥反應需要從圍手術期的各環節進行防控,以保證生物工程角膜植片良好的透明性恢復角膜視覺功能。生物工程角膜有效緩解了角膜供體來源不足的現狀。

