TNFSF13B基因與腎透明細胞癌預后及腫瘤微環境的關系
鄭浩然,蔣愛民,劉 娜,傅 瀟,姚 煜
(西安交通大學第一附屬醫院腫瘤內科,陜西西安 710061)
在世界范圍內,腎癌約占成人惡性腫瘤的2%~3%,其最常見的病理類型為腎透明細胞癌(renal clear cell carcinoma,RCCC),約占腎癌病理分型的75%[1]。RCCC預后差,早期診斷困難,20%的患者初診時已經出現轉移,晚期患者5年生存率小于10%[2]。因此,找到RCCC早期診斷及預后相關的生物標志物至關重要。以培唑帕尼、舒尼替尼等為代表的靶向治療是晚期RCCC的傳統一線治療。近年來,免疫治療的出現在晚期RCCC的治療中具有里程碑式意義[3],腫瘤微環境(tumor microenvironment,TME)也成為當下的研究熱點。本研究基于TCGA數據庫,通過生物信息學方法找到與RCCC腫瘤微環境相關的差異表達基因TNFSF13B,進一步驗證了其在RCCC中的表達、對RCCC預后的影響及其與RCCC腫瘤微環境成分的關系,為RCCC的發病機制、早期診斷、綜合治療及預后評價提供了新思路。
1 資料與方法
1.1 數據來源605例RCCC病例(正常樣品72例,腫瘤樣品533例)的轉錄組RNA-seq數據和相應的臨床數據均從TCGA數據庫(https:∥portal.gdc.cancer.gov/)下載。
1.2 ESTIMATE評分、免疫評分和基質評分的計算
使用R語言estimate包中的ESTIMATE算法估計腫瘤微環境中免疫成分和基質成分的比率,以3種得分的形式展現:免疫評分(immune score)、基質評分(stromal score)和ESTIMATE評分。其分別與免疫成分、基質成分和兩者之和呈正相關。得分越高,TME中相應成分的比率越大[4]。
1.3 生存分析及臨床相關性分析使用R語言survminer包進行生存分析,生存曲線通過Kaplan-Meier法繪制,采用對數秩和檢驗,以P<0.05差異有統計學意義。使用Wilcoxon秩和檢驗或Kruskal-Wallis秩和檢驗進行臨床相關性分析,P<0.05為差異有統計學意義。
1.4 在免疫評分和基質評分的高分組和低分組之間生成差異表達基因根據免疫評分和基質評分的中位數將腫瘤樣本分為高分組和低分組。通過R語言limma包對高分組之間和低分組之間分別進行分析,篩選出差異表達基因(differently expressed genes,DEGs)[5]。以|log2FC|>1和錯誤發現率(FDR)<0.05作為DEGs的截斷標準。
1.5 GO和KEGG富集分析通過R語言clusterProfiler、enrichplot、ggplot2軟件包對篩選出的93個DEGs進行基因本體(gene ontology,GO)分析及京都基因和基因組百科全書(kyoto encyclopedia of genes and genomes,KEGG)分析,以P值和q值均小于0.05為顯著性富集。
1.6 識別核心基因首先,采用STRING(https:∥string-db.org/)數據庫對DEGs進行蛋白質-蛋白質相互作用網絡(protein-protein interaction,PPI)構建[6]。隨后,運用Cytoscape 3.8.0(http:∥www.cytoscape.org/)[7]中的cytohubba插件對PPI網絡進行重構,采用交互關系置信度大于0.95的節點構建網絡。其次,通過R語言survival包進行單因素Cox回歸分析,分析結果在森林圖中顯示。最后,對PPI網絡及單因素Cox回歸分析中發現的DEGs繪制韋恩圖以獲得核心基因。
1.7 GSEA富集分析從Molecular Signatures(https:∥www.gsea-msigdb.org/gsea/msigdb/index.jsp)數據庫下載Hallmark和C7(免疫相關通路)數據集作為目標集,進行GSEA富集分析[8]。用所有腫瘤標本的全部轉錄組數據進行GSEA富集分析,只有當NOMP<0.05且FDRq<0.06時即為顯著性富集。
1.8 腫瘤浸潤性免疫細胞譜及其相關性分析通過R語言CIBERSORT算法估算所有腫瘤樣本中腫瘤浸潤性免疫細胞的豐度分布。隨后進行免疫細胞間相關性分析、免疫細胞與基因表達水平差異性和相關性分析。
1.9 HPA數據庫運用HPA數據庫(https:∥www.proteinatlas.org/)初步驗證基因在RCCC和正常組織中的蛋白質表達情況。
2 結 果
2.1 高免疫評分與RCCC患者不良預后及淋巴結轉移相關除了腫瘤細胞外,TME主要由免疫細胞和基質細胞等成分組成,在腫瘤的發生、發展過程中產生重要作用[9]。基質細胞已被證實在腫瘤的血管生成和基質重塑方面發揮重要作用[10]。而TME中不同種類的免疫細胞在抗腫瘤和促腫瘤方面發揮不同作用。越來越多的研究表明,TME中腫瘤浸潤性免疫細胞水平可能作為療效預測的指標[11]。本研究從TCGA數據庫下載RCCC患者的基因表達譜數據,通過ESTIMATE算法計算免疫評分、基質評分和ESTIMATE評分,進而估計免疫細胞和基質細胞在RCCC微環境中所占的比例。對三種評分分別進行Kaplan-Meier生存分析以建立TME中免疫和基質比例與患者生存的相關性(圖1)。結果表明,免疫評分高與RCCC患者預后不良相關(P=0.033,圖1B)。然而,ESTIMATE評分和基質評分與患者預后無相關性(圖1A和圖1C)。隨后,我們研究了3種評分與RCCC主要臨床病理特征的關系(圖2),結果顯示,免疫評分高與RCCC淋巴結轉移顯著相關(P=0.021,圖2G)。
2.2 基于免疫評分和基質評分篩選DEGs并進行GO和KEGG富集分析將RCCC樣本根據免疫評分和基質評分的中位數分為高分組和低分組,構建基因表達譜熱圖(圖3A、C),進而篩選出DEGs。結果表明,兩組之間有44個上調的DEGs和49個下調的DEGs(圖3B、D)。隨后,我們對這些DEGs進行了GO和KEGG富集分析,以研究這些DEGs最常見的生物學過程和途徑。GO富集分析結果表明,這些DEGs主要參與B細胞增殖、體液免疫應答、白細胞增殖、淋巴細胞增殖和單核細胞增殖(圖3E)。KEGG富集分析結果表明,這些DEGs主要在細胞因子-細胞因子-受體相互作用、造血細胞系、原發性免疫缺陷、酮體的合成和降解等通路富集(圖3F)。
2.3 通過PPI網絡和單因素Cox回歸分析確定核心基因我們對DEGs進行PPI網絡構建和單因素Cox回歸分析,以確定RCCC中潛在的與預后相關的核心基因。圖4A顯示了前52個基因之間的蛋白質相互作用,圖4B用條形圖表示按節點數排列的前30個基因。單因素Cox回歸分析結果表明,23個DEGs與RCCC的預后相關(圖4C)。最后,我們選擇PPI網絡中的前20個基因與單因素Cox回歸分析篩選出的23個基因并繪制韋恩圖,從而確定核心基因。結果表明,只有IGLL5和TNFSF13B重疊(圖4D)。
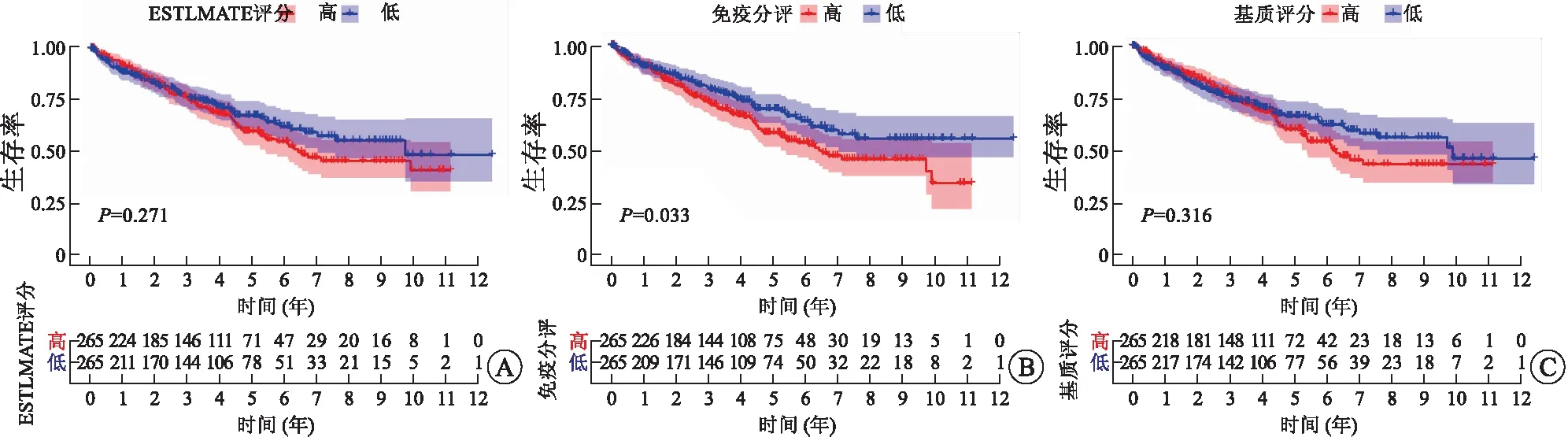
A:ESTIMATE評分;B:免疫評分;C:基質評分。
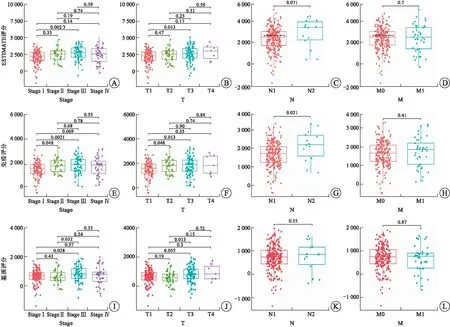
A~D:ESTIMATE評分;E~H:免疫評分;I~L:基質評分。
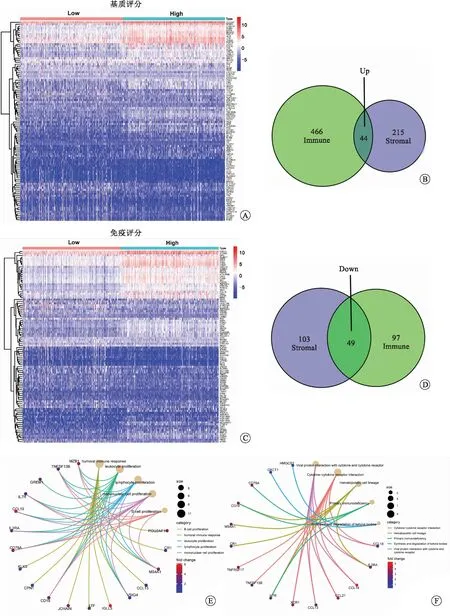
A:基質評分DEGs熱圖;B:免疫評分DEGs熱圖;C:免疫評分和基質評分共有上調DEGs的韋恩圖;D:免疫評分和基質評分共有下調DEGs的韋恩圖;E:DEGs的GO富集分析;F:DEGs的KEGG富集分析。
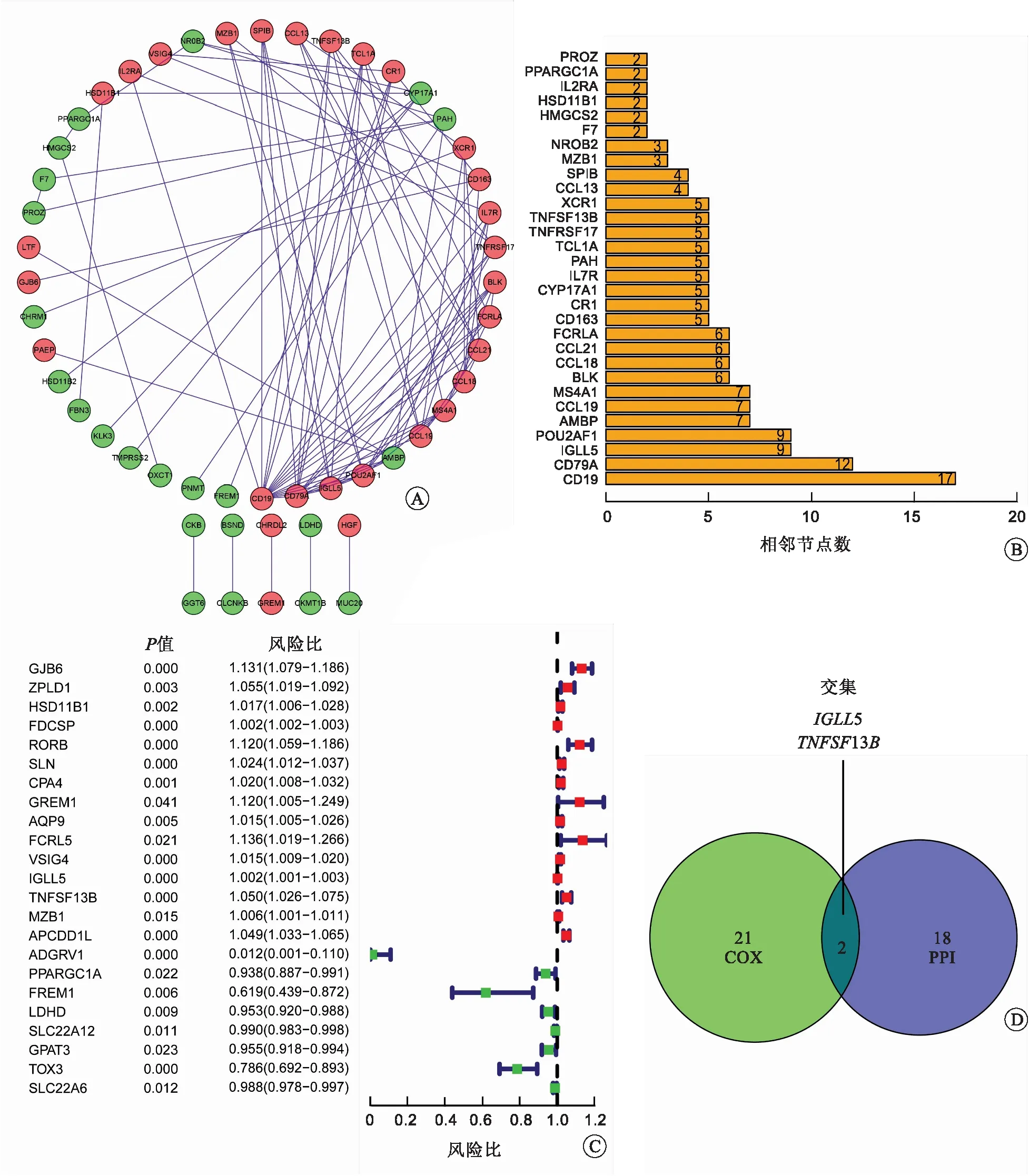
A:PPI網絡;B:按節點數排列的前30個基因;C:DEGs的單因素Cox回歸分析;D:PPI網絡中前20個基因和單因素Cox回歸分析共有基因的韋恩圖。
2.4TNFSF13B的表達與RCCC預后、N分期及TME相關TNFSF13B又稱B細胞激活因子(BAFF),在B細胞生存、增殖、向漿細胞分化等方面發揮關鍵作用[12]。作為免疫相關基因,我們進一步研究了TNSF13B表達與RCCC預后、臨床病理特征和TME的關系。結果表明TNFSF13B在RCCC腫瘤組織中的表達顯著升高(圖5A、B)。通過HPA數據庫初步驗證TNFSF13B蛋白在RCCC組織中的表達高于正常組織(圖8D)。生存分析結果表明TNFSF13B高表達與RCCC患者更短的總體生存率(OS)顯著相關(圖5C,P<0.001)。此外,我們還發現TNFSF13B的高表達與RCCC淋巴結轉移相關(圖5F)。隨后,對C7基因集(免疫相關通路)的GSEA富集分析結果顯示,TNFSF13B的高表達主要在抗原的處理和提呈、趨化因子信號通路、細胞因子-細胞因子-受體相互作用和自然殺傷細胞介導的毒性等通路富集(圖6A)。此外,對Hallmark基因集的GSEA富集分析結果表明,在TNFSF13B高表達組中,多個免疫通路相關基因集,如移植物排斥反應、細胞凋亡、補體、IL2-STAT5信號通路和IL6-JAK-STAT3信號通路等顯著富集(圖6B)。這表明,TNFSF13B與RCCC免疫微環境存在一定的相關性。
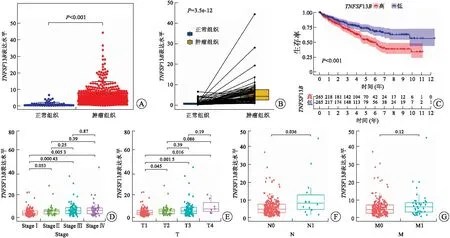
A:TNFSF13B在RCCC腫瘤組織和正常組織中的表達;B:同一患者來源的正常組織和腫瘤組織中TNFSF13B表達的配對差異性分析;C:不同TNFSF13B表達RCCC患者的生存分析;D~G:TNFSF13B表達與RCCC患者臨床病理特征的相關性。
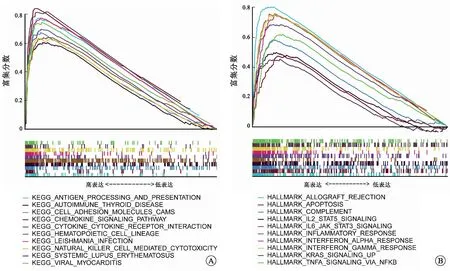
A:TNFSF13B高表達樣本中C7基因集的GSEA富集分析;B:TNFSF13B高表達樣本中Hallmark基因集的GSEA富集分析。
2.5TNFSF13B表達與腫瘤浸潤性免疫細胞的相關性為了進一步證實TNFSF13B表達與RCCC免疫微環境的相關性,我們采用CIBERSORT算法分析了RCCC腫瘤浸潤免疫細胞亞群的豐度分布(圖7A),構建了RCCC樣本的21種免疫細胞相關性圖譜(圖7B)。我們進一步繪制了免疫細胞浸潤水平相對于TNFSF13B表達水平差異性的小提琴圖(圖8A)和免疫細胞浸潤水平與TNFSF13B表達水平相關性的散點圖(圖8B)。差異性和相關性分析結果表明,共11種腫瘤浸潤免疫細胞與TNFSF13B表達相關(圖8C)。其中未成熟B細胞、靜息CD4+記憶T細胞、活躍樹突狀細胞、靜息肥大細胞與TNFSF13B表達呈負相關。CD8+T細胞、活躍的CD4+記憶T細胞、Tfh細胞、Treg細胞、γδT細胞、靜息的NK細胞、嗜酸性粒細胞與TNFSF13B表達呈正相關。這些結果進一步證實TNFSF13B表達會對RCCC腫瘤免疫微環境產生一定影響。
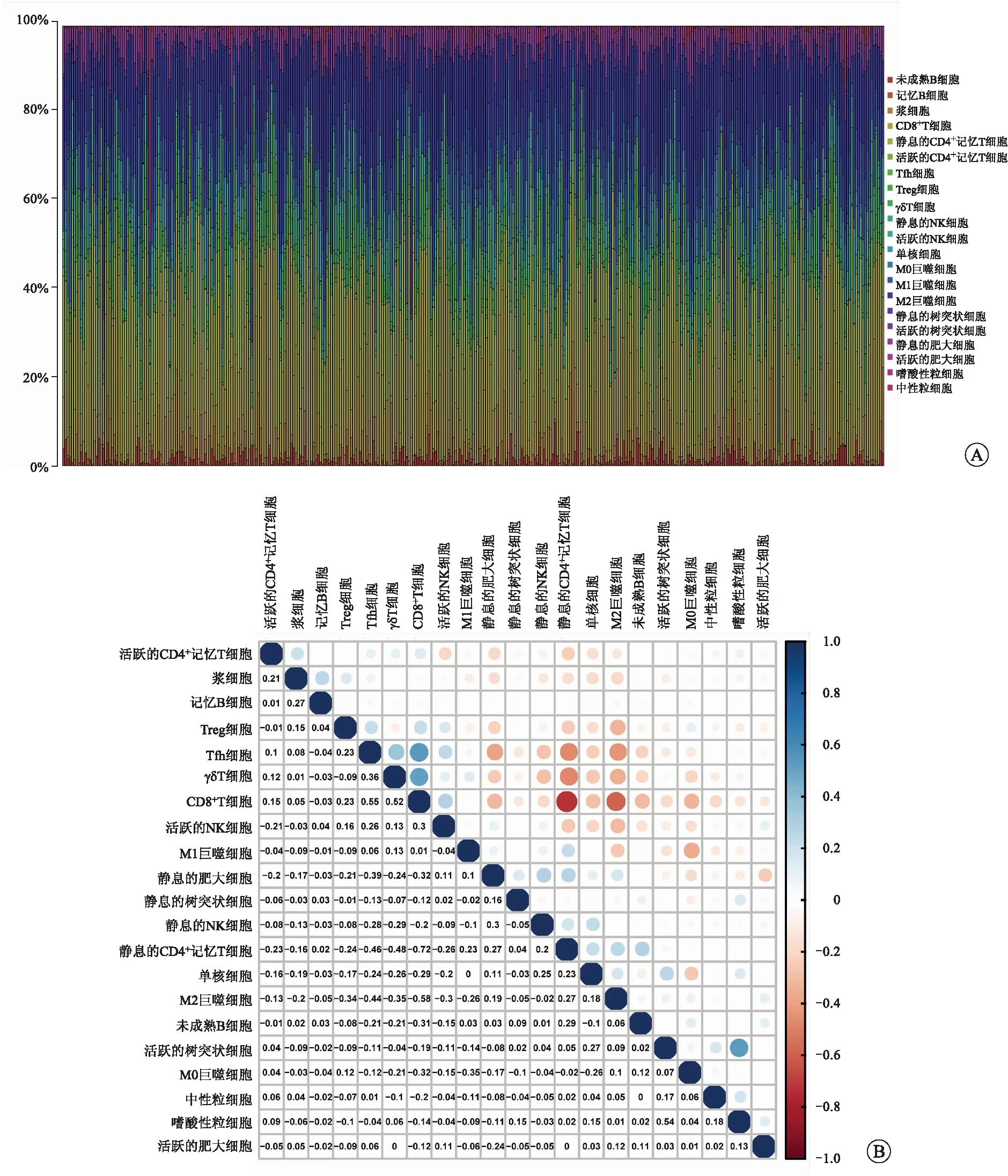
A:RCCC樣本中21種腫瘤浸潤性免疫細胞比例;B:RCCC樣本中21種腫瘤浸潤性免疫細胞的相關性。

A:RCCC中21種腫瘤浸潤性免疫細胞比例相對于TNFSF13B表達水平差異性分析的小提琴圖;B:RCCC中15種腫瘤浸潤性免疫細胞與TNFSF13B表達水平相關性的散點圖;C:差異性分析和相關性分析共有的腫瘤浸潤性免疫細胞韋恩圖;D:TNFSF13B蛋白在RCCC腫瘤組織和正常組織中的表達。
3 討 論
大量研究表明RCCC是免疫原性惡性腫瘤,TME中存在大量浸潤性免疫細胞,如CD8+T細胞、CD4+T細胞、巨噬細胞、NK細胞、髓樣細胞(myeloid-derived suppressor cells,MDSCs)等[13]。然而,CD8+T細胞和CD4+T細胞的大量浸潤卻與RCCC的高分級和生存期縮短相關。研究表明,CD8+T細胞的高增殖率與RCCC患者生存期延長相關,這表明免疫細胞的功能狀態是決定其抗腫瘤活性的關鍵因素。RCCC中腫瘤浸潤性淋巴細胞無法發揮抗腫瘤功能可能是與Treg細胞、MDSCs等免疫抑制性細胞的大量浸潤相關[14]。RCCC的免疫抑制狀態可以通過應用靶向免疫檢查點抑制劑的負向調節作用打破,恢復抗腫瘤免疫反應。RCCC中30%的患者存在PD-L1的過表達[15],TME中亦經常發現PD-1陽性的巨噬細胞、MDSCs和NK細胞。巨噬細胞中PD-1的表達與M2型巨噬細胞的極化以及IL-6的產生增加相關,從而導致免疫抑制及腫瘤進展[16]。免疫檢查點抑制劑在RCCC的治療過程中顯示出良好的療效,目前,免疫治療以及免疫治療聯合靶向治療已經成為晚期RCCC患者的標準治療模式。盡管如此,部分RCCC患者對免疫治療響應差,找到能夠影響RCCC腫瘤微環境及預測免疫治療療效的生物標志物至關重要。
本研究基于TCGA數據庫發掘出的與RCCC患者預后及TME相關的關鍵基因TNFSF13B又稱B細胞激活因子(B cell activating factor,BAFF),是腫瘤壞死因子(tumor necrosis factor,TNF)家族成員之一,在B細胞增殖分化過程中發揮重要作用。血液中可溶性BAFF的升高與系統性紅斑狼瘡等自身免疫性疾病的發生密切相關[17]。自發現以來,BAFF在腫瘤發生發展過程中的作用一直是研究的熱點。由于BAFF在維持B細胞和漿細胞的存活方面發揮重要作用,血清中BAFF水平的升高與多發性骨髓瘤和B淋巴細胞惡性腫瘤患者不良預后相關[18-19]。目前,美國食品藥品監督管理局(food and drug administration,FDA)批準的抗BAFF抗體貝利木單抗(Belimumab)只適用于系統性紅斑狼瘡的治療,其在B細胞淋巴瘤的療效仍在臨床試驗過程中[20]。在實體瘤中,已有研究表明,胰腺癌、腎癌及神經內分泌癌等腫瘤中TNFSF13B表達升高,且與患者不良預后相關[21-23]。RIHACEK等[24]的研究表明BAFF可能通過促進炎癥反應及胰島素抵抗導致癌癥患者晚期惡病質的出現。最近,YARCHOAN等[25]的研究表明,BAFF在TME中發揮雙重作用:既可以增強B細胞對CD4+Th細胞的抗原提呈能力,增強TME中Th1細胞的抗腫瘤活性,又能夠導致TME中Treg細胞的增加,從而介導腫瘤免疫逃逸。我們的研究發現Treg細胞浸潤水平與TNFSF13B表達呈正相關,這說明TNFSF13B高表達可能與RCCC免疫逃逸及免疫抑制狀態相關。CD8+T細胞、活躍的CD4+記憶T細胞等抗腫瘤免疫細胞水平雖然與TNFSF13B表達呈正相關,但其功能可能處于抑制狀態,無法發揮抗腫瘤效應。TNFSF13B對RCCC腫瘤微環境影響的具體機制仍有待于更詳細、更具體的體內外研究的進一步開展。
綜上所述,TNFSF13B基因高表達與RCCC患者的不良預后顯著相關,并對RCCC腫瘤微環境產生一定影響。本研究基于公共數據庫進行研究,存在一定的局限性,如樣本量較小、未通過真實世界進行驗證等。但本研究找到了與RCCC預后及TME相關的關鍵基因,為RCCC的發病機制、早期診斷、預后評估及治療策略提供了一定的依據,為新型藥品的研發及RCCC基礎與臨床試驗提供了新思路。TNFSF13B有望成為RCCC新的潛在治療靶點和預后相關的生物學標志物。

