舒尼替尼治療晚期腎癌的預后因素分析及國際轉移性腎細胞癌數據庫聯盟預后模型驗證
周饒饒,戚聶聶,趙方正 ,李子祥,王詩驛,邱 冬,王軍起 ,朱海濤
(1.徐州醫科大學研究生院,江蘇徐州 221000;2.徐州醫科大學附屬醫院泌尿外科,江蘇徐州 221002)
腎細胞癌(renal cell carcinoma,RCC)起源于腎實質泌尿小管上皮系統,泌尿生殖系統常見惡性腫瘤之一。我國2015年新增腎癌病例約6.68萬,死亡約2.34萬,且腎癌新增病例呈逐年遞增趨勢[1-2]。早期腎癌以手術治療為主,轉移性腎癌對傳統放化療及非特異性免疫治療均不敏感,隨著對腎癌發病機制的進一步研究發現,酪氨酸激酶抑制劑能夠明顯提高晚期腎癌患者的無進展生存期(progression free survival,PFS)和總生存期(overall survival,OS)[3]。無論采用何種治療方式,人們都希望找到能夠預測治療效果的預后因素,從而實現精準醫學的發展。影響腎癌預后的因素很多,且會隨著治療方式的變化而改變,需不斷探索更新。將預測效能強的單因素聯合起來建立預后模型,可提高預測效能,國際轉移性腎細胞癌數據庫聯盟(International Metastatic Renal-Cell Carcinoma Database Consortium,IMDC)腎癌預后模型[4]即是通過聯合6個預后因素形成的預測系統。本研究通過隨訪收集服用舒尼替尼治療晚期腎癌患者的臨床資料,探索影響預后的因素,并進一步對IMDC腎癌預后模型準確性進行驗證。
1 資料與方法
1.1 臨床資料回顧性收集2017年5月至2020年8月期間徐州醫科大學附屬醫院泌尿外科115例服用舒尼替尼治療的晚期腎癌患者的臨床資料,其中男80例(69.6%),女35例(30.4%);中位年齡60(28~83)歲;病理類型為透明細胞癌108例,乳頭狀細胞癌3例,透明細胞癌伴乳頭狀細胞癌2例,透明細胞癌伴肉瘤樣癌1例,嫌色細胞癌1例;轉移部位為肺82例(71.3%),骨57例(49.6%),淋巴結27例(23.5%),腎上腺22例(19.1%),肝15例(13.0%),腹膜后12例(10.4%),腦6例(5.2%),對側腎6例(5.2%)。
其他隨訪收集內容及評定標準包括:①是否切除原發灶;②首月相對劑量密度(relative dose intensity in the first month,1M-RDI)是否<50%,其定義為:(實際劑量密度/標準推薦劑量)×100%,實際劑量密度為:服用藥物的累計劑量/實際使用的天數;③服藥前體能狀態美國東部腫瘤協作組織(Eastern Cooperative Oncology Group,ECOG)評分;④初始診斷有無癥狀;⑤IMDC分級;⑥胱抑素C;⑦中性粒細胞與淋巴細胞比值(neutrophil-to-lymphocyte ratio,NLR);⑧白蛋白;⑨服藥過程不良反應包括高血壓,手足綜合征(表1)。
IMDC 6個危險因素分別為:①卡氏功能狀態評分(Karnofsky performance status,KPS)<80分;②血紅蛋白(hemoglobin,HGB)<正常值下限;③從診斷至全身系統治療時間<1年;④中性粒細胞計數(neutrophil,NE)>正常值上限;⑤血清校正鈣離子濃度(Ca2+)>10.0 mg/dL(2.4 mmol/L);⑥血小板(platelet,PLT)>正常值上限。劃分風險等級標準為:0項為低危,1~2項為中危,3~6項為高危。
1.2 納入排除標準
1.2.1納入標準 ①病理及檢查結果證實為晚期腎細胞癌;②不適合手術治療或拒絕手術患者;③估計存活時間大于3個月;④至少有一個可測量病變;⑤可接受的心臟功能(由心臟超聲左心室射血分數評估)、肝臟功能[天冬氨酸轉氨酶和丙氨酸轉氨酶≤1.5×正常值上限(upper limit of normal,ULN)、膽紅素≤1.25×ULN、堿性磷酸酶≤2.5×ULN]、腎功能(血清肌酐≤1.5×ULN,24 h尿蛋白定量<1.0 g)和血液系統(血紅蛋白≥90 g/L,中性粒細胞絕對數≥1.5×109/L,血小板計數≥100×109/L)。
1.2.2排除標準 ①不能口服藥物患者(如無法吞咽、胃腸切除、腸梗阻等);②妊娠或哺乳期患者;③精神障礙不能按時服藥患者;④有未愈合的傷口或骨折;⑤患者有出血傾向,或正在進行溶栓或抗凝治療;⑥臨床資料不完整患者;
1.3 治療方法根據患者狀態評估,采用舒尼替尼標準服藥方案50 mg/d,口服,服用4周停2周,即4/2方案或50 mg/d,服用2周停1周方案。服藥劑量和方案需根據不良反應隨時調整。在治療過程中,若出現1~2級不良反應可及時對癥治療,不改變治療劑量;若出現≥3級不良反應,需立即中斷服藥,對癥治療,藥物治療直至疾病進展或發生患者難以耐受的不良反應。
1.4 療效及不良反應評價患者服藥前行影像學檢查確定靶腫瘤數量及大小,初始服藥的前2個周期內,每1個周期進行一次療效及安全性評價;后每2個周期進行一次療效評估,每1個周期進行安全性評估。根據實體腫瘤療效評價標準(response evaluation criteria in solid tumors,RECIST)進行療效評價,無進展生存期(progression free survival,PFS)定義為從服藥開始至腫瘤發生進展或死亡。不良反應按照通用不良反應術語標準(CTCAE 4.0)(Common Terminology Criteria for Adverse Events version 4.0)進行評估分級。
1.5 統計學方法采用SPSS 26.0統計軟件進行數據處理分析,通過Kaplan-Meier法進行繪制生存曲線,并采用Log-rank法進行顯著性檢驗,應用Cox比例風險模型進行單因素和多因素預后分析,采用R4.0軟件行Harrell一致性指數對IMDC預后模型進行驗證,以P<0.05為差異有統計學意義。
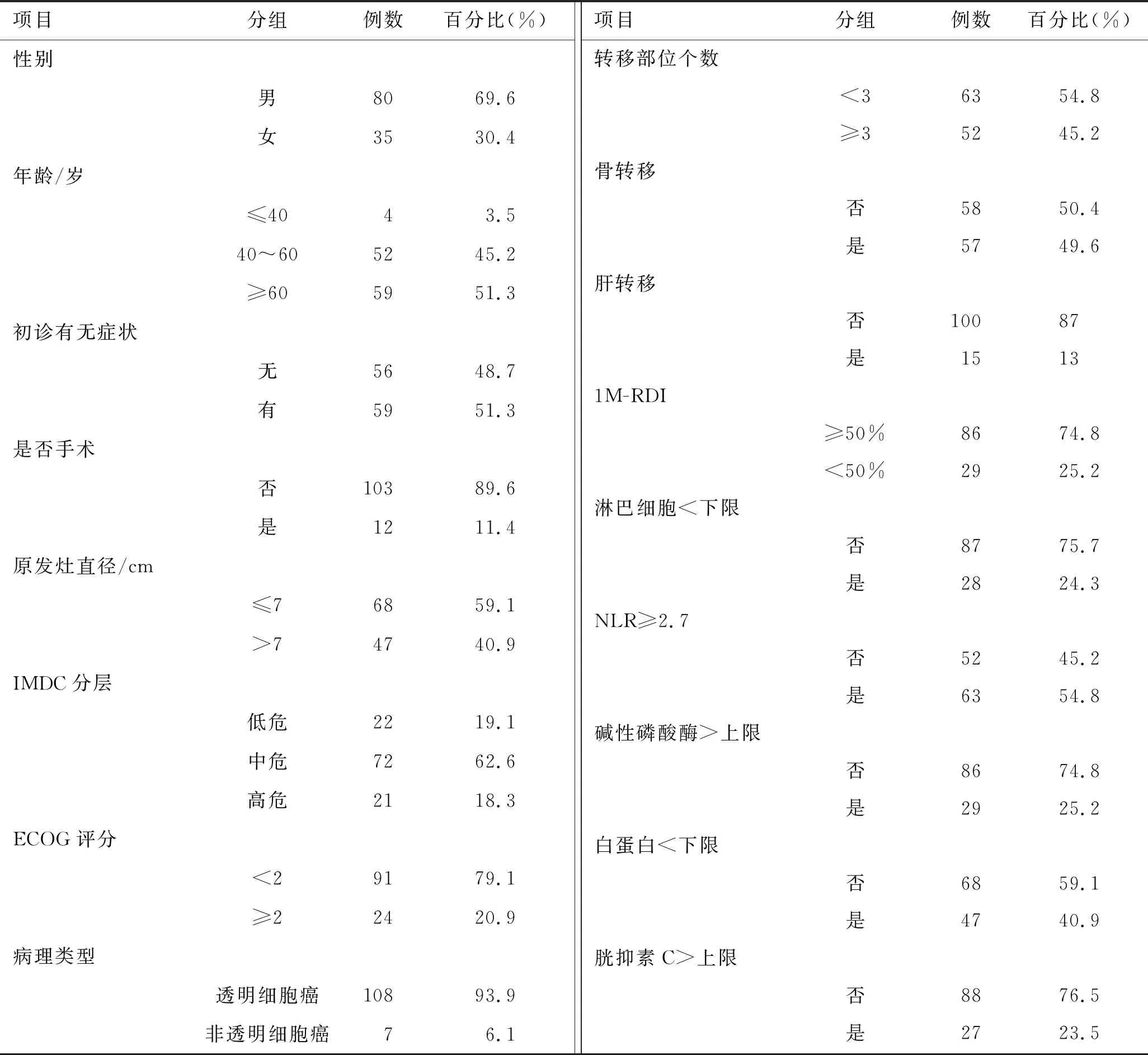
表1 舒尼替尼治療晚期腎癌患者的基本資料
2 結 果
本研究115例患者的中位隨訪時間14.6(2~54)個月,部分緩解(partial remission,PR)21.7%,疾病穩定(stabilization of disease,SD)60.0%,疾病進展(progression of disease,PD)18.3%,客觀緩解率(objective response rate,ORR)21.7%,疾病控制率(disease control rate,DCR)81.7%,中位無進展生存時間mPFS 11.3(9.4~13.2)個月,中位總生存時間mOS未達到。單因素分析結果顯示:ECOG評分≥2分、IMDC分層、轉移部位個數≥3個、骨轉移、肝轉移、1M-RDI<50%、服藥期間發生≥3級HFS、NLR≥2.7,初診時有癥狀為影響服用舒尼替尼轉移性腎癌預后的危險因素(表2)。多因素分析顯示:ECOG評分≥2分,IMDC高分級,轉移器官個數≥3個,NLR≥2.7,初診時有癥狀為影響腎癌預后的獨立危險因素(表3)。根據IMDC分層,此研究中低危組22例(19.1%),中危組72例(72.6%),高危組21例(18.3%)。低、中、高危組患者中位PFS分別為14.0個月、11.3個月和5.6個月,3組生存曲線明顯分離(P<0.01,圖1),IMDC模型一致性指數C-index為0.663(95%CI:0.610~0.716),表明該腎癌預后模型有一定的預測功能。
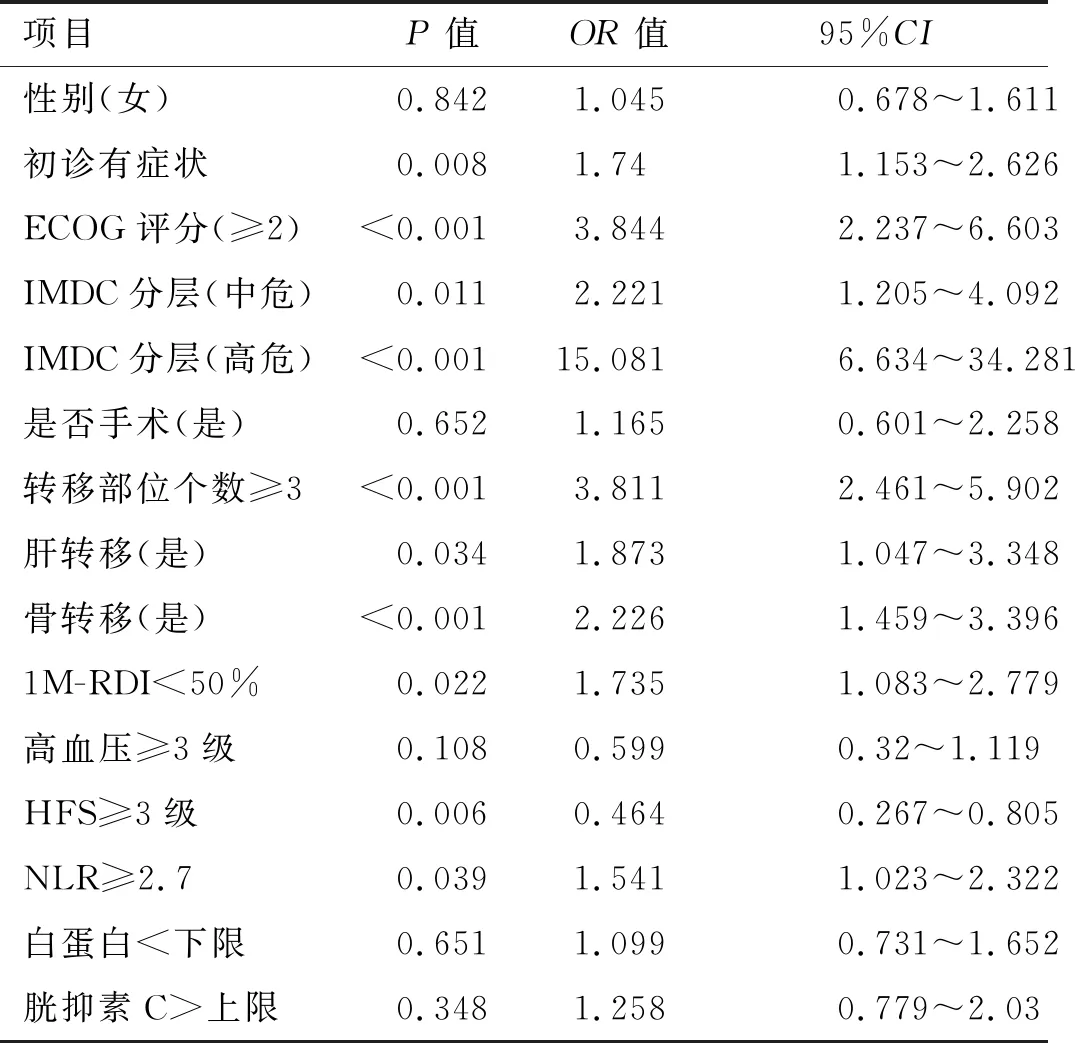
表2 舒尼替尼治療轉移性腎癌影響無進展生存期(PFS)的單因素分析
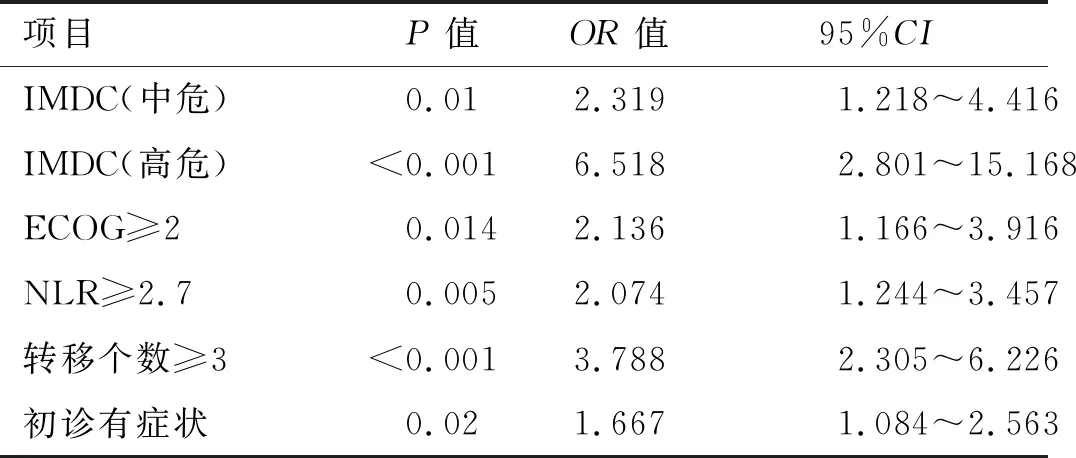
表3 舒尼替尼治療轉移性腎癌影響無進展生存期(PFS)的多因素分析
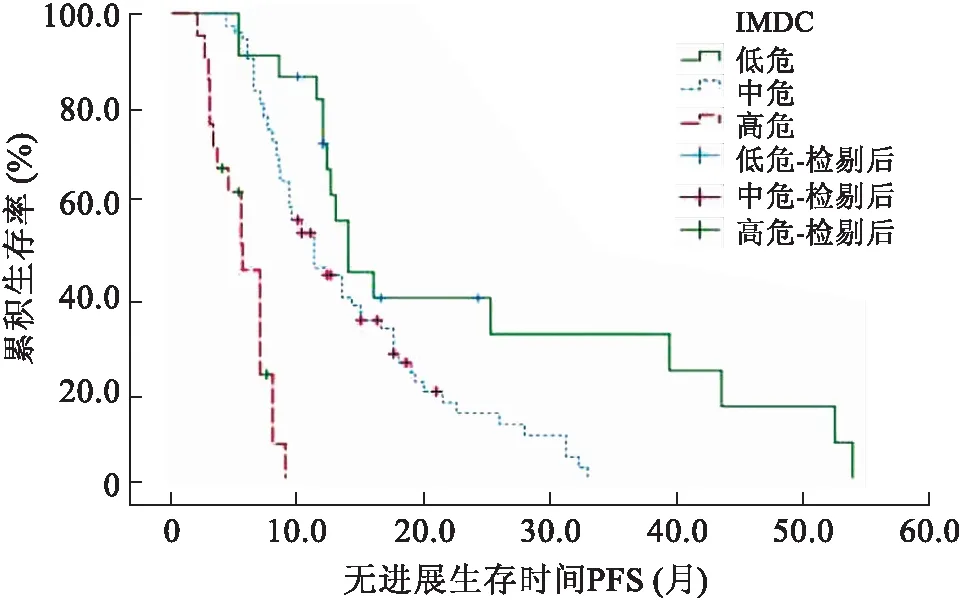
圖1 IMDC分層腎癌患者無進展生存時間Kaplan-Meier曲線
3 討 論
早期腎癌多以手術治療為主,對于轉移性腎癌的治療,從細胞因子到分子靶向再到免疫檢查點抑制劑,治療方式的改變,必然也伴隨著預后因素的改變。2020版歐洲泌尿外科學會(European Association of Urology,EAU)指南將之分為:解剖學因素、組織學因素、臨床因素和分子生物學因素,單因素預測能力有限,將預測效能強的因素聯合起來建立預后模型,可提高預測效能。隨著治療方式的改變及不同種族、不同地區治療習慣的差異,預測模型的準確性需要進行不斷的驗證[5]。
MOTZER等[3]對比舒尼替尼與干擾素-α治療轉移性腎癌患者療效的研究奠定了舒尼替尼治療晚期腎癌的重要地位,并成為各種新型分子靶向藥物療效的標桿。中國晚期腎癌患者也可從舒尼替尼的治療中顯著獲益[6-7],但不同患者間療效存在差異,因此研究舒尼替尼治療晚期腎癌患者的預后因素并驗證IMDC模型很有臨床意義。
藥物代謝動力學表明舒尼替尼在體內劑量濃度需達到50~100 ng/mL方能起到較好抗腫瘤作用,且藥物相關不良反應多出現在用藥的首個服藥周期[8-9],因此若1M-RDI≥50%,預示著患者對藥物毒性耐受較好,能在后續治療中取得較好效果。趙菊平等[10]研究同樣發現1M-RDI≥50%的患者OS明顯高于1M-RDI<50%的患者,是影響腎癌預后的獨立因素。本研究中單因素分析1M-RDI≥50%較低濃度有更好效果,但多因素分析未顯示明顯差異,可能與該研究樣本量少有關。
藥物相關不良反應的嚴重程度與機體內藥物濃度有關,而舒尼替尼的療效同樣取決于此,因此不良反應一定程度上可做為靶向藥物治療轉移性腎癌患者的預后預測因素。研究表明出現≥3級高血壓是預后較好因素[11],產生高血壓原因可能是:①血管內皮生長因子(vascular endothelial growth factor,VEGF)抑制后,一氧化氮產生減少,由此引起血管收縮,阻力增加;②VEGF抑制后,內皮細胞凋亡增多,毛細血管數量下降,從而導致阻力增加。DI FIORE等[12]研究表明≥3級手足綜合征也是預后較好因素,原因為藥物抑制表皮生長因子受體(epidermal growth factor receptor,EGFR)后可影響角質化細胞的增生、分化、遷移以及粘附,導致藥物相關手足綜合征,表現為皮疹及皮膚角質層增厚、脫皮、水泡,出血水腫、疼痛。但同時也應注意到出現不良反應是患者減少用量或者停藥的原因,因此需及時發現并處理不良反應。
KARAKIEWICZ等[13]研究發現ECOG評分是影響局部腎癌和轉移性腎癌預后的獨立危險因素,認為ECOG可量化腫瘤對機體的損害程度。國內外其他研究也發現服用舒尼替尼治療晚期腎癌的患者,較高ECOG評分預示不良預后[14-15]。分析可能的原因為服用舒尼替尼的患者,較好的體能狀態能夠耐受不良反應,使患者盡可能按時按劑量服藥。此外良好的體能狀態表明腫瘤負荷較低,腫瘤對機體損害的程度小,因此預后較好。
馬清昌等[16]研究認為腫瘤的產生、進展及最終轉移均與炎癥反應有關。腫瘤導致的全身炎癥反應會使中性粒細胞相對增多、淋巴細胞的相對降低。中性粒細胞會釋放多種炎癥介質,損傷血管內皮細胞導致通透性增加從而引起腫瘤轉移,且可與腫瘤細胞通過粘附分子結合形成癌栓有利于腫瘤轉移。淋巴細胞的相對減少會導致體內特異性T淋巴細胞免疫功能受限,降低了對腫瘤細胞的抑制作用從而導致腫瘤進展[17]。NLR通過聯合中性粒細胞和淋巴細胞,能夠更加準確地反映腫瘤對機體的影響程度,且研究表明NLR值與腫瘤大小和分級顯著相關,與包括泌尿系統腫瘤的多種腫瘤的預后相關,是非轉移性腎癌和轉移性腎癌免疫或靶向治療后的獨立危險因素[18-20]。本研究發現NLR≥2.7為舒尼替尼治療晚期腎癌的預后獨立危險因素。NLR<2.7和≥2.7患者中位生存時間分別為12.6個月和9.3個月,差異有統計學意義。
現階段患者極少出現腎癌三聯征,但出現其中之一便意味著腫瘤已屬于晚期,腎癌出現臨床癥狀提示預后不良[21],意味著更長時間的病程和發生侵犯轉移的可能性。本研究出現臨床癥狀患者59例(51.3%),未發現臨床癥狀者56例(48.7%),體檢發現腫瘤所占比例較以往升高。MOTZER等[22]研究表明未行原發病灶切除術患者預后不良,在靶向治療時代,減瘤性腎切除術(cytoreductive nephrectomy,CN)在轉移性腎細胞癌治療中的作用存在爭議。MEJEAN等[23]研究發現對于IMDC中、高危患者,減瘤性腎切除術后服用靶向藥物和直接服用靶向藥物兩者療效無明顯差異。然而一項相關綜述通過分析56項研究中的63項報告,結果顯示對于對于那些轉移負擔有限、身體狀態能夠接受病灶切除術,采用靶向治療后病情穩定、反應良好的患者,接受CN能夠延長患者的OS[24]。王杰等[25]認為,腎癌骨轉移患者切除原發腫瘤和轉移病灶,能夠延長患者OS,骨轉移灶切除術后靶向藥物治療可使IMDC中危患者生存獲益。
體檢發現腫瘤患者所占比例逐年增高,但約有1/3的腎癌患者初診即發現轉移,早期局限性腎癌即使在接受根治性腎切術治療后,仍有20%~30%患者出現轉移[26]。發生轉移是預后不良指標,多發轉移病灶意味著更大的腫瘤負荷。本研究中轉移個數≥3個的患者有52例(45.2%),可能與患者腫瘤切除術后未能及時復查、產生癥狀后已是多發轉移有關,體現了術后定期復查隨訪的重要性。
建立預后模型是通過統計學方法把預測效能大的單因素整合成系統的預測體系。常見的預測模型形式包括公式法、評分法、諾摩圖法,通過統計學方法將預后因素轉換為公式或圖形,從而使復雜多樣的預測因素以更直觀的方式被用來判斷腎癌患者預后風險及生存率,有著較好的準確性和可操作性。預后模型分為非轉移性和轉移性腎癌預后模型,非轉移性預后模型包括加利福尼亞大學洛杉磯分校腎癌預后多因素評分系統(University of California Los Angeles Integrated Staging System,UISS)預后模型[27],SSIGN預后模型[28]和Karakiewicz’s諾摩圖[29],轉移性預后模型包括(Memorial Sloan-Kettering Cancer Center,MSKCC)預后模型[30]和IMDC預后模型,各種模型有其優劣性且準確度有所差異。IMDC預后模型是HENG等[4]在MSKCC模型基礎上,于2009年建立的轉移性腎癌靶向治療預后模型,具有良好的預測效能,且該模型需要觀察的因素均是常規檢查內容,涉及的預后信息容易收集完整,有很好的臨床應用價值。但該模型從建立到驗證多是在高加索人群中進行,因此需要更多亞洲人群對該模型進行驗證。根據IMDC預后模型分層,本研究患者低危組22例(19.1%)、中危72例(72.6%)、高危21例(18.3%),3組患者中位PFS分別為14.0、11.3、5.6,3組生存曲線明顯分離(P<0.01),有較好的區分度。IMDC模型Harrell一致性指數為0.663(95%CI:0.610~0.716),表明該腎癌預后模型有一定的預測功能。
本研究局限性表現在以下幾個方面:首先本研究為回顧性研究,可能會出現各種信息偏倚;其次,隨訪時間較短,中位總生存時間未達到;再次,部分患者私自調整服藥劑量,可能會影響服藥療效;最后,單中心研究且病例數較少。因此本研究結果需要多中心合作及更多的病例進一步驗證。
總之,本文通過對服用舒尼替尼治療晚期腎癌患者的臨床資料的研究,篩選出了影響腎癌預后的危險因素,并進一步對IMDC預后模型的準確性進行了驗證。該結果對于指導臨床治療決策、預測治療效果、方便醫患溝通等方面起到很好的輔助作用。

