單原子納米酶在生物醫學中的應用
向 琴, 董海峰, 張學記
(深圳大學生物醫學工程學院,廣東深圳 518061)
1 前言
自然界一切生命現象都與酶有關。天然酶作為一種強大的生物催化劑,因其優異的催化活性和特異性而在醫藥、農業、化工、食品領域發揮著重要作用[1 - 4]。然而天然酶主要由蛋白質和生物有機分子組成,易受外界酸、堿、溫度等條件影響,并且生產成本高,阻礙了其實際應用。酶模擬物,尤其是納米酶,在替代天然酶方面具有至關重要的作用。納米酶是一類既有納米材料的獨特性能,又有類似天然酶的催化效率和酶促反應動力學的人工模擬酶[5 - 8]。納米酶具有良好的穩定性、制備成本低、儲存時間長等優點,能有效避免天然酶制備和純化過程中的復雜性,可應用于生物檢測、腫瘤治療以及其他類酶催化反應(圖1)[9 - 14]。然而與天然酶相比,其結構、性質和催化機理都十分復雜,嚴重制約了它的快速發展。隨后有研究表明,納米酶的尺寸對其催化性能起著至關重要的作用,由于低配位金屬原子通常作為活性部分,每個金屬原子的催化活性隨著金屬顆粒尺寸的減小而相應提高,并且通過實驗和理論分析,驗證了亞納米尺寸的金屬團簇具有更高的催化活性和選擇性。
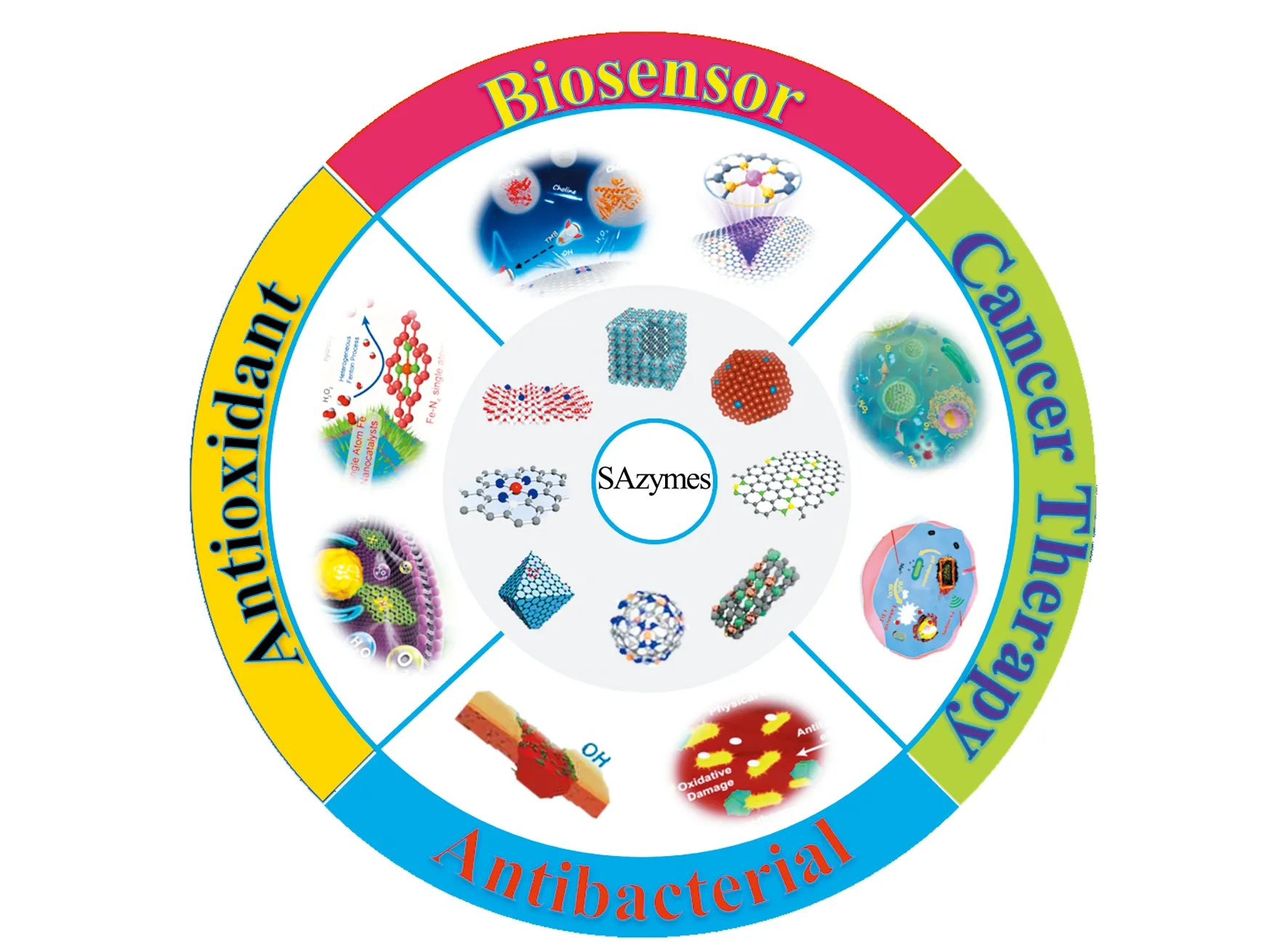
圖1 單原子納米酶在生物醫學中應用示意圖Fig.1 Illustration of SAzymes in biomedical applications
為進一步推進納米酶的發展,新出現的單原子納米酶(SAzymes),集成了單原子技術和固有的類酶活性位點,將納米酶技術提升到原子水平,并為突破其固有的局限性提供了新的機遇[15 - 20]。SAzymes中,原子分散的金屬中心最大限度地提高了原子利用效率和活性位點密度,具有比傳統納米酶高10~100倍的優異催化活性[21],并且通過精確調節原子的空間構型可以設計出同時具有多種酶催化活性的金屬配位結構,展現出廣泛的催化選擇性,為其實際應用提供了廣闊的前景。
2 單原子納米酶的特征
2.1 單原子納米酶的結構優點
基于SAzymes的類酶催化反應是一種特殊的多相催化反應,其催化活性和選擇性是最重要的考察因素,這在很大程度上取決于納米材料的結構和原子特性[22 - 23]。然而,對于傳統納米酶,其活性主要來源于納米材料表面極少的活性位點,如邊緣、缺陷位點中的不飽和配位原子[24]。這些位點結構難以區分和定量控制,不僅使催化機理極其復雜,還導致其與天然酶的活性相差甚遠。大量的研究表明,較小尺寸的納米酶會因較高的表面體積比而暴露出更多的催化活性位點,從而提高催化活性[25 - 26]。當納米粒子縮小到原子水平時,可以表現出與納米顆粒顯著不同的幾何和電子效應,不僅具有最高的原子利用率,并且原子結構簡單,表現出明確的配位結構、活性位點、催化機理以及優越的催化性能。SAzymes可以填補均相催化與多相催化之間的空白,突破材料設計的局限[27]。
2.2 單原子納米酶的表面優化
通常,合成的SAzymes具有較高的表面能,對其表面進行修飾,能改變對底物的親和力,改善疏水性,增加靶向性,并提高其催化效率[28 - 30]。在SAzymes的表面進行適當的聚乙二醇(PEG)修飾,不僅可以增強其在溶液中的分散性和生物相容性,而且可以防止SAzymes與生物液體組分相互作用,從而延長血液循環,降低單核吞噬系統的清除率。Huo等[27]使用DSPE-PEG作為表面活性劑,使得Fe -N4SAzymes在生理鹽水中具有良好的分散性,顯著提高了對腫瘤的抑制作用;同樣,Xu等[31]使用PEG共軛維生素E改善了Zn-N4催化劑在溶液中的分散性。除了PEG,Wang等[29]利用PVP作為穩定劑,使錨定Ru原子的Mn3[Co(CN)6]2在水溶液中具有較好的分散性,提高了其用于癌癥光動力學治療的效率。
此外,使用靶向配體修飾于SAzymes表面,可以提高SAzymes與細胞表面的特異性相互作用,有利于對病灶位點的特異性選擇。常用的靶向修飾物有生物小分子、肽、抗體或蛋白質等,通過與細胞表面受體結合,然后由受體介導的內吞作用進入細胞,進而實現有效靶向癌細胞[27,32,33]。例如利用EDC/NHS化學偶聯法,將三苯基膦(TPP)上的羧基與所制備的碳點上的胺共價偶聯,可以得到穩定的靶向線粒體的Au-碳點結構,而且具有原子分散的Au,可以實現最大程度地與內源性谷胱甘肽(GSH)反應,降低GSH水平,放大線粒體內活性氧(ROS)水平,進而誘導癌細胞凋亡[34]。
3 單原子納米酶在生物醫學領域中的應用
3.1 單原子納米酶用于生物傳感
SAzymes具有高選擇性和優異的催化活性,有利于應用于生物傳感[30,35-40]。Jiao等[41]通過摻雜B元素精確調控中心Fe原子的配位環境,開發出一種B摻雜的Fe-N-C單原子納米酶(FeBCN),其具有與天然辣根過氧化物酶(HRP)相似的結構(圖2(A)),表現出比HRP更高的溫度耐受性以及顯著增強的類過氧化物酶(POD)活性和選擇性。通過pH調節FeBCN的POD活性,實現了對乙酰膽堿酯酶(AChE)活性及其相應的抑制劑分子的高靈敏檢測。證明了SAzymes能有效模擬天然酶,在生物酶活性和小分子檢測中顯示良好的應用前景。
除了利用單原子Fe構建納米酶催化位點,Cu離子同樣可以用于構建SAzymes。Zhu課題組[35]通過鹽模板策略,在摻N碳納米片上嵌入高濃度Cu單原子位點,合成了具有POD活性的Cu-NC SAzymes。然后將Cu-NC SAzymes與AChE和膽堿氧化酶(ChOx)結合,構建了基于三酶的級聯反應體系(圖2(D)),通過顯色法可以檢測痕量的乙酰膽堿,線性檢測范圍為10~8 000 μmol/L,檢出限為1.24 μmol/L。
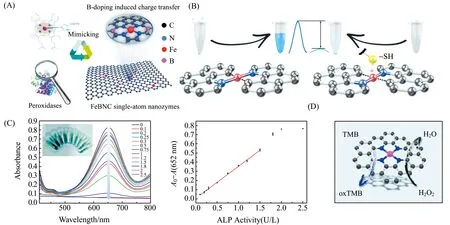
圖2 FeBCN(A)[41]、Fe -N-C(B)[36]、Cu-N-C(D)[42]結構示意圖以及Fe/NC-SAzymes[35]對ALP的檢測(C)Fig.2 Structure diagram of FeBCN(A)[41],Fe -N-C(B)[36] ,Cu-N-C(D)[42] and UV-Vis absorption spectra of the Fe/NC-SAzymes/H2O2/TMB/AAP system with various concentrations of ALP(U/L) and Plots of the absorbance of the assay based on Fe/NC-SAzymers[35] versus ALP activity at 652 nm(C)
3.2 單原子納米酶用于腫瘤治療

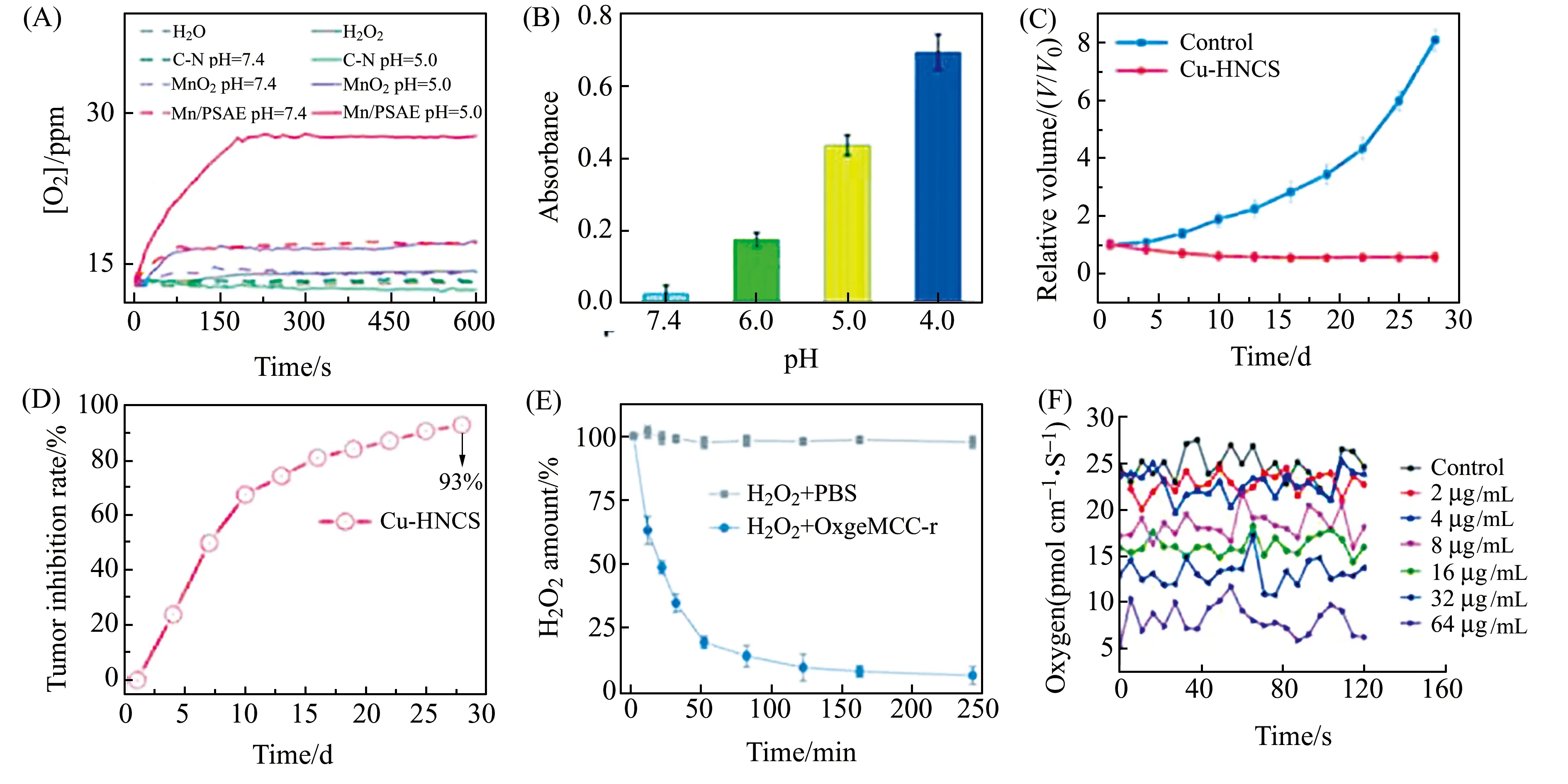
圖3 Mn/PSAE催化H2O2分解O2(A);TMB法測定不同pH下Mn/PSAE的類氧化酶活性(B)[28];Cu-HNCS用于小鼠后的腫瘤生長曲線(C)和腫瘤抑制率(D)[50];OxgeMCC-r SAE分解H2O2的能力(E)[29];不同濃度MitoCAT-g處理后單個HepG-2細胞中的氧通量(F)[34]。Fig.3 The O2 generation from the decomposition of H2O2 by Mn/PSAE-mediated catalysis (A);TMB assay for measuring oxidase-like activity of the Mn/PSAE at the different pH(B) [28];Tumor proliferation curves (C) and relative tumor inhibition rates (D) after treatment with Cu-HNCS [50];Degradation profiles of H2O2 with or without of OxgeMCC-r SAE(E)[29];Representative traces of oxygen flux in single HepG-2 cells after treatment with different concentrations of MitoCAT-g(F)[34].
除了催化產生ROS,有效降低腫瘤細胞內谷胱甘肽(GSH)的含量,同樣可以破壞細胞內的氧化還原內穩態,從而引起ROS相對增加,誘發細胞凋亡。例如,Gong等[34]開發了一種碳點支撐的原子尺度分散的金(CAT-g),這種納米材料可以有效清除線粒體中的GSH,并增加ROS,經過瘤內注射后,可以顯著殺傷癌細胞,抑制腫瘤細胞生長,同時不損傷正常組織。并且,通過流式細胞術檢測發現,修飾了三苯基膦(TPP)的MitoCAT-g可以降低癌細胞線粒體膜電位和氧消耗,導致細胞凋亡。
3.3 單原子納米酶用于抗菌作用
ROS可以破壞細菌的活性組分,造成其細胞膜、核酸、蛋白質等損傷,最終導致細胞死亡[21,52 - 53]。目前報道的納米酶主要介導氧化還原反應,可以調節ROS水平,用于開發新型的抗菌藥物。例如,Huo等[51]將單原子Fe錨定在氮摻雜無定形碳上,制備了碳基單原子Fe催化劑(SAF NCs),該納米材料具有優異的POD活性,在生理水平濃度(50~100×10-6)的H2O2存在下,可以產生豐富的 ·OH,具備殺死革蘭氏陽性菌(金黃色葡萄球菌)和革蘭氏陰性菌(大腸桿菌)的能力。利用SAF NCs和H2O2處理細菌后,大腸桿菌和金黃色葡萄球菌的存活性僅為28.9%和17.4%,并且此單原子催化劑對近紅外光具有特異性吸收,表現出19.37%的光熱轉化效率,在近紅外光照射下,對兩種菌落的抗菌效率均提高到接近100%,可以協同殺死細菌。類似的,Liu課題組[31]利用金屬有機框架(MOFs)材料ZIF-8,通過介孔硅裂解保護策略,制備了單原子Zn催化劑,通過酶學實驗驗證其可作為一種高效的單原子POD模擬物,可應用于傷口消毒。在體外抗菌實驗中,該SAzymer實現了高達99.85%的抑菌率,同時能夠在低濃度H2O2情況下有效促進小鼠傷口的愈合。此外,Huang等[54]制備了一種能模擬細胞色素P450的單原子納米酶(FeN5-SA/CNF),以Zn基MOFs包裹鐵酞菁作為前驅體,高溫熱解形成FeN5/C位點,該位點具有優異的OXD活性。體外抗菌實驗表明,經FeN5SA/CNF處理的大腸桿菌細胞的存活率明顯降低,細菌形態受到嚴重損傷。并且FeN5SA/CNF對小鼠的潰瘍情況具有明顯的緩解作用,可以加速傷口愈合。
3.4 單原子納米酶的抗氧化應激作用
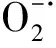

圖4 (A)FeN5SAzymes/CNF的形成示意圖[54];(B)單原子Pt/CeO2納米酶繃帶對小鼠腦外傷的無創治療[58]。Fig.4 (A)Schematic formation process of carbonnanoframe-confined atomically dispersed Fe sites with axial five-N coordination for mimicking the active center of cytocrome P450[54];(B)Noninvasive treatment of brain trauma in mouse models using the nanozyme-based bandage [58].
4 結論與展望
SAzymes具有均勻分散的活性位點和明確的配位結構,能夠模擬多種天然酶的活性,可用于生物的檢測與疾病的治療。未來應進一步探索SAzymes的活性-結構關系,合理地調節催化活性位點的幾何和電子性質,從而設計出效率更高的納米酶;應拓展金屬原子的種類,開發除Fe、Zn、Au金屬原子以外的SAzymes,深入挖掘其潛力;應著眼于加強SAzymes的反應特異性和優化催化性能,研究納米酶在體內的藥代動力學、降解、代謝、劑量依賴毒理性以及生物相容性等,實現SAzymes的臨床使用。SAzymes的高催化性與選擇性以及優異的穩定性,為開發可持續、經濟、安全的疾病治療方法提供了新思路。也預示了SAzymes在生物醫學領域巨大的應用前景,但也存在如下一些挑戰:
(1)目前已報道的SAzymes多基于碳基材料,其合成方法主要是通過高溫熱解,然而經過高溫煅燒的碳材料水溶性和生物相容性差,難以直接應用于生物醫學領域,雖然可以通過表面修飾改善其疏水性,但同時可能對納米材料的結構位點造成破壞,加大對催化機理的研究難度,故未來需拓展負載單原子材料的種類。
(2)單原子納米材料的金屬負載量仍然是目前亟待解決的難題之一,開發高效合理的合成方法,減小負載材料的尺寸,加強金屬原子的分散,以最大程度的提高金屬原子的負載量是未來研究的方向之一,并且可以開展雜原子(N/S/B/P)摻雜,以及設計多金屬中心的SAzymes,以追求發揮SAzymes最大的功效。
(3)應用于生物醫學領域的中心原子主要基于Fe、Zn、Au,并多以M-N-C形式存在,而對其它金屬原子研究甚少,造成了SAzymes的活性單一,未來還需開發對貴金屬、稀有金屬的研究,擴大SAzymes的研究范圍。
(4)為早日實現SAzymes的臨床轉化,需特別重視材料的生物安全性,提高材料的生物相容性和生物可降解性,深入探究納米酶在體內的作用機制,建立完備的納米酶毒性評估平臺,最終實現低毒、高效納米酶制劑的開發。

