突破“摩爾”這座大山
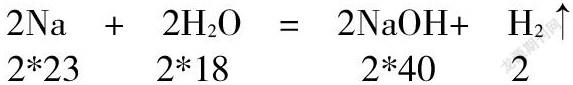
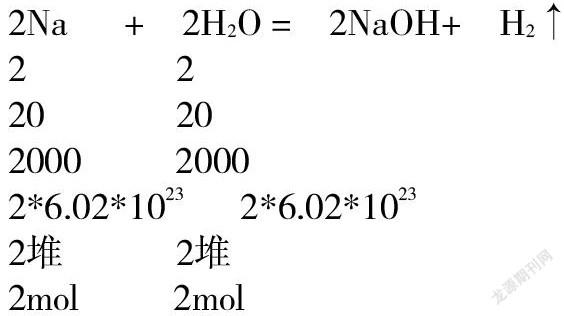
摘要:研究目的:“物質的量”是橫亙在學生面前的一座大山,不選考化學,會面臨很多專業報考受限的窘境,創新思路,拿下摩爾這座山頭。方法:化學計算解決一個定量問題,如果和系數開比例,計算會簡單些。規定“12克碳-12含有的碳原子數為一堆。”一堆任何物質都含有6.02*1023個微粒。這是個常數,我們稱之為阿伏伽德羅常數,用NA表示。標準堆,“12克碳-12為一堆”,一堆任何物質的質量以克為單位數值都等于它的化學式的式量。
結果:通過多年探索所教學生選化學比例保持在60%以上,會考合格率超97.6%
結論:質量的單位是克,物質的量的單位是堆。題目給了克數,我們只要換成堆數,就可與系數開比例了。要點:除著進去、乘著出來。
關鍵詞:和系數開比例;系數比代表堆數比;克數換成堆數
高一化學學習中,“物質的量”是橫亙在學生面前的一座大山,很多同學因為學習不得法,望而卻步,對化學學習興趣了然,從而將精力轉向其他學科,在新高考的背景下,即使會考化學不及格,也不影響參加高考,但是面臨很多專業報考受限的窘境。
在新高考、新課本的形勢下,創新思路,拿下摩爾這座山頭,使學生學習一路坦途。激發學生學習興趣,為學生今后的發展,為建設祖國,報效社會,成為屠呦呦、鐘南山那樣的偶像,打下堅實的基礎。
以魯科版高一新課本為例,集中闡述一點思路和做法,供大家參考。
首先,用視頻進行情景再現,取一小塊鈉,質量為4.6克,放入事先在燒杯里滴入幾滴酚酞的水中,觀察現象,同學們很容易通過觀察和回憶,答出,浮、熔、游、響、紅。這個化學反應中,反應物為鈉和水,生成物分別為氫氧化鈉和氫氣。提問,我們能否根據發熱病人的體溫高低,隨意改變服用藥物的劑量呢?顯然是不行的。這就需要一個定量問題,我們只知道反應物和生成物是不夠的,還需要進一步弄清他們的數量關系,依據質量守恒定律,和化學方程式進行計算即可。
2Na + 2H2O = 2NaOH+ H2↑
2*23 2*18 2*40 2
用質量比開比例進行化學計算,對高一學生還是比較容易做到的。我們發現計算時的數字有點大,過二十甚至過百,都很正常。大家對二十以內的加減乘除特別熟悉。有沒有可以把數字變得較小,計算更加輕松的辦法呢。答案是有的。化學方程式中的系數一般較小,如果和系數開比例,計算會簡單些。我們知道,化學方程式中系數代表微粒的個數比,而微粒個數顯然直接聯系現實中的化學反應。那么,科學家就引入了一個新的物理量,稱為物質的量,符號:n,用來表示物質量的多少,它的單位是“堆”用符號mol表示。一堆一堆的來表示物質的量的多少。像極了自行車可以作為代步工具,會使我們上學行路方便了許多。摩爾(mol)作為一個單位就是來解決化學計算太繁雜的。一堆有大有小,含義不固定不行。科學家制定了“堆”的標準,使得一堆有了科學的含義。規定“12克碳-12含有的碳原子數為一堆。”我們用N來表示微粒個數。那么每一堆物質都含有相同的微粒個數,是多少個呢,這不用我們去查,科學家早查好了,大約6.02*1023個。換句話說,一堆任何物質都含有6.02*1023個微粒。這是個常數,我們稱之為阿伏伽德羅常數,用NA表示,記作6.02*1023mol-1。他是有單位的。不過我們在考試中一般都假設阿伏伽德羅的數值為NA,好的,我們先做一下練習,一堆有6.02*1023個,半堆呢,10堆呢。呵呵,同學們答得很準確。我們一般說0.5NA,10NA,下面我們再來看,下面的化學方程式:系數比與微粒個數比
不難推出系數比還可代表堆數比,即物質的量之比。如果知道了反應體系中某物質的堆數,即可利用系數比開比例進行計算了。可是沒有一種衡器像天平,可以稱量物質的質量來量取物質的量。怎么辦呢,我們再來看,標準堆,“12克碳-12為一堆”。一堆碳是12克,一堆其他物質呢,簡而化之,一堆任何物質的質量一克為單位,都等于它的化學式的式量,比如,一堆鈉的質量為23克,一堆水的質量是18克。我們稱為摩爾質量,用M表示,與式量的區別在于它有單位是g.mol-1不過無所謂,化學計算中間過程,可以不用寫單位。只要知道,質量的單位是克,物質的量的單位是堆。題目給了克數,我們只要換成堆數,就可與系數開比例了。我們在實驗中投入的是4.6克鈉,現在先換堆數,我稱作除一下,簡稱除著進去。4.6/23得到4.6克鈉為0.2堆,不難算出參加反應的水也是0.2堆,生成的氫氧化鈉也是0.2堆,氫氣為0.1堆。若問生成的物質質量,再乘一下,或者說乘著出來,氫氧化鈉的質量是0.2*40=8(克)。計算要點就是除著進去、乘著出來。登山的到了這一步,難度就已克服了一半。接下來做練習。分別計算下列物質的物質的量(將克數換算成堆數、除以下)1、5.4克和H2O。2、19.6克H2SO4。3、4克NaOH。4、11克CO2 5、10克CaCO3。6、11.7克NaCl。7、11.2克Fe。注意公式n=m/M.再分別計算0.2堆(mol)下列物質的質量(將堆數換算成克數、乘以下)1、H2O 2、H2SO4 3、NaOH。4、CO2 5、CaCO3 6、 NaCl 7、Fe。公式是m=n*M
結論與思考
物質的量作為新授課,要以解決化學計算系數比的升級2.0版為重點,不要過多糾纏阿伏伽德羅常數,和摩爾的叫法。讓學生盡可能直觀的了解,個數與堆數,質量和堆數的相互轉換,就像步行改為騎自行車。摔跟頭是不可避免的,不能學周倉扛著馬攆關老爺。不會騎,就扛自行車上學,成為一種負擔。摩爾也無非像理發店里剃頭的王翠芬阿姨,改成了洗剪吹的托尼老師。咱也覺得人家叫王浩然比王建國洋氣,李梓萱比李雪琴顯得有文化。你要覺得接地氣,咱先用堆代替摩爾頂一會。啥時候,和國際接軌了,再高大上的叫摩爾,或摩。
參考文獻:
[1]王磊陳光巨[M]普通高中化學教科書必修第一冊濟南山東科學技術出版社2019年7月21-22.
作者簡介:
趙廣河,男,生于1965年12月,1985年7月畢業于濟南師專化學系,高級教師。1985年72011年獲濟南市長清區化學優質課一等獎。

