TiO2納米線的水熱法制備及表征
海 霞,張曉明,鄒 斌
(中央民族大學 理學院,北京 100081)
1 引言
納米TiO2作為一種常用的化工材料[1],具有半導體特性[2]、化學穩定性[3]、超親水性、光催化活性[4]、熱穩定性[5]、抗氧性、多孔性等優良性能,已經廣泛應用于自清潔、空氣凈化、廢水處理等方面[6],此外,納米TiO2還具有表面效應、小尺寸效應等納米顆粒的特點,其光催化性能也十分優越,因此被用作光催化劑用來進行有機污染物的的降解。但在實際研究過程中,發現TiO2中載流子的擴散路徑較長且載流子之間容易直接復合,限制了納米TiO2光電轉換效率的提升。而且TiO2本身禁帶寬度較大( 3.0~3.2 eV) ,所以限制了其對太陽光吸收的范圍,因此其催化活性有待提升[7]。因此提高納米TiO2對光的吸收范圍,加速光生電子的發生從而提高納米TiO2光電轉換效率便十分重要的探究方向。為了提高納米TiO2光電轉換效率而對納米TiO2進行表面改性是目前較為有效的方式。而納米線作為一種橫向為納米級尺寸,縱向卻沒有限制的一維結構。具有較高的電荷載流子傳輸效率和離子分散能力,使其具有較強的電荷收集效率,減少了光電子的損失[8]。目前TiO2納米線的光催化降解特性還處于研究階段,制備TiO2納米線的方式有很多,主要分物理法和化學法,物理法主要包括磁控濺射、球磨法,而化學發以氣相-液相沉積、溶膠凝膠發、水熱法為主。由于水熱法具有:能夠以單一步驟完成產物的形成與晶化,流程簡單;能夠控制產物配比;制備單一相材料;成本相對較低;容易得到取向好、完美的晶體;在生長的晶體中,能均勻地摻雜;制備工藝比較簡單;可調節晶體生成的環境氣氛等優點。因此本文采用了以氫氧化鈉、尿素與Ti片進行反應,再用鹽酸浸泡并進行煅燒,采用水熱法制備合成具有更大的比表面積和表面能的TiO2納米線;并探究反應時間、尿素用量對TiO2納米線的表面形貌、表面化學成分、物相結構的影響。
2 實驗材料與方法
2.1 原材料
Ti片,尿素溶液,氫氧化鈉,鹽酸溶液(0.6 mol/L),丙酮,異丙醇,國藥化學試劑有限責任公司;去離子水,中央民族大學自制。
2.2 TiO2納米線的制備
TiO2納米線的制備包括以下步驟。
第一步:前期準備:清洗實驗器皿:清洗本次實驗所用的所有器皿并將其烘干;準備實驗所用材料:根據反應釜型號(50 mL)確定Ti片尺寸,使放入反應釜中的Ti片能剛好接觸到反應液;清洗原材料:將Ti片置于容積比為1∶1∶1的去離子水、丙酮、異丙醇的混合溶液中,進行超聲處理,功率為90%,時間為10 min。
第二步:藥品配置。配置化學材料(溶液):分別配置0 g、0.8 g、1.6 g、2.4 g的氫氧化鈉和2.4 g的尿素加入到40 mL的去離子水中充分溶解,然后倒入反應釜內膽中,再將Ti片超聲,超聲完成之后也放入反應釜并擰緊,放入溫度為220 ℃的恒溫干燥箱加熱,時間設置為A組20 h,B組40 h。
第三步:TiO2納米線燒制。樣品取出后呈現灰色或淡黃色的金屬色,失去或保留有部分金屬色。將Ti片浸泡在0.6 mol/L鹽酸溶液中,時間為1 h。之后將Ti片從鹽酸中取出,并用豐富的去離子水清洗后在室溫下晾干(晾干時間大于1 h),注意此過程不能用吹風機吹干。將晾干后的Ti片置于溫度為400 ℃/650 ℃的管式爐,馬弗爐中進行煅燒2h,緩慢升溫。
在該過程中,可以通過將Ti片放入洗好的50 mL的燒杯中去判斷淹沒Ti片所需要的溶液體積,從而確定配置溶液所需3種溶液的體積;為了避免溶液揮發,取出3種溶液后需盡快將三者混合,并將Ti片放入,用封口膜封好進行超聲處理;在所有等待過程中,防止Ti片/溶液都必須用封口膜封好防止污染溶液或者溶液揮發。TiO2納米線的制備流程如圖1。
已知在自然界中的TiO2,存在三種晶體結構[9],分別為金紅石型、銳鈦礦型和板鈦礦型,其中金紅石型與銳鈦礦型TiO2均具有光催化活性,而銳鈦礦型光催化活性則是三者之中最佳的,圖2為兩種晶型的結構圖。
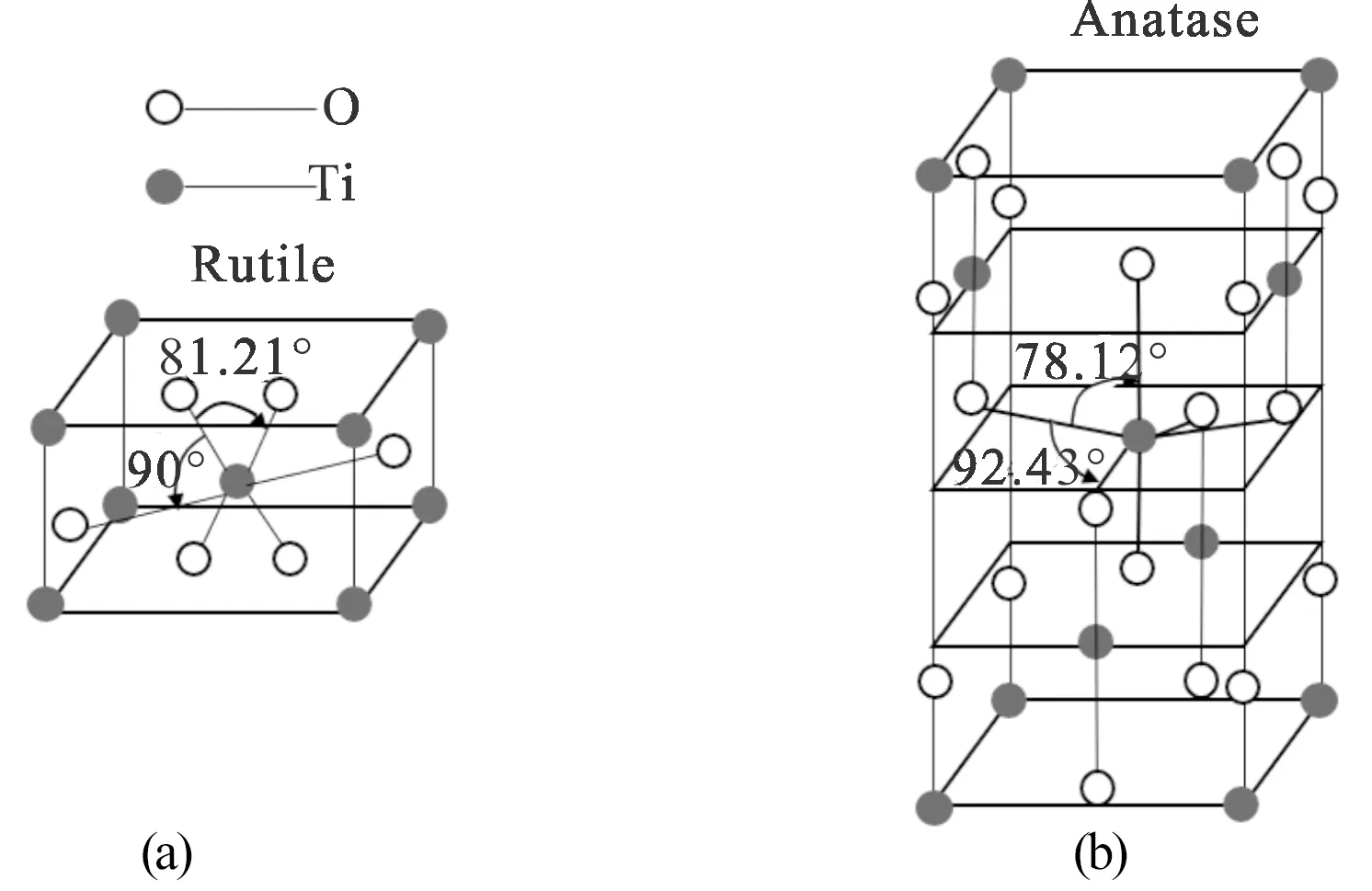
圖2 (a)銳鈦礦晶型結構 (b)金紅石晶型結構
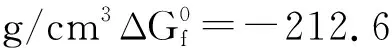
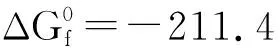
本實驗主要在鈦箔上定向合成單晶二氧化鈦(TiO2)納米線陣列的[10]。
(1)在鈦箔上通過新型堿水熱生長法生長單晶鈦酸鈉(Na2Ti2O5·H2O)納米線。
(2)Na2Ti2O5·H2O·H2O納米線通過離子交換反應轉化為質子化的雙鈦酸鹽(H2Ti2O5·H2O·H2O)納米線,而不改變其形貌或晶體結構。
(3)通過煅燒將質子化的雙鈦酸鹽納米線轉化為單晶銳鈦礦TiO2納米線。
反應順序:
(1)
(2)

(3)
(4)
式(1)、(2)代表水熱生長全部反應;式(3)、(4)為離子交換和煅燒過程。
這是一種在鈦箔上生長數十微米長的定向單晶TiO2納米線的方法。是利用一種新的水熱法生長出Na2Ti2O5·H2O納米線,通過之前開發的一種拓撲變換,實現這些納米線轉化為定向的銳鈦礦TiO2納米線的過程。從而將其作為光電器件利用在一些電池(如染料敏化太陽能電池)中。
2.3 分析與表征
采用掃描電子顯微鏡(SEM)對TiO2納米線的表面包覆形貌進行觀察,利用X-射線粉末衍射(XRD)進行TiO2納米線的晶體結構分析。
3 結果與討論
3.1 掃描電子顯微鏡下的形貌
(1)首先先對照A1、A2、A3、A4組,在同樣的實驗條件下,不同反應物尿素量下得到TiO2納米線的電鏡圖,如圖3。
由電鏡圖3可見,當尿素含量為0,反應時間為20 h時, (圖3(A1)), 薄膜表面由許多細長的絲線,粗細大約在10~20 μm,只出現了還沒有從絨狀納米片帶上完全分裂下來的一維納米線結構;當尿素含量為0.8 g,反應時間為20 h時(圖3(A2)),可以看到薄膜表面的一維納米線結構出現了相互交叉生長的情況且各納米線的直徑出現差異,約在10~30 μm之間波動,出現了一些長度達到幾個微米的單根納米線,也可以看到仍然存在一些還未完全分裂開來的納米線束很薄的絨狀納米片[11](納米帶)。由(圖3(A3))可見,當尿素含量達到1.6 g時,Ti片表面出現許多納米線束(帶)聚集體,這些聚集體大小不一且并沒有分裂下來, 形狀類似展開的花朵,可見隨著尿素含量增加,薄膜結晶性有明顯提高;在尿素含量達到2.4 g(A)時, 鈦膜表面出現了很多尖錐狀的鈦晶粒,可見其結晶性能相對優越且薄膜致密度也明顯提高。
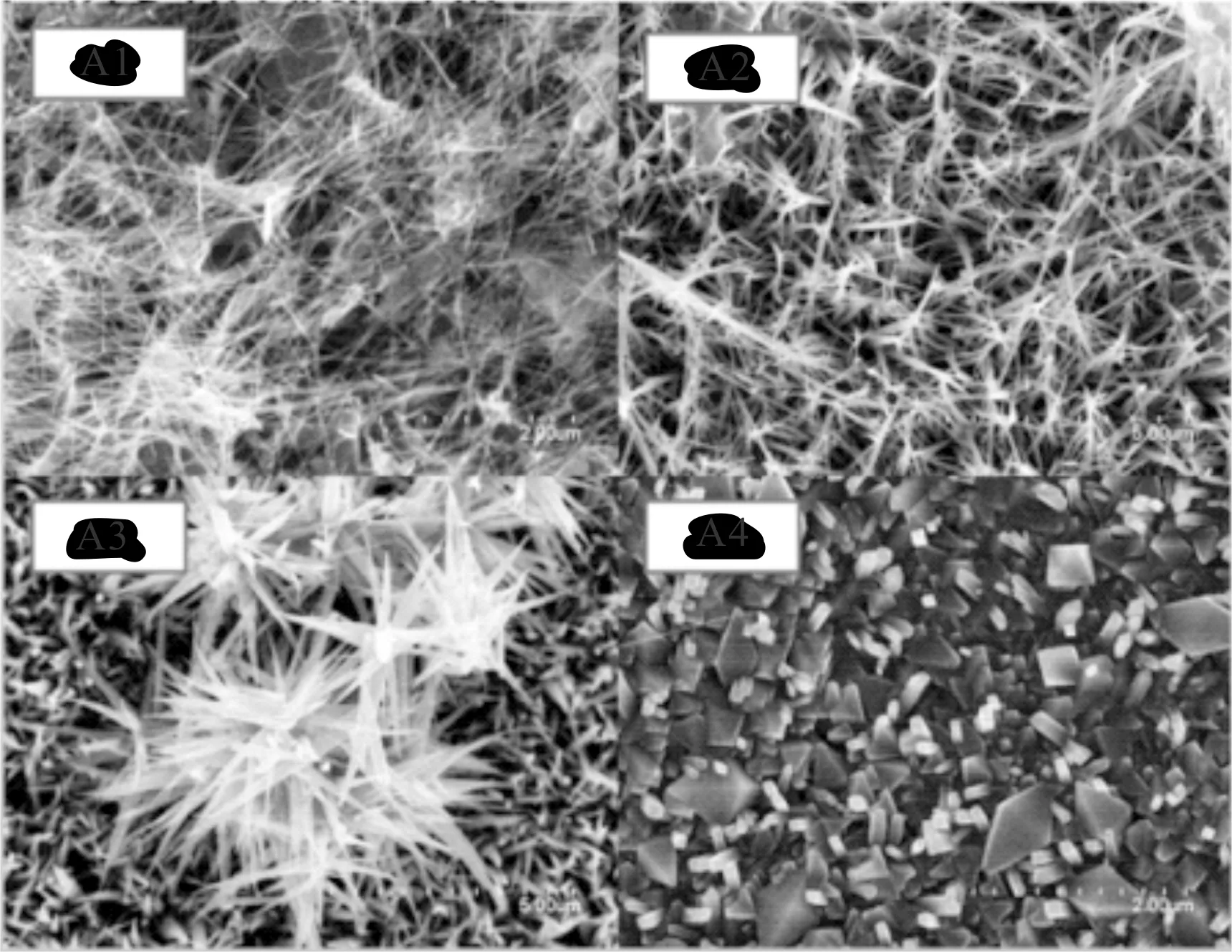
A1、A2、A3、A4尿素含量分別為0 g、0.8 g、1.6 g、2.4 g
(2)對照A1、B1、A4、BA組,在同樣的尿素含量下,不同反應時間下得到TiO2納米線的電鏡圖。
圖4、5中,(A)與(A.1)為反應時間為20 h TiO2的正側面圖,(B)與(B.1)為反應時間為40 h TiO2的正側面圖。對比可見,反應時間為40h的B1組TiO2比反應時間為20 h的TiO2更加細長,且有(A1.1)和(B1.1)可以看出,B組相對于A組有序性相對好一點,且長度更長,而(A4.1)和(B4.1)是由于剪樣是遭到破壞無法得到較準確信息,但綜上可見,反應時間越長,得到的TiO2的長度越長,有序性也越好;而當反應時間一樣,尿素含量越多,TiO2的團聚程度越大,而我們已知粒子粒徑與比表面積成反比,當TiO2粒子運用于光催化的催化劑時,其粒徑大小對光催化活性有直接的影響。

(A1)反應時間為20 h TiO2形貌圖,(A1.1)為(A1)側面圖,(B1)為反應時間為40 h TiO2形貌圖,(B1.1)為(B1)側面圖 尿素含量為0 g

(A4)反應時間為20hTiO2形貌圖(A4.1)為(A4)的側面圖(B4)反應時間為40 h TiO2形貌圖(B4.1)為(B4)的側面圖 尿素含量為2.4 g
3.2 用XRD對水熱法制備產物進行表征
由于實驗是在Ti片襯底上紡絲,所以首先對實驗所用的Ti片襯底進行物相識別,確保其上沒有雜質而對后續分析帶來影響。
對實驗所用Ti片襯底進行物相識別發現,Ti片襯底在Search-Match上的衍射峰與編號為44-1294的PDF卡片匹配得很好,而該PDF卡片為數據庫中質量良好的Ti元素物相,所以基本可以確定Ti片襯底就是Ti的純相。此外,因為該實驗選取Ti片作為背底,為了避免樣品覆蓋背底不均勻,在進行X-射線衍射時引入新的變量,也將進行Ti片的測量。
如圖6中,在反應時間分別為20 h(A組)與40 h(B組),尿素含量分別為0,0.8,1.6,2.4時,TiO2特征峰基本與標準峰匹配,但隨著尿素含量的增加,20~30附近缺少了一個衍射峰,當尿素含量為1.6~2.4 g時該衍射峰基本消失,且隨著時間的增加,20~30更加明顯。由此可以推測,尿素含量對TiO2納米線的衍射峰位有影響,隨著尿素含量的增多,TiO2納米線的衍射峰位不再和標準TiO2衍射峰一致[12]。
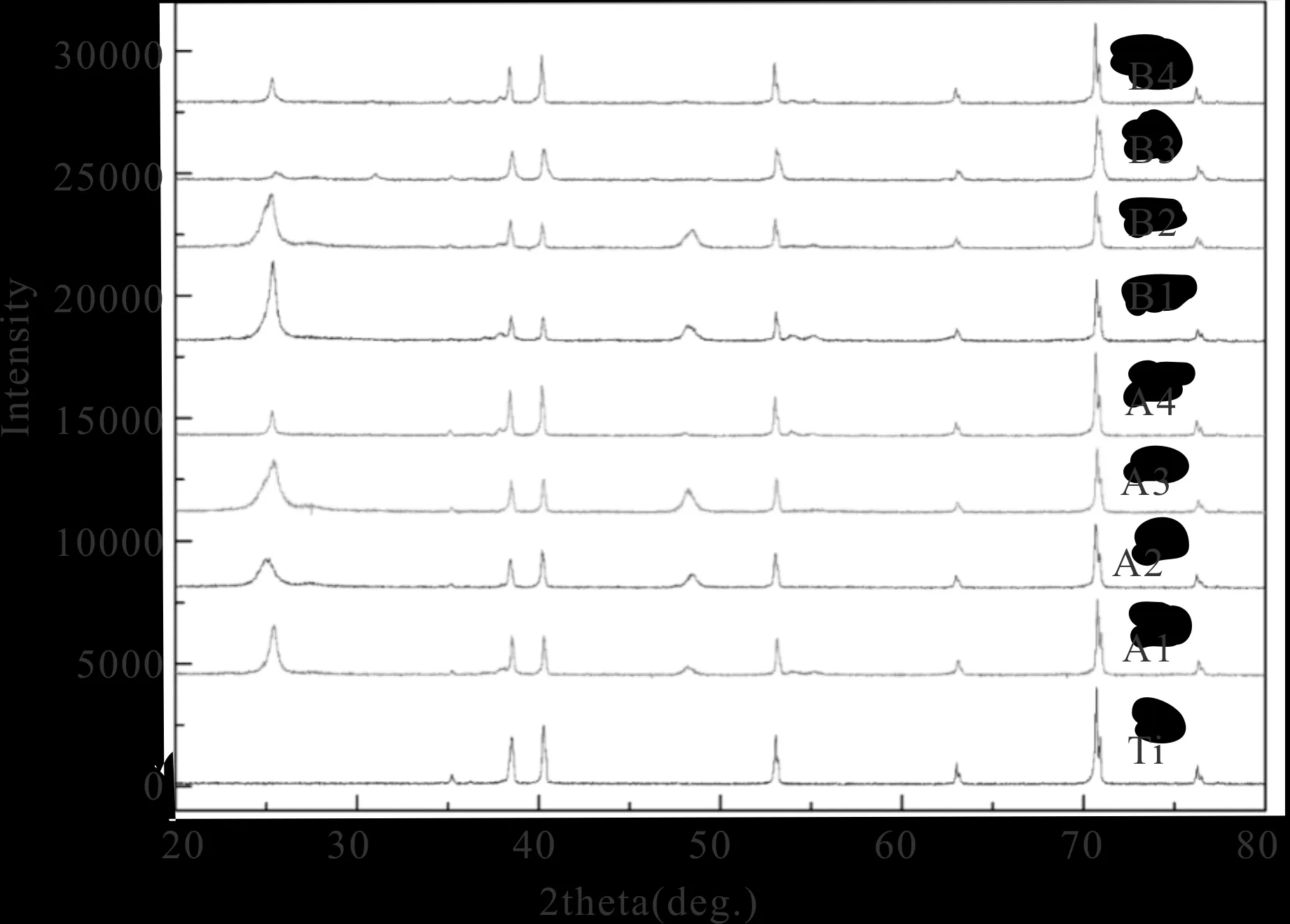
圖6 不同尿素含量下TiO2的物相識別
由此,可以推測尿素含量對TiO2的有抑制作用,隨著尿素含量的增多,納米材料中TiO2的含量不斷減少,如果一直增加尿素含量,可能TiO2的含量會越來越少,衍射峰也不再能對應。
4 結論
水熱法的燒結溫度、反應溫度、反應時間等都會引起產物的性質的改變。當反應時間一樣時,TiO2薄膜的結晶性隨著尿素含量增加而提高;在尿素含量達到2.4g時, 鈦膜表面出現很多尖錐狀的鈦晶粒,表現出很好的結晶性能, TiO2的團聚程度越大,同時薄膜致密度明顯提高。而在尿素含量一樣的情況下,TiO2的長度隨著反應時間的增加而增加。根據XRD譜圖,可以看出尿素含量對TiO2的有一定抑制作用,隨著尿素含量的增多,納米材料中TiO2的含量不斷減少,如果一直增加尿素含量,可能TiO2的含量會越來越少,衍射峰也不再能對應。

