CRISPR/Cas9系統及其在糧油作物遺傳改良中的研究進展
高忠奎,蔣 菁,韓柱強,黃志鵬,熊發前,唐秀梅,吳海寧,鐘瑞春,劉 菁,唐榮華,賀梁瓊
(1廣西農業科學院科研基地管理處,南寧 530007;2廣西農業科學院經濟作物研究所,南寧 530007)
0 引言
隨著測序技術迅猛發展,越來越多作物物種完成了基因組測序,單個基因功能研究以及多個基因協同調控作用研究成為新的研究熱點,作物育種學已經進入基因組輔助育種階段。基于CRISPR/Cas9系統的基因組編輯技術是近年分子生物學界的熱點,利用此技術進行遺傳改良是當前作物遺傳育種研究的最前沿,了解相關研究動態和進展,對遺傳育種工作者如何利用該技術進行精準遺傳改良和品種選育具有重要意義。自1987 年石野良純在大腸桿菌中發現“重復-居間序列(spacer)-重復”序列[1],到2007 年在實驗上首次證實CRISPR-Cas是一種細菌獲得性免疫系統[2],再到2012 年CRISPR/Cas9 基因編輯技術基本成型[3],短短幾十年,這一領域的研究發展日新月異、不斷取得新突破,使其以高效的敲除效率、簡單的操作、位點選擇的寬泛性、廣泛的物種適應性及實驗周期短等優勢,成為目前基因組編輯領域最受歡迎的新方法[4],為作物真正實現基因組輔助育種提供了確實有效的手段。2020年,高彩霞研究團隊用一種優化過的引導編輯系統(prime editing system,PPE),在原生質體中的9 個水稻位點和7個小麥位點上產生了所有12種類型的單堿基替換,以及多種點突變和小DNA 片段插入,編輯效率最高可達19.2%,成功獲得了單堿基突變、多堿基突變及精準刪除的水稻突變體植株,突變效率最高可達21.8%,這些突變均難以通過現有的基因編輯系統實現,這一新突破極大地擴展了植物基因組編輯范疇,為植物基因組功能解析及實現作物精準育種提供了重要技術支撐[5]。相比傳統的轉基因技術,基于CRISPR/Cas9系統的基因組編輯技術,其表達載體插入的位點與基因編輯的位點不同,外源插入質粒待基因編輯完成后,可在后代配子形成過程中染色體分離時被去除,不需要引入外源基因,無轉基因爭議,成為近年分子生物學界的熱點研究領域[6],應用前景十分廣闊。此外,利用CRISPR/Cas9技術已培育出具有優良性狀的糧油作物新品系,這些性狀包括產量(水稻千粒重、單粒重)、品質(水稻香型、糯性,大豆多根瘤)、抗病性(水稻稻瘟病、小麥白粉病)等重要性狀[7-11]。因此,為了充分認識CRISPR/Cas9基因組編輯技術及其在糧油作物中的研究進展,本文對CRISPR/Cas 系統的基本原理、作用機制以及在糧油作物遺傳改良研究中取得的成績進行了梳理,助力CRISPR/Cas9 基因組編輯技術在糧油作物遺傳改良和品種優化升級中得到更好、更快的應用。
1 CRISPR/Cas系統發展歷程及分類
1987年,日本科學家石野良純在對大腸桿菌的堿性磷酸酶同工酶(alkaline phosphatase isozyme, iap)進行測序時,意外發現終止密碼子后的非編碼區存在一些異常重復序列,這些序列在原核生物如細菌的DNA利用率較高,且具有“重復-居間序列(spacer)-重復”這一排列特征[1]。同時期西班牙莫伊察在一種嗜鹽古菌(Haloferax mediterranei)中也發現了具有“重復-居間序列-重復”特征的序列,莫伊察在后續研究中發現這種序列在微生物中非常普遍,將其命名為短規律間隔重復(short regularly spaced repeat, SRSR)[12-13]。2002 年,荷蘭科學家詹森進一步發現這種短規律間隔重復特殊結構存在于多個微生物(原核生物)中,不同物種的重復序列堿基數存在差異,并將這種結構重新定義為成簇規律性間隔短回文重復(clustered regularly interspaced short palindromicrepeat, CRISPR),他還發現CRISPR 序列附近還存在多個編碼序列,將其定名為CRISPR 相關基因(CRISPR- associated gene,Cas)[14]。法國微生物學家巴蘭古、霍瓦特利用P1、P2 2株噬菌體侵染鏈球菌(細菌),在實驗上首次證實CRISPR-Cas 是一種細菌獲得性免疫系統[2]。2012 年Jinek 等研究發現,CRISPR-CasⅡ系統中的Cas9 是個核酸酶,這個核酸酶結合2 個RNA(crRNA,tracrRNA)便能切割雙鏈DNA[15],并進一步弄清了RNA 和靶DNA 配對的原則,闡明了CRISPR-CasⅡ系統的作用機制,至此,CRISPR/Cas9這個新型基因組定向編輯系統基本成型[3](見圖1)。
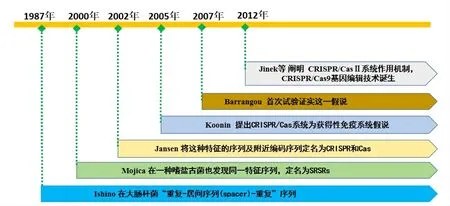
圖1 CRISPR/Cas9系統發展時間線
根據CRISPR-Cas 系統的結構和分子機制將該系統分為3 類,即Ⅰ系統、Ⅱ系統和Ⅲ系統,其中Ⅰ系統和Ⅲ系統具有一定的共性:都是pre-crRNA 被特定的Cas 核酸內切酶加工成為成熟的crRNA,crRNA 與多個Cas蛋白構成復合體后,再對靶基因進行剪切,實現基因組的定點編輯;在基因編輯過程中,由于需要多個Cas 蛋白參與,使得CRISPR-CasⅠ系統和Ⅲ系統極難被 應 用。CRISPR-Cas Ⅱ系 統 中,pre-crRNA 在tracrRNA(trans-activating crRNA,反式激活crRNA)、Cas9 蛋白和RNA 酶III 共同參與下產生成熟的crRNA,tracrRNA 與crRNA 形成特殊二級結構并與1個Cas蛋白構成復合體后,對靶基因實施剪切;相對于Ⅰ系統和Ⅲ系統,Ⅱ系統在基因編輯過程中,只需要2種RNA(crRNA和tracrRNA)和1個Cas蛋白參與,系統更為簡單好利用[16]。
2 CRISPR/Cas9 系統的作用機制及優化
CRISPR/Cas9 系統基于Ⅱ系統,是目前用于基因組定向編輯的最主要類型。經典的CRISPR/Cas9系統由tracrRNA、crRNA、Cas9蛋白和RNA酶III構成的復合體以及相應的靶基因組成,靶基因中包含1 個由幾個堿基構成的前間區序列鄰近基序(protospacer adjacent motif, PAM),用于標記外源基因并指示系統的剪切位點。CRISPR/Cas9系統的作用機制是crRNA通過堿基配對與tracrRNA 結合形成特殊的tracrRNA/crRNA 發卡結構即單一向導RNA(small guide RNA),sgRNA 引導內切酶Cas9 蛋白形成sgRNA-Cas9 復合體,識別靶基因的PAM 序列后完成與靶基因結合,并對靶位點DNA實施剪切、產生DNA雙鏈斷裂[17-18]。在修復過程中,利用細胞的非同源性末端連接(Nonhomologous end joining, NHEJ) 或 同 源 重 組(Homologous recombination, HR)修復機制對斷裂的DNA 進行插入缺失(Indel)、修復(Repair)或替換(Replacement),從而實現對動、植物基因組中的靶位點進行定點敲除、插入、替換、點突變等操作[19-20]。
但由于CRISPR/Cas9系統依賴間隔區序列與目標基因序列的堿基互補配對識別外源入侵DNA,對目標DNA的匹配程度具有一定的容忍度,允許個別堿基錯配。在基因編輯過程中,CRISPR/Cas9 系統的這一特點,導致基因組中與目標DNA只有較少堿基差別的其他DNA 也可能會被切割,稱為脫靶現象,脫靶現象的存在很大程度上阻礙了該技術在生產實踐中的應用。為了降低編輯過程中的脫靶效應,更好的實現基因組編輯,科學家們對CRISPR/Cas9 系統進行了優化和改進:(1)將sgRNA 和Cas9 蛋白構建到同一個表達載體上,簡化并提高系統的轉化效率[17-18]。(2)開發使用脫靶效應評估方法和更優的sgRNA設計軟件,使用精確匹配度高的sgRNA(20 個核苷酸長度)和PAM 序列,降低脫靶率[21-23]。(3)通過篩選和改造Cas9 蛋白,比如對Cas9 蛋白的HNH 和RuvC 2 個切割元件進行優化、使用增強型化膿鏈球菌Cas9蛋白突變體(eSpCas9)等,以減弱脫靶效應、提高CRISPR/Cas9 系統剪切效率和精準性[24-26];比如金黃色葡萄球菌(Staphylococcus aureus)的Cas9 核酸酶(SaCas9)基因改造后獲得的新變體SaCas9-HF,與野生型Cas9 相比,SaCas9-HF 平均在靶編輯效率為80%,對于通常具有較少編輯失誤的基因序列,SaCas9-HF具有幾乎無法檢測到的脫靶活性[27];Benjamin P.Kleinstiver研究團隊對SpCas9蛋白進行改造升級獲得的新突變體SpRY,識別的PAM 序列涵蓋NRN和NYN(Y為C/T)(NRN>NYN),幾乎完全放松了Cas9 對識別PAM 的要求,從而實現不需要特定PAM 就可結合和切割DNA 的目標,解決了CRISPR/Cas9 系統不能靶向不位于PAM 附近的基因位點這一困擾[28]。
3 CRISPR/Cas9 基因編輯技術在糧油作物遺傳改良中的研究進展
作物品種改良的關鍵是對農藝性狀進行改良以達到高產、高品質、抗逆等育種目標,通過傳統育種途徑改良作物品種,存在遺傳背景復雜、不良性狀連鎖、性狀穩定速度緩慢、費時耗力等劣勢,育種效率低;分子標記能夠對許多控制重要農藝性狀的基因進行定位,相對快速的實現作物品種改良,但很難實現對目標性狀進行定向改造,CRISPR/Cas9 系統卻能解決這一技術難題。隨著生物信息分析平臺和相應數據庫的廣泛建立,CRISPR/Cas9基因編輯技術利用反向遺傳學、配合高通量測序,能有目的地選擇一些有價值的等位基因進行高效定點編輯。自2013 年CRISPR/Cas9 技術被用于進行植物基因組定點編輯研究以來,該技術已在水稻、小麥、大麥、玉米、大豆、油菜、花生等糧油作物突變體創制、性狀改良等方面得到廣泛應用。
3.1 CRISPR/Cas9基因編輯技術在糧食作物遺傳改良中的研究進展
3.1.1 在水稻遺傳改良中的研究進展 水稻是重要的糧食作物,也是重要的單子葉模式植物,CRISPR/Cas9系統在水稻基因編輯改良中操作相對容易,并在水稻基因功能研究、突變體創制、品種遺傳改良方面表現出巨大的潛力。2013 年Feng 等[29]利用CRISPR/Cas9 技術對 擬 南 芥BRI1、JAZ1、GAI和 水 稻 的ROC5(Rice Outermost Cell- specific gene5)、SPP(Stromal Processing Peptidase)、YSA(Youg Seedling Albino) 3 個基因為靶位點進行編輯,均獲得了純合或雙等位基因突變體,且這些突變體之間差異顯著,這是世界上首次關于成功利用CRISPR/Cas9技術對水稻進行基因編輯的報道,證實該技術不僅能對模式植物擬南芥、還能對其他作物如水稻的基因位點進行定點編輯。同年,Shan 等[30]利用CRISPR/Cas9 技術,也成功對水稻控制籽粒形狀和分蘗的TaGASR7、TaDEP1基因進行了定點編輯,并獲得純合敲除突變體,與野生型表型相比,突變體株高降低、千粒重和分蘗數明顯增加,進一步證實該技術在水稻基因定點編輯方面的可行性。從此,在水稻中掀起了利用CRISPR/Cas9系統進行基因編輯的研究熱潮,并不斷獲得創新,使水稻成為農作物中利用該技術的模式植物,并且,中國在這一方面已經走在了世界前沿。
沈蘭等[7]以控制粒型基因GS3和控制每穗粒數基因Gn1a為靶基因,利用CRISPR/Cas9 技術,通過農桿菌介導法對4 個優質水稻品種的靶基因進行編輯,在T0代獲得gs3和gs3gn1a突變體,突變體粒長變長、千粒質量增加,T1代突變體株系除了目標性狀得到改良外,其他性狀未受到明顯影響;同年,又對水稻品種‘日本晴’8個農藝性狀基因的位點敲除成功,獲得了具有多基因突變組合的突變體[31]。周文甲等[32]以水稻抽穗期基因Hd2、Hd4和Hd5及香味基因Bath2為靶基因,進行定點編輯,在T0代便獲得編輯成功的突變植株、T1代分離出無轉基因成分且編輯成功的株系,經田間抽穗調查和香味物質測定,突變株系早熟且帶有香味;邵高能等[8]也對香味基因Badh2進行編輯,在T1代獲得香味物質顯著增加的突變體單株,在T2代便獲得了分蘗數和結實率顯著差異、其他性狀沒發生顯著改變的香型株系。吳明基等[33]通過CRISPR/Cas9 系統,對可育水稻品種中間材料GH89的TMS5基因(tms5為溫敏不育基因)進行編輯,獲得純合突變株和雙等位突變株,快速成功創制了水稻溫敏核不育系。馮璇等[34]以水稻優良保持系209B為材料,對水稻直鏈淀粉合成主效基因Wx位點進行定點編輯,T0代Wx位點純合缺失突變率達26.9%,T1代純合突變體直鏈淀粉含量顯著降低、糯性品質優良、其他性狀沒發生顯著改變,成功將高產的非糯性品系Wx209B 轉為糯性品系WX209B,并轉育糯稻不育系WX209A。王子璇等[35]對水稻成花素家族成員OsDTH11基因進行敲除,成功獲得了該基因62 bp缺失、31 bp缺失的2種類型且能穩定遺傳的純合突變體材料。范美英等[36]利用CRISPR/Cas9 技術以Wx為靶基因,遺傳改良優質粳稻‘秀水134’,發現45個轉基因株系中有41個株系發生靶定位置堿基修改,突變率達到91.1%,并獲得了糯稻新材料。徐鵬等[10]利用該技術對水稻稻瘟病相關基因Pita、Pi21和ERF922進行定點編輯,獲得Pi21單突變純合株系及Pita、Pi21和ERF922的三突變純合株系,突變株系的稻瘟病抗性顯著提高,獲得了能夠穩定遺傳的抗稻瘟病水稻材料。還有高彩霞研究團隊利用CRISPR/Cas9改良后的PPE 編輯系統,在原生質體中的9 個水稻位點產生了所有12種類型的單堿基替換,以及多種點突變和小DNA 片段插入,成功獲得了單堿基突變、多堿基突變及精準刪除的水稻突變體植株[5]。
以上研究成果表明,自2013 年以來,水稻的CRISPR/Cas9編輯系統已不斷趨近成熟,能夠快速、準確對水稻每穗粒數基因、抽穗基因、香味基因、控制糯性基因、溫敏不育基因等各種功能性基因位點進行定點編輯,并能在短時間內獲得能進行穩定遺傳的突變植株和目標突變株系,大大縮短了水稻育種進程,提高了水稻育種效率,使水稻定向育種成為可能。
3.1.2 在小麥遺傳改良中的研究進展 小麥是異源多倍體,基因組龐大(17 Gb)、重復性高、遺傳結構復雜,導致利用CRISPR/Cas9 系統對小麥基因組進行定點編輯、實現遺傳改良相對比較困難。高彩霞課題組率先實現利用CRISPR/Cas9系統對小麥特定基因進行定點突變,且在小麥基因組編輯方面一直處于國際領先水平。該課題組成員Shan 等利用CRISPR/Cas9 技術對控制小麥籽粒形狀和分蘗的基因TaGASR7、TaDEP1進行定點編輯,原生質體突變效率達到14.5%~38.0%,首次實現了該技術對小麥基因的定點編輯[30]。課題組成員王延鵬等報道以六倍體小麥抗白粉病相關基因TaMLO單拷貝設計靶位點,利用CRISPR/Cas9技術對小麥原生質體進行定點編輯,成功在A基因組定點插入能穩定遺傳的片段,表明該技術不僅可以同時突變多倍體小麥中的多個拷貝,也能特異突變單個基因拷貝[37]。2016 年,依然是該團隊的Zhang 等繼續對未成熟胚細胞的TaMLO位點進行編輯,T0代獲得突變體材料,并在后代分離出沒有任何轉基因成分的突變體植株;2017 年,Zhang 等又對小麥EDR1基因的3 個同源基因同時進行敲除,在T1代便獲得了沒有任何可檢出轉基因成分的突變體材料,突變體植株對白粉病具有很好的抗性,進一步證實了CRISPR/Cas9 技術能對多倍體小麥進行定點編輯的可行性和有效性[9,38]。杜麗君等[39]以TaMOC1基因為靶位點,利用農桿菌將表達載體pBUE411-TaMOC1-Cas9 轉移到野生型小麥品種‘科農199’的幼胚中,確定了TaMOC1對小麥分蘗的作用,并獲得TaMOC1的轉基因植株,但pBUE411-TaMOC1-Cas9 轉化效率僅為1.6‰。高彩霞研究團隊Liang 等 利 用CRISPR/Cas9 ribonucleoproteins(RNPs核糖核蛋白)技術對面包小麥的TaGW2TaGW2和TaGASR7基因進行編輯,同時與pGE-TaGW2 技術進行對比,原生質體突變效率從35.6%~41.2%降低到21.8%~33.4%、脫靶率從30.8%降至5.7%,未成熟胚細胞編輯效率從0.99%~1.00%降低到0.18%~0.21%、脫靶率從0.76%降至0.03%,雖然編輯效率有所降低、但同時更大幅度的降低了脫靶率;對獲得的T0代植株基因位點的突變率進一步跟蹤,gw2-RNPs 與pGETaGW2 兩種技術的突變率分別為4.4%和4.7%,突變效率相當,實驗結果表明CRISPR/Cas9 RNPs 技術不僅能完全消除CRISPR/Cas9體系質粒片段整合到目的基因,還能大幅度降低脫靶率、快速(7~9周內)獲得不含任何外源基因的目標突變體,從而為更有效的利用CRISPR/Cas9編輯技術研究小麥基因功能以及定向培育新品種提供了新方法[40-41]。2020 年,該研究團隊用一種優化過的CRISPR/Cas9 引導編輯系統(prime editing system,PPE),在原生質體中6個小麥位點上產生了所有12種類型的單堿基替換,以及多種點突變和小DNA片段插入,這些突變均難以通過現有的基因編輯系統實現[5]。以上研究結果表明,因為小麥是異源多倍體(六倍體居多)、基因組龐大,利用CRISPR/Cas9技術進行定點編輯時效率很低,但隨著對系統的不斷改進和優化,使其在短時間內成功獲得純合的、能穩定遺傳的目標突變株系成為可能。

表1 CRISPR/Cas9技術在水稻遺傳改良中的研究進展
3.1.3 在玉米遺傳改良中的研究進展 在玉米方面,Liang等在玉米原生質體中,成功利用CRISPR/Cas9基因編輯技術對玉米磷酸激酶ZmIPK內2個不同位點進行編輯,這是玉米方面利用此技術最早的報道,但未獲得 再 生 植 株[42]。2015—2016 年,Svitashev 等 利 用CRISPR/Cas9 技術,以乙酰乳酸合成酶基因ALS2為靶基因,通過基因槍轟擊法,將CRISPR-Cas9-ALS2-gRNA 復合物轉入玉米未成熟胚細胞,成功實現了對基因ALS2的定點編輯,并指出利用該技術可以高效地獲得玉米基因編輯再生植株[43-44]。Feng 等[45]以玉米Zmzb7基因為靶基因,利用農桿菌將特異的CRISPRCas9-gRNA質粒侵染轉化玉米未成熟胚,實現了基因定點編輯,突變率達19%~31%。2017 年,Char 等[46]利用農桿菌轉移CRISPR/Cas9 編輯系統,成功對玉米4個基因ZmAgo18a、Zm-Ago18b、Zm-Ago a1和a4實現高效靶基因突變,并獲得了突變植株。Li 等[47]利用特異RNA介導CRISPR/Cas9誘變系統,對玉米無葉舌基因LG1進行編輯,T0植株代中突變效率達到51.5%~91.2%,分別以突變體和野生型作為親本進行雜交育種,突變體作為親本的雜交玉米葉夾角生長角度更小。Chen 等[48]報道利用CRISPR/Cas9 技術編輯玉米雄性不育基因MS8,T0代獲得了8個轉基因株系,突變株系基因組分析結果表明MS8基因并沒有發生突變,而是其他位點發生了單堿基突變,突變性狀能穩定遺傳給后代,獲得新的無外源轉基因污染的(Transgene-Free)的玉米雄性不育系品系。
3.2 CRISPR/Cas9 基因編輯技術在油料作物遺傳改良中的研究進展
與水稻、小麥、玉米等糧食作物相比,受遺傳轉化效率低、缺乏通量載體等因素的影響,利用CRISPR/Cas9 技術在花生、大豆、油菜等油料作物中的研究進展相對比較落后,特別是在花生這一作物中,相關報道很少,He 等利用CRISPR/Cas9 技術、以花生毛狀根為材料,對FAD2基因成功進行了定點編輯,但并沒有成功獲得相應的突變體植株[49]。
3.2.1 在大豆遺傳改良中的研究進展Li等[50]采用粒子轟擊轉化法,將CRISPR/Cas9載體和供體DNA共轉化到大豆胚愈傷組織中,在大豆中實現了靶位點突變和基因插入,其中DD20和DD432個基因位點的突變頻率分別達到59%和76%,并且通過編輯大豆ALS1基因成功獲得了氯磺隆抗性轉基因大豆。Cai 等[51]利用CRISPR/Cas9 技術,首次應用農桿菌介導大豆子葉節遺傳轉化體系,對大豆光周期調節基因3 個不同靶位點進行靶向突變,結果證實T1代大豆植株在自然光周期下發生晚花現象,T2代大豆純合體在長、短日照下均呈現出晚花表型;并從T1/T2代大豆植株中鑒定出一批不含有轉基因元件的純合突變體,成功創制出穩定遺傳的大豆突變體材料,為深入研究GmFT2a基因的功能以及大豆育種提供了全新材料。以大豆子葉節為遺傳轉化體,不僅提高了獲得突變植株的幾率,還縮短了獲得突變體植株的時間,為有效利用CRISPR/Cas9 技術進行大豆基因定點編輯具有非常重要的意義,后續研究人員基本上都是用大豆子葉節為轉化體進行相關方面的研究,且成效顯著。候智紅等[52]以大豆‘華夏3號’為材料,利用CRISPR/Cas9技術對控制油酸轉化為亞油酸的關鍵酶基因FAD2-1A外顯子區進行靶向編輯,T1代獲得純合的GmFAD2-1A突變體,純合突變體種子油酸含量達23%,顯著高于‘華夏3 號’,但株高、葉形、花色、種皮色、生育期等其他性狀均無顯著差異,進一步證實FAD2-1A基因是油酸代謝過程中的關鍵基因,并獲得了穩定純合的株型健壯、豐產性突出、綜合抗性好、油酸含量高的GmFAD2-1A突變體植株。吳艷等[53]利用CRISPR/Cas9 基因編輯技術,對大豆GmSPL3家族基因進行編輯,將pYL CRISPR/Cas9-GmSPL3-gRNA 載體轉化到根癌農桿菌中,侵染大豆子葉節獲得spl3abcd突變體,并與野生型表型進行對比,表明GmSPL3在調控大豆植株形態方面發揮重要功能。柏夢焱等[11]為研究豆科作物結瘤自我調節機制的作用機理,運用CRISPR/Cas9 基因編輯技術創制大豆品種‘華春6 號’超結瘤gmnark基因,獲得了超結瘤、矮小和葉片深綠的突變體材料。以往研究結果表明,雖然花生與大豆都是豆科作物和油料作物,但是相對于花生,利用CRISPR/Cas9系統在大豆突變體創制、遺傳改良方面要成熟得多,為利用此系統進行大豆定向育種提供了強有力的技術支撐,也為花生提供了有效的參考。

表2 CRISPR/Cas9技術在小麥和玉米遺傳改良中的研究進展
3.2.2 在油菜遺傳改良中的研究進展 在油菜方面,成功利用此CRISPR/Cas9系統進行基因定點編輯的最早報道是在2017年,Yang等[54]對油菜的BnCLV基因進行定點編輯,用不同的sgRNA 序列產生的突變頻率為0%~48.5%不等,證實sgRNA 對CRISPR/Cas9 編輯效率的重要性,同時也證實了BnCLV基因對控制油菜的每莢粒數和重量具有重要作用。Sun等[55]利用該技術對BnWRKY11的2 個位點和BnWRKY70的4 個位點進行 編 輯,T0代 獲 得 的22 株BnWRKY11和8 株BnWRKY70轉化植株中,基因位點發生突變的分別有12株和4株,突變率分別為54.5%和50%,對T2植株繼續跟蹤,BnWRKY70位點發生突變的植株對菌核病的抗性增加、BnWRKY11發生突變的植株沒有明顯效果,從而推斷出BnWRKY70基因可能與調控油菜菌核病抗性有關。Zhai等[56]對油菜的BnIND和BnALC2個基因進行定點編輯,在T0代獲得的251 株BnIND和269株BnALC轉化植株中,分別有202 株和206 株的基因位點發生了插入突變,突變率分別為80.5%和76.6%,對純合的T2BnIND突變植株繼續研究,結果表明BnIND基因可能與油菜抗裂莢有關,獲得了能穩定遺傳的、抗裂莢的純合突變體株系,抗裂莢一直是油菜育種的瓶頸之一,很難通過普通育種方法得到改良,利用CRISPR/Cas9技術卻在短時間內攻克了這一困擾油菜育種多年的難題。因此,CRISPR/Cas9 系統為油菜基因功能研究、高效定向培育新品種等方面提供了可靠而有效的新途徑。
4 小結與展望
CRISPR/Cas9 系統原理簡單,自2013 年誕生以來便得到了迅速發展和應用,是目前基因組編輯領域最受歡迎的新方法,操作簡單、周期短、位點選擇多,并且隨著科技人員不斷努力、技術日益創新,如何提高編輯效率、降低脫靶率等難題也不斷得到了解決,能夠實現對水稻、小麥、玉米、大豆、油菜等糧油作物的靶基因進行定向精準編輯。此外,通過該系統獲得的轉基因植株,通過傳代,可以分離獲得沒有轉基因片段、且能穩定遺傳的突變株系及品種,不會產生類似由轉基因引發的可能影響物種進化、食品安全等方面的不利因素,有利于利用CRISPR/Cas9基因組編輯技術改良后的糧油作物品種規模化、商業化生產,還能高效、定向改良某些性狀(傳統育種方法難以改良)從而育成目標新品種,所有這些都使該系統成為糧油作物及其他物種基因組編輯最熱門的新手段。但是,CRISPR/Cas9 系統在糧油作物遺傳育種上的利用效率很大程度上依賴作物本身功能基因的解碼、轉化體系的建立以及編輯效率的高低,因此,解決這些難題是加大應用該系統進行作物遺傳改良、定向育種的關鍵。

表3 CRISPR/Cas9技術在大豆、油菜和花生遺傳改良中的研究進展

