抗菌肽HBβ-C在全雄和雜交黃顙魚對多子小瓜蟲抗性差異中的作用
熊 陽 王 帥 丹 成 張義兵 梅 潔
(1. 華中農業大學水產學院, 武漢 430070; 2. 中國科學院水生生物研究所, 武漢 430072)
黃顙魚(Pelteobagrus fulvidraco)是我國一種重要的淡水經濟魚類, 肉質鮮美, 無肌間刺, 營養價值高, 深受廣大消費者的喜愛。在相同的養殖條件下,雄性黃顙魚在養殖第二年的生長速度是雌性的1.5—2倍, 培育全雄黃顙魚能夠顯著提高養殖產量和經濟效益[1]。中國科學院水生生物研究所桂建芳課題組和華中農業大學梅潔課題組開發出了性染色體特異的性別標記, 并建立了一條X和Y染色體連鎖標記輔助的全雄魚培育技術路線[2—6], 推動黃顙魚產業的迅速發展。近年來, 由于YY超雄魚多代自交退化及在親本培育過程中遇到一些問題, 制約了全雄黃顙魚產業的發展[7], 需要進行品種改良或培育新品種。雜交黃顙魚(黃顙魚Pelteobagrus fulvidraco♀×瓦氏黃顙魚Pelteobagrus vachelli♂)形態特征與黃顙魚相近, 且其生長速度明顯優于黃顙魚。華中農業大學等多家單位和企業進行聯合育種研究, 采用傳統選育和雜交育種的方法, 培育出了水產新品種雜交黃顙魚“黃優1號”(GS-02-001-2018)[8]。育種技術的創新和新品種的培育推動了黃顙魚產業的持續發展, 2019年我國黃顙魚養殖產量高達5.37×108kg, 成為發展速度最快的特色淡水魚之一[9]。
近年來, 由多子小瓜蟲(Ichthyophthirius multifiliis)引起的小瓜蟲病(又稱白點病)成為黃顙魚養殖常見的疾病之一, 給我國黃顙魚養殖業造成巨大的經濟損失。多子小瓜蟲沒有嚴格的宿主專一性,能感染絕大部分淡水魚類, 如斑點叉尾鮰(Ictalurus punctatus)、虹鱒(Oncorhynchus mykiss)、泥鰍(Misgurnus anguillicaudatus)、鯉(Cyprinus carpio)、尼羅羅非魚(Oreochromis niloticus)、赤眼鱒(Squaliobarbus curriculus)和鳙(Hypophthalmichthys nobilis)等經濟魚類均易受到感染[10—16]。刺激隱核蟲(Cryptocaryon irritans; 又稱為海水小瓜蟲)引起的白點病已成為大范圍、經常暴發的傳染性疾病, 給海水魚養殖也造成巨大的經濟損失, 大部分海水養殖魚類如斜帶石斑魚(Epinephelus coioides)、卵圓鯧鲹(Trachinotus blochii)和大黃魚(Pseudosciaena crocea)等均容易感染刺激隱核蟲[17—19]。小瓜蟲病的防治目前仍是國際性的難題。
魚類的皮膚黏液作為抵御寄生蟲感染的第一道重要屏障, 含有諸多抑殺病原的活性物質如免疫球蛋白、轉鐵蛋白、補體、凝集素和抗菌肽等[20]。黃斑藍子魚(Siganus oramin)等極少數魚類具有天然抗刺激隱核蟲(Cryptocaryon irritans)的能力[21],其皮膚黏液蛋白對多子小瓜蟲和刺激隱核蟲均有殺傷效果[22]。魚類的鰓和皮膚作為分泌皮膚黏液的主要器官, 有學者在其中發現了一個抗菌肽(位于血紅蛋白β鏈HBβ C端的肽段)具有抗多子小瓜蟲的效果[23]。最近, 通過蛋白質組技術發現HBβ存在于黃顙魚皮膚黏液中, 其表達量在鲇愛德華氏菌感染后明顯上升[24], 說明HBβ可能具有抗菌功能。據多數養殖戶反映, 全雄黃顙魚和雜交黃顙魚對多子小瓜蟲的敏感程度存在明顯差異。為解析全雄黃顙魚與雜交黃顙魚對多子小瓜蟲抗性差異的分子機制, 本研究系統地比較了全雄黃顙魚、雜交黃顙魚和瓦式黃顙魚對多子小瓜蟲的抗性差異, 檢測了HBβ基因在全雄黃顙魚和雜交黃顙魚免疫相關組織中的表達差異, 研究了人工合成黃顙魚抗菌肽(HBβ C端的肽段, HBβ-C)體外的殺蟲效果, 旨在為黃顙魚多子小瓜蟲病的防控提供技術保障。
1 材料與方法
1.1 實驗魚
全雄黃顙魚(4.43±0.45) g、雜交黃顙魚(6.07±0.64) g和瓦式黃顙魚(8.65±1.18) g在武漢百瑞生物技術有限公司循環水養殖系統暫養2周。在暫養期間, 隨機選取全雄黃顙魚、雜交黃顙魚和瓦式黃顙魚各10尾在光學顯微鏡下對鰓、鰭條和皮膚黏液進行仔細檢查, 均未見小瓜蟲等寄生蟲。
1.2 小瓜蟲的培養及其滋養體、包囊體和掠食體的分離
采用張其中等[25]報道的方法分離小瓜蟲的滋養體、包囊體和掠食體, 用于體外攻毒試驗。將已感染小瓜蟲的赤眼鱒與雜交黃顙魚飼養于同一循環水箱中進行平行感染維持實驗所需的小瓜蟲。首先用200 mg/L MS-222 (甲基磺酸三胺)將嚴重感染的雜交黃顙魚麻醉, 然后用干凈的細胞刮刀從魚皮膚和鰭條上取出包裹著囊泡的滋養體, 反復清洗多次后, 直至去除大部分黏液, 將干凈滋養體放置裝有養殖系統水的培育皿中用于體外抗蟲試驗和形成包囊體。滋養體在20℃下約10min停止游動吸附在培育皿底部, 形成一層透明的薄膜形成包囊體,蟲體在內旋轉運動并以二分裂的形式分裂形成子體, 約20h后成熟并釋放出400—600個具有感染性的掠食體, 收集后用于抗蟲試驗。
1.3 小瓜蟲人工感染試驗及樣品收集
在暫養2周后, 將健康的全雄黃顙魚、瓦式黃顙魚和雜交黃顙魚分別隨機分為對照組和感染組置于90 L水箱中, 水溫保持在(20±1.0)℃, 溶解氧≥6 mg/L以上。每組3個平行, 每個平行隨機放入65尾魚。此外, 添加一組混合感染組即全雄黃顙魚和雜交黃顙魚各32尾, 通過分別剪左右腹鰭進行物理辨別。參照Clark等[26]方法進行小瓜蟲人工感染實驗, 3尾已被平行感染的雜交黃顙魚與每個感染組共棲息在同一個養殖缸中, 而對照組則不放入受感染的魚, 其他養殖環境相同。在試驗期間, 及時清理死魚以免污染水質, 記錄其感染情況并統計每個組合死亡率。在感染的第5天, 每個組合分別從3個平行魚箱中各取5尾魚, 用200 mg/L MS-222 (甲基磺酸三胺)麻醉后, 分別取部分皮膚和鰓組織固定在4%多聚甲醛24h, 用于免疫組化和病理學分析;而另取部分組織用液氮處理后轉移置-80℃冰箱保存, 用于血紅蛋白β鏈基因的組織表達分析。
1.4 黃顙魚血紅蛋白源抗菌肽HBβ-C生物信息學分析及化學合成
前期我們通過蛋白質組技術比較鲇愛德華氏菌感染前后黃顙魚皮膚黏液蛋白質的表達變化[24]。本實驗通過本地blastall程序將黃顙魚黏液蛋白質組所有肽段序列與抗菌肽數據庫(http://aps.unmc.edu/AP/APD3_update2020_release.fasta)進行比較分析確定抗菌肽位置。使用以下軟件和工具對血紅蛋白源抗菌肽HBβ-C進行分析: Clone Manager軟件對黃顙魚血紅蛋白β鏈基因序列進行分析, 確定其開放閱讀框(ORF); DNAMAN 7.0軟件進行氨基酸序列分析; BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)進行核苷酸和氨基酸序列相似性分析。利用HeliQuest工具(https://heliquest.ipmc.cnrs.fr)進行抗菌肽HBβ-C進行氨基酸電荷和疏水性分析。以硬骨魚Leiostomus xanthurus的血紅蛋白β鏈(蛋白數據檢索號1spg.1.B)為模板使用SWISS-MODEL server (http://swissmodel. expasy.org/)進行建模預測抗菌肽結構。
抗菌肽HBβ-C由南京市金斯瑞生物科技股份有限公司采用固相化學合成法合成, 反向液相色譜確定純度在90%以上, 然后利用質譜確定分子量準確無誤。
1.5 血紅蛋白β鏈在黃顙魚皮膚和鰓組織中表達量分析
用TRIzol試劑(中國大連, TaKaRa)提取每個樣品的總RNA; 通過NanoDrop 2000測定RNA濃度和瓊脂糖凝膠電泳確認提取的RNA完整后, 等量混合;使用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)試劑盒按說明書要求進行反轉錄得到cDNA。RT-PCR反應體系: SYBR Green Mixture 10 μL,10 μmol/L的正向引物(F: 5′-TTCACGCTTCTTGC TAACT-3′)和反向引物(R: 5′-CAGCCACGACGAC ATTCA-3′)各0.5 μL, 去離子水8.0 μL, cDNA 1.0 μL。反應條件: 95℃預變性30s, 40個循環(95℃ 5s, 60℃30s), 溶解曲線: 65—95℃、0.5℃/次, 5s讀板。每個樣品設置3個重復。反應結束后分析擴增產物的溶解曲線, 以黃顙魚β-actin作為內參基因, 分析每個樣品中基因表達情況。
Western blot印跡分析: 將黃顙魚HBβ-C肽段部分序列(PEVHETWQKFLN)進行化學合成后注射到新西蘭大白兔獲得兔源的HBβ多克隆抗體; 提取鰓組織的總蛋白后再進行15% SDS-PAGE電泳, 用濕轉法進行轉膜; 在封閉液(5%脫脂奶粉)中封閉1h, 封閉液加入HBβ多克隆抗體(1﹕1000)中在搖床上4℃封閉過夜; 洗膜, 加入HRP-conjugated Goat Anti-Rabbit lgG(H+L) (1﹕1000), 室溫搖床孵育1h;洗膜, 用ECL顯色系統進行顯色, 置紅外激光成像系統檢測并拍照。Western blot結果中的條帶強度使用Image J軟件分析。
1.6 HBβ-C體外抗小瓜蟲試驗
將化學合成的HBβ-C粉劑溶于滅菌雙蒸水中使其終濃度為1000 μg/mL, 用雙蒸水稀釋為500、250、125、50、25、15、5、2和1 μg/mL。體外試驗在96孔細胞培養板中進行, 每孔加入70 μL不同濃度抗菌肽和10個滋養體, 每種濃度3個平行孔。試驗設置未加抗菌肽的作為陰性對照組。每0.5h鏡檢1次, 4h后統計各孔死亡情況。包囊體和掠食體的藥物處理同上。不同生活史小瓜蟲死亡判斷標準為蟲體纖毛不再運動, 膜破裂, 胞內物質外流。
1.7 組織病理學分析
組織樣品做石蠟包埋后進行連續切片, 分別進行蘇木精-伊紅(HE)染色和免疫組化分析。
免疫組化分析: 組織石蠟切片置于65℃烘箱中烘片2h進行脫蠟, PBS洗滌(洗滌3次, 每次5min, 下同)后置于EDTA緩沖液中微波修復, 自然冷卻后PBS洗滌; 切片置于3%過氧化氫溶液中室溫下避光孵育10min, 阻斷內原酶反應; PBS洗滌, 甩干后用5% BSA封閉20min, 封閉非特異性反應; 去除BSA液, 每張切片加入HBβ多克隆抗體(1﹕200)覆蓋組織,4℃過夜; PBS洗滌, 每張切片加入Cy3-conjugated Goat Anti-Rabbit lgG(H+L) (1﹕1000), 37℃孵育50min; PBS洗滌, 每張切片加50—100 μL DAPI染液, 室溫避光孵育5min; 染色后將切片放入PBS洗滌, 滴加適量的抗熒光淬滅劑于組織上, 蓋玻片封片, 熒光顯微鏡下觀察。
1.8 數據分析
使用Excel 2010和SPSS 11.0軟件統計分析數據, 采用單因素方差分析(One-Way ANOVA)檢驗小瓜蟲感染組與對照組樣品間血紅蛋β鏈基因表達量差異。實驗數據為平均值±標準差(SD)的方式表示,P<0.05表示差異性顯著(*),P<0.01表示差異性極顯著(**)。利用GraphPad Prism 6.0軟件做基因表達和Kaplan-Meier生存曲線圖, 用Mantel-Cox檢驗分析曲線之間的差異。
2 結果
2.1 全雄黃顙魚、雜交黃顙魚和瓦氏黃顙魚對多子小瓜蟲的抗性差異分析
為了評估全雄黃顙魚、雜交黃顙魚和瓦式黃顙魚對多子小瓜蟲的敏感性, 我們進行了感染試驗。在3種魚進行感染實驗后, 每日死亡狀況如表 1所示。雜交黃顙魚和瓦式黃顙魚極易感染多子小瓜蟲, 在感染5—6d即可觀察到清晰的小白點寄生在皮膚和鰭條上, 光學顯微鏡下也可觀察鰓部被感染, 感染率高達100%。在試驗期間, 全雄黃顙魚未發現臨床癥狀, 通過光學顯微鏡觀察未檢測到多子小瓜蟲存在于全雄黃顙魚鰓、皮膚和鰭條組織。在相同感染條件下, 瓦式黃顙魚和雜交黃顙魚的死亡率高達100%顯著高于全雄黃顙魚(P<0.0001), 而所有對照組魚均存活且未被感染(圖 1)。在混合感染組中, 雜交黃顙魚因感染多子小瓜蟲大批量死亡,而全雄黃顙魚依舊鏡檢未檢測到多子小瓜蟲存在(圖 2), 少量幾條全雄黃顙魚可能由于鰭條破損細菌感染而死亡。

圖1 全雄黃顙魚、雜交黃顙魚和瓦式黃顙魚感染多子小瓜蟲的存活曲線圖Fig. 1 The survival curves of all-male yellow catfish, hybrid yellow catfish and darkbarbel catfish after infected with Ichthyophthirius multifiliis
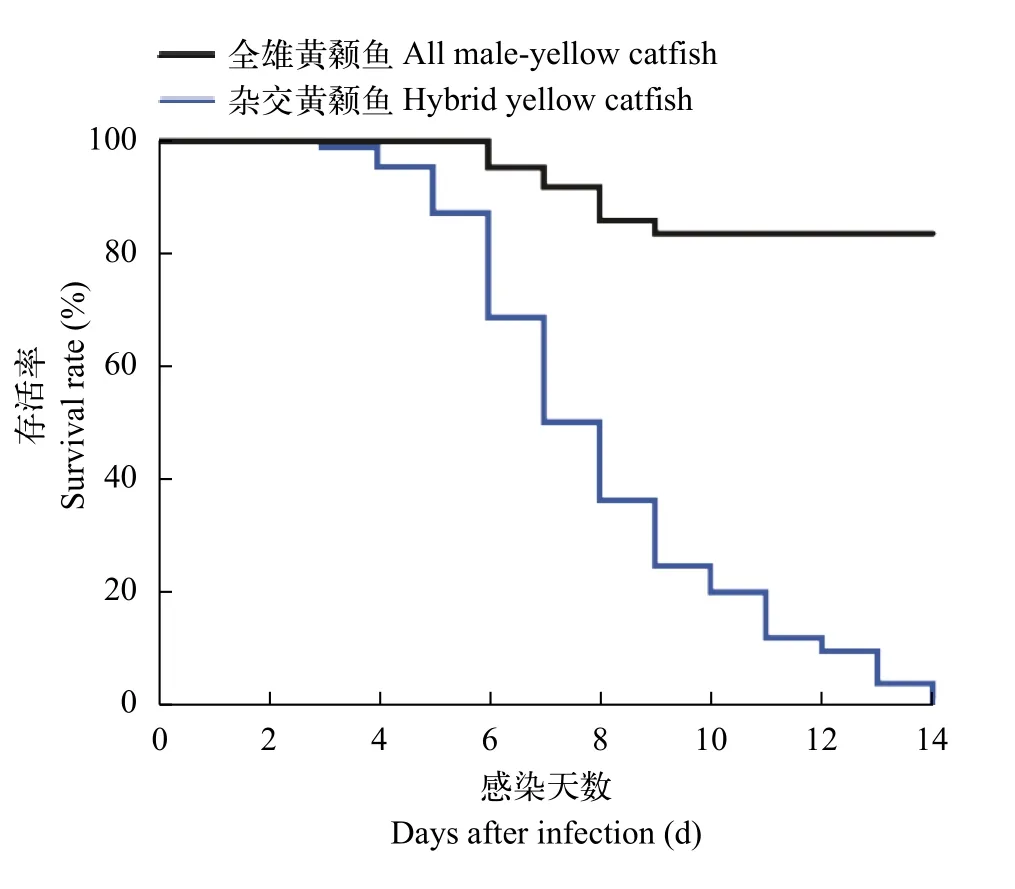
圖2 全雄黃顙魚和雜交黃顙魚混合感染多子小瓜蟲的存活曲線圖Fig. 2 The survival curves of all-male yellow catfish and hybrid yellow catfish after infected with Ichthyophthirius multifiliis. Allmale yellow catfish and hybrid yellow catfish were mixed together
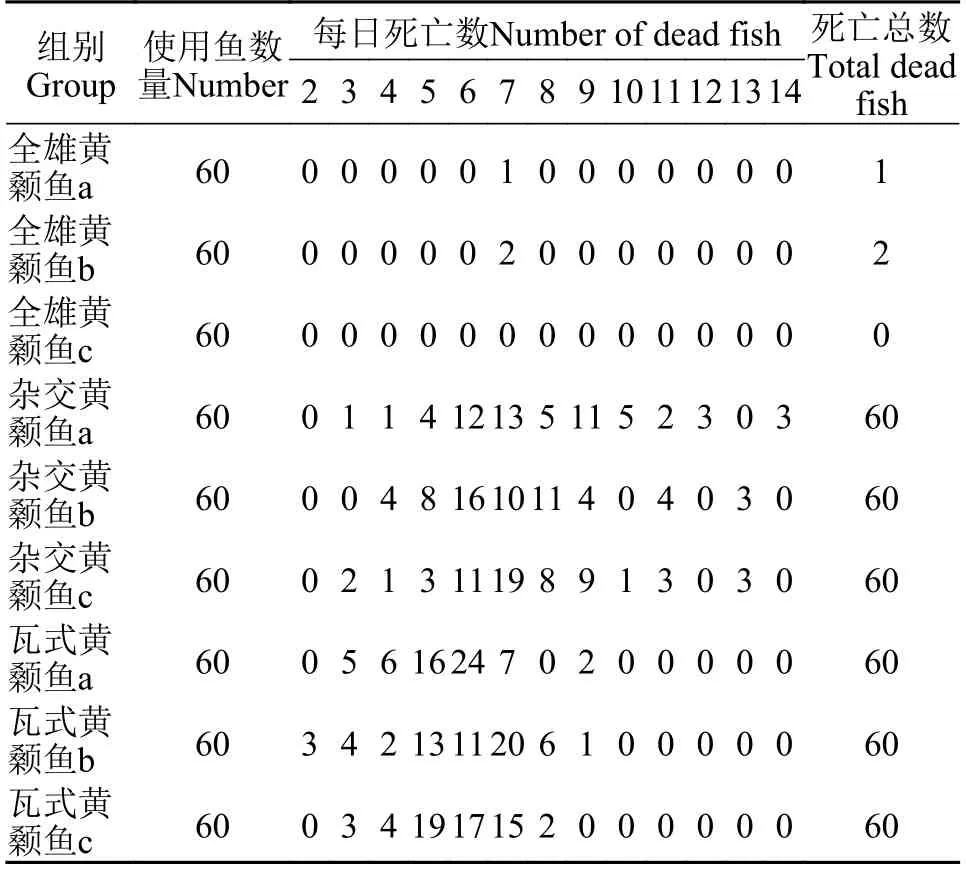
表1 黃顙魚感染多子小瓜蟲每日死亡狀況(尾)Tab. 1 The daily dead status of yellow catfish after infected with Ichthyophthirius multifiliis
2.2 黃顙魚血紅蛋白β鏈基因(HBβ)及其C端抗菌肽HBβ-C生物信息學分析
基于生物信息學分析, 黃顙魚HBβ的cDNA全長為447 bp, 共編碼148個氨基酸(aa; 圖 3)。通過與抗菌肽數據庫(http://aps.unmc.edu/AP/APD3_update2020_release.fasta)進行比較分析發現黃顙魚抗菌肽HBβ-C與斑點叉尾鮰抗菌肽AP01619匹配度高達84.84%, 位于黃顙魚血紅蛋白β鏈基因的C端33 aa (圖 3下劃線)。抗菌肽HBβ-C的螺旋輪分布如圖 4A所示, 其總電荷為+1.5, 總疏水率為51.8%。抗菌肽HBβ-C的模型結構圖如圖 4B所示, 由序列10PEVHETWQKFLNVVVAAL28形成α螺旋結構。

圖3 黃顙魚HBβ基因cDNA全長及其預測的氨基酸序列Fig. 3 The cDNA sequence and deduced amino acid sequences of HBβ in yellow catfish
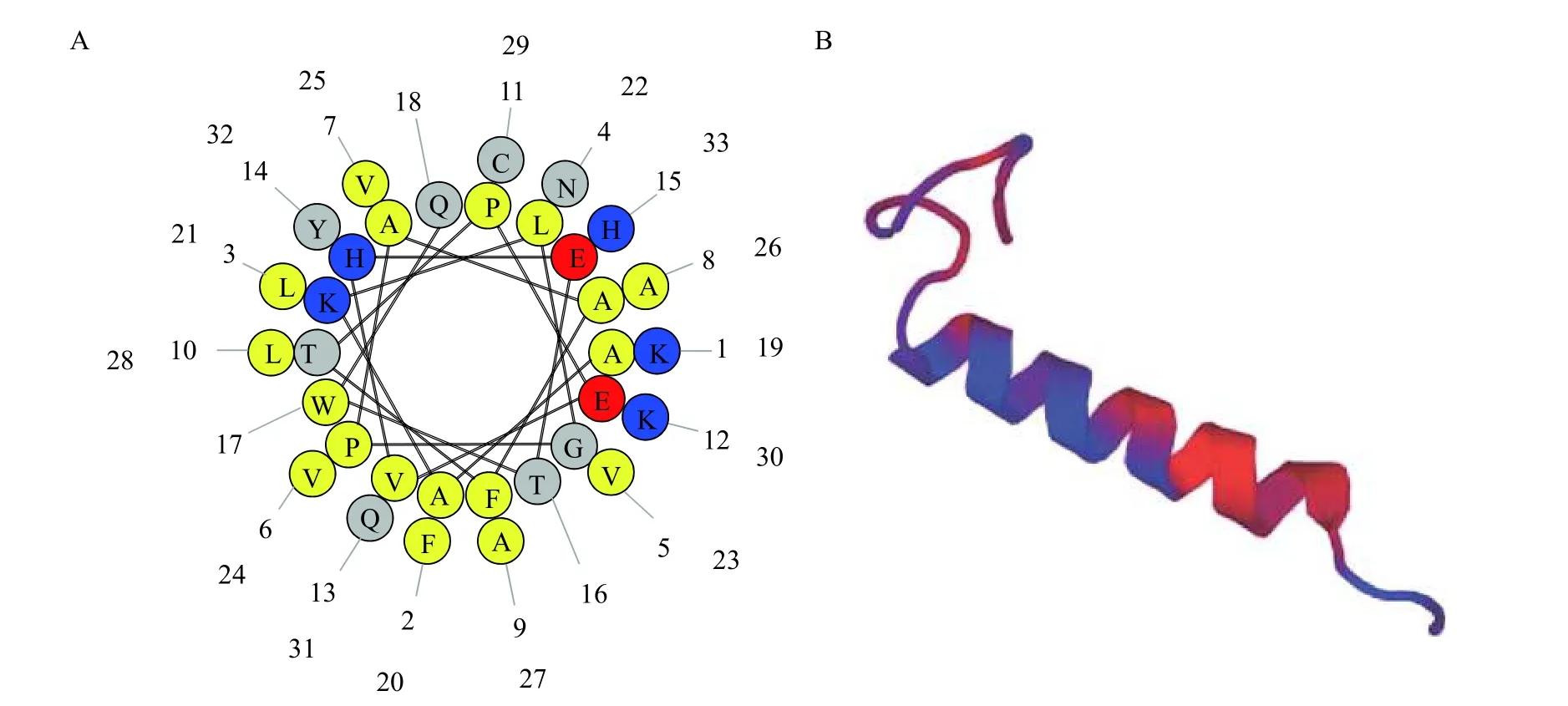
圖4 抗菌肽HBβ-C的螺旋輪分布和結構模型圖Fig. 4 The helical wheel distribution and structure model of the antimicrobial peptide HBβ-C
2.3 黃顙魚HBβ在鰓和皮膚等免疫組織中mRNA和蛋白表達量分析
我們分別以全雄黃顙魚和雜交黃顙魚作為抗感染和易感個體, 選取多子小瓜蟲的主要感染部位即皮膚和鰓組織檢測HBβ的mRNA表達水平。定量結果如圖 5A和5B所示, 在對照組中, 雜交黃顙魚的鰓和皮膚組織中HBβ的mRNA表達量均高于全雄黃顙魚; 在攻毒試驗第5天,HBβ的mRNA表達量在雜交黃顙魚鰓和皮膚組織中分別上升了3.7倍和1.5倍,而在全雄黃顙魚鰓和皮膚組織分別上升了23.8倍和26.3倍, 此時全雄黃顙魚的鰓和皮膚組織中HBβ的mRNA表達量顯著高于雜交黃顙魚。在未感染多子小瓜蟲的鰓組織中, 全雄黃顙魚HBβ蛋白表達量比雜交黃顙魚高2.2倍(圖 5C和5D), 表明全雄黃顙魚HBβmRNA在鰓和皮膚等免疫組織中蛋白翻譯水平明顯高于雜交黃顙魚; 在應對小瓜蟲感染的過程中, 全雄黃顙魚的mRNA轉錄水平快速提升, 遠遠高于雜交黃顙魚, 可能與全雄黃顙魚抗多子小瓜蟲的特性相關。

圖5 HBβ在鰓和皮膚組織中的表達分析Fig. 5 The relative expression of HBβ in gill and skin
2.4 抗菌肽HBβ-C對多子小瓜蟲的體外殺傷影響
多子小瓜蟲的生活史分為滋養體、包囊體和掠食體三個階段。當使用50 μg/mL的HBβ-C處理后, 滋養體從黏液囊中逃出后在水中劇烈運動, 然后25s左右裂解, 胞質外流而死(圖6A和6B); 僅需要15 μg/mL的HBβ-C能在3min內殺死所有滋養體(表 2)。由于包囊體具有較厚的包囊膜(圖 6C), 抗菌肽HBβ-C較難滲透; 當使用500 μg/mL的HBβ-C處理后, 前40min包囊體的包囊膜迅速皺縮, 里面的子體急劇運動(圖 6D), 之后包囊體中的子體逐漸逃脫游離在水中, 約1h后胞質外流最后死亡(圖 6E和6F)。對于剛釋放的掠食體來說, HBβ-C需要使用較高濃度(125 μg/mL)及花費更長時間(約3h)才能將其完全殺死(圖 6G和6H)。所有對照組的3個階段的多子小瓜蟲完好無損, 各個階段正常分裂發育。
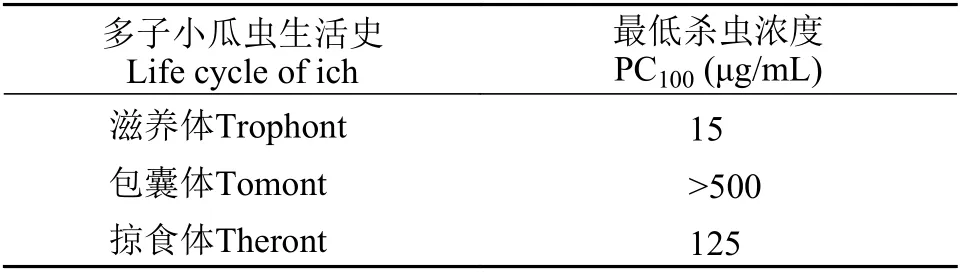
表2 抗菌肽HBβ-C對不同生活史的多子小瓜蟲體外影響Tab. 2 The effect of antimicrobial peptide HBβ-C on the different life cycles of Ichthyophthirius multifiliis in vitro

圖6 抗菌肽HBβ-C對不同生活史的多子小瓜蟲的影響Fig. 6 The effect of antimicrobial peptide HBβ-C on Ichthyophthirius multifiliis different life cycles
2.5 HBβ在雜交黃顙魚感染小瓜蟲過程中的表達定位分析
為了研究HBβ在多子小瓜蟲感染過程中的組織分布, 我們使用連續切片分別進行HBβ抗體熒光免疫組化和蘇木精—伊紅(HE)染色分析。熒光免疫組化結果顯示, HBβ抗體在雜交黃顙魚鰓組織中的紅細胞中有較強的表達信號(圖 7A和7B, 箭頭所示)。此外, HBβ抗體能特異性結合到多子小瓜蟲表面, 表現出很強的熒光信號(圖 7C和7D, 箭頭所示)。在皮膚組織中, 多子小瓜蟲寄生位置較深緊靠著基底膜, HBβ抗體也特異性附著多子小瓜蟲上(圖7E和7F, 箭頭所示)。
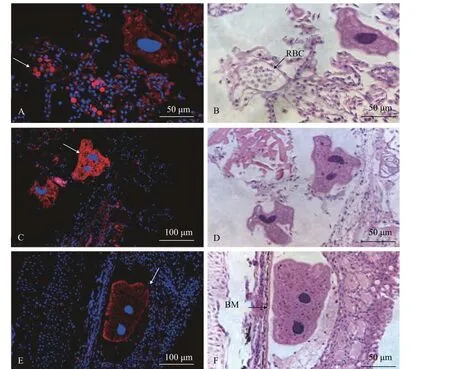
圖7 HBβ免疫熒光定位及組織切片分析Fig. 7 Detection of HBβ localization by immunohistochemistry and analysis of histological section
3 討論
多子小瓜蟲病是水產養殖的主要病害之一, 國內外科研工作者早期對小瓜蟲的防治藥物進行了大量的篩選, 已篩選的有效治療藥物如孔雀石綠、硝酸亞汞和醋酸亞汞等, 均由于毒性強、致癌和嚴重污染環境而被禁用。近年來中草藥上篩選的辣椒、生姜、五倍子等和化合物高錳酸鉀、福爾馬林、硫酸銅等有一定療效, 但大多數藥物僅對掠食體階段有一定效果, 對滋養體階段效果并不顯著。小瓜蟲病防治的最大難題就是一般藥物不能有效滲透到小瓜蟲的寄生部位殺死滋養體[27]。
血紅蛋白廣泛存在于脊椎動物和無脊椎動物的紅細胞中, 是由2個α亞基和2個β亞基形成一個四聚體結構具有攜氧功能的重要呼吸蛋白[28]。近年來, 研究者們發現血紅蛋白除了具有攜氧功能外,其亞基片段可形成各種活性肽, 具有止痛、促生長激素釋放、阿片樣活性、促腎上腺皮質激素釋放和血管緊張素轉換酶抑制活性等功能[29—33]。血紅蛋白源的肽段可形成多種抗菌肽, 其抗菌特性在哺乳類、爬行類、魚類和貝類中均有發現[34,35]。諸多研究發現血紅蛋白α鏈35—56位氨基酸和位于血紅蛋白β鏈的111—146位氨基酸片段存在抗微生物活性[23,36—41]。Ullal等[23]在斑點叉尾鮰的鰓和皮膚組織中發現位于血紅蛋白β鏈的116—148位氨基酸的短肽, 其僅對小瓜蟲滋養體階段有較好的殺傷效果, 對掠食體和包囊體卻沒有明顯效果。
我們前期在黃顙魚的皮膚黏液蛋白質組中也曾發現血紅蛋白β鏈的碳端序列HBβ-C, 其表達量在鲇愛德華氏菌感染后明顯上升[24]。本研究合成的黃顙魚HBβ-C抗菌肽對滋養體階段效果最佳, 僅需要15 μg/mL的HBβ-C抗菌肽能在3min內殺死所有滋養體; 黃顙魚HBβ-C處理滋養體后短時間內會被誘導分泌出黏液囊并急劇運動, 而這種黏液囊與正常滋養體脫離宿主后往包囊體分化時形成的黏液囊腫非常相似, 而同樣對多子小瓜蟲具有殺傷作用的抗菌肽Piscidin 1處理后卻并未發現滋養體分泌黏液囊[42,43]。從誘導滋養體運動加劇和分泌黏液囊的作用效果來看, 抗菌肽HBβ-C可能誘導滋養體離開宿主并加速分化, 具體還需通過活體試驗來進一步證實。此外, 黃顙魚抗菌肽HBβ-C對掠食體也有殺傷效果, 且高濃度處理包囊體后能導致包囊膜皺縮, 導致體內子體旋轉加劇甚至從包囊中逃逸出來最終死亡。以上表明黃顙魚的HBβ-C抗小瓜蟲能力高于斑點叉尾鮰的HBβ-C, 抗小瓜蟲能力的差異可能是由于HBβ-C在2個物種中的序列差異造成的[23]。一般抗菌肽發揮功能涉及3個重要特征:α螺旋結構、抗菌肽整體帶正電荷和較高含量的疏水性氨基酸。大量研究表明, α螺旋結構抗菌肽的陽離子電荷和疏水性氨基酸對抗菌作用至關重要[44—46]。黃顙魚抗菌肽Hbβ-C大部分氨基酸呈α螺旋結構, 整體帶+1.5電荷, 疏水率高達51.8%, 而在斑點叉尾鮰發現的抗小瓜蟲肽的整體0電荷, 疏水率為45%。
斑點叉尾鮰易患鮰愛德華氏菌引起的鯰魚腸道敗血癥(Enteric septicemia of catfish, ESC), 而藍鯰(Ictalurus furcatus)對鮰愛德華氏菌具有較強的抗性, 其雜交種表現出中等抗性水平[47]。本研究發現全雄黃顙魚對由多子小瓜蟲引起的白點病具有抗性, 瓦式黃顙魚易感染多子小瓜蟲而快速死亡;但在養殖過程中也偶有報道全雄和普通黃顙魚感染小瓜蟲的案例, 這可能與養殖條件和魚體本身的健康狀態有關系。我們分析雜交黃顙魚和全雄黃顙魚在感染多子小瓜蟲前后HBβ的表達發現, 雖然雜交黃顙魚的鰓和皮膚組織中HBβ的mRNA表達量均高于全雄黃顙魚, 然而HBβ蛋白在全雄黃顙魚鰓組織中要明顯高于雜交黃顙魚, 這可能與翻譯效率有關[48]。在感染小瓜蟲后, 全雄黃顙魚和雜交黃顙魚的鰓和皮膚組織中HBβ的mRNA均顯著上升, 且全雄黃顙魚上升倍率更高。研究者發現感染多子小瓜蟲產生免疫抗性的鯉中, 掠食體就可以侵入皮膚, 但在感染后2h 80%的多子小瓜蟲消失了, 表明魚體本身可針對寄生蟲迅速產生反應抵抗入侵[49]。在多子小瓜蟲感染后, 全雄黃顙魚能快速合成大量HBβmRNA并高效率翻譯成蛋白質, 產生的高水平HBβ-C抗菌肽可能有效抵御多子小瓜蟲。此外, 黃顙魚在感染多子小瓜蟲后, 抗菌肽HBβ-C會富集在多子小瓜蟲表面。多子小瓜蟲的抑動抗原(Immobilization antigens)可誘導宿主在血清和黏液中產生抗體, 在體外會附著在不同生活史階段的多子小瓜蟲上[50]。Xu等[51]發現免疫球蛋白T和免疫球蛋白M廣泛存在于虹鱒(Oncorhynchus mykiss)皮膚中,當多子小瓜蟲感染時立即附著在其表面。抗菌肽導致膜破裂主要通過與寄生蟲表面相互作用[52]。殺蟲類抗菌肽發揮作用主要通過作用于細胞膜, 擾亂電化學梯度, 從而引起寄生蟲滲透性休克, 這一過程主要涉及膜電位的迅速崩潰和細胞內ATP下降; 膜通透性增加; 形態改變如氣泡或破裂[53]。
綜上所述, 目前絕大多數藥物僅對多子小瓜蟲的掠食體階段有效, 而對寄生在魚體表的滋養體階段很難發揮作用; 黃顙魚抗菌肽HBβ-C對寄生在魚體的滋養體階段有較好的殺傷效果, 未來可探索利用生物工程技術對抗菌肽HBβ-C進行規模化生產,應用到水產養殖業中。結果證明, 全雄黃顙魚對小瓜蟲病具有抗性, 而雜交黃顙魚易感。全雄黃顙魚和雜交黃顙魚的抗病性能存在差異, 在養殖過程中,可以根據養殖條件和養殖環境合理選擇黃顙魚的養殖品種。

