翹嘴鲌血紅蛋白基因Hbs的克隆、分子特征及系統進化分析
祁 梅 吳嘉偉 譚鳳霞 羅鳴鐘 程保琳 張遠松 柴 毅
(1. 長江大學動物科學學院, 荊州 434025; 2. 中國水產科學研究院長江水產研究所, 荊州 434000)
有氧代謝(Aerobic metabolism)是動物界基本的生理代謝之一, 基于此動物們才能展開一系列的能量代謝活動[1,2]。從水中的無脊椎動物, 如軟體動物等, 到脊椎動物魚類和兩棲類, 再到陸地上的脊椎動物爬行類、鳥類和哺乳類都利用各自的方式進行著有氧代謝活動[3—5]。從水環境到陸地環境的改變, 動物們的呼吸器官也從體腔和鰓轉換到了皮膚和肺, 其呼吸方式的改變極大地促進了物種的進化[6—9]。而血紅蛋白正是脊椎動物體內有氧代謝最重要的蛋白之一。
血紅蛋白(Hemoglobin, Hb)是由多肽鏈組成,又稱為珠蛋白, 且每條鏈上都有一個血紅素輔基[10,11]。脊椎動物的血紅蛋白分子一般是異源四聚體結構,由兩條α多肽鏈(α1和α2)和兩條β多肽鏈(β1和β2)組成。α和β多肽鏈分別有7和8個螺旋片段(A-H, α多肽鏈無D螺旋), 這些螺旋片段和非螺旋片段形成轉角并引起鏈的特征三級折疊形成內二聚體(α1β1和α2β2)和間二聚體(α1β2和α2β1)[3,12,13]。血紅蛋白主要存在于紅細胞中, 能溶解大量的氧氣并將其運送至機體的各個組織器官, 是氧化分解代謝電子的最終受體[14]。當脊椎動物血紅蛋白分子中的一個α亞基與氧分子結合后, 會立即使得其余亞基結構改變,致使血紅蛋白分子對氧分子的親和力迅速增大[15]。與之類似, 血紅蛋白分子在組織中釋放氧分子的過程也隨著一個氧分子的釋放促使其他氧分子的釋放。機體利用血紅蛋白分子的協同效應來提高其轉運和存儲氧氣的效率。血紅蛋白分子各亞基氨基酸序列高度同源, 是研究全基因組復制事件的良好材料。有研究表明血紅蛋白的α和β多肽鏈氨基酸序列相似度大約為50%, 且有頜類(Gnathostomata)的α和β球蛋白是在450—500 Ma奧陶紀時全基因組復制事件中從無頜類(Agnatha)中一個古基因復制分化而來的[16,17]。而硬骨魚類血紅蛋白α和β球蛋白基因的多態性很可能是在320—400 Ma硬骨魚類特有的全基因組復制事件中復制生成的[18—20]。
翹嘴鲌(Culter alburnus)隸屬鯉形目、鯉科、鲌亞科、鲌屬, 在我國平原各水系均有分布, 是長江流域優質經濟魚類之一, 享有“太湖三白”的美譽。翹嘴鲌以其個體大、生長快、鱗下脂肪多、營養價值高和味道鮮美等特點深受漁民和食客歡迎[21]。在眾多水產養殖品種之中, 翹嘴鲌對氧的需求量較高。研究表明平均體重0.44—0.51 g的翹嘴鲌在水溫21℃時窒息點為0.41 mg/L; 當水溫上升到29℃時, 其窒息點達到0.57 mg/L[22]。鯉(Cyprinus carpio)在體長11.3—14.2 cm、水溫30℃時, 窒息點為0.29 mg/L[23]; 鏡鯉(Cyprinus carpio var. specularis)在平均體重30—70 g、水溫20℃時, 窒息點為0.15 mg/L[24]; 青魚(Mylopharyngodon piceus)在平均全長55 cm、水溫18℃時, 窒息點為0.31 mg/L[22]; 尼羅羅非魚(Oreochromis niloticus)在平均全長13—14 cm、水溫21℃時, 窒息點為0.07 mg/L[25]。隨著集約化高密度養殖模式的擴大, 低氧的養殖環境容易使得魚類生長緩慢, 抵抗力低, 甚至出現死亡。而且在魚類運輸中, 也很容易出現缺氧導致大規模死亡現象。
因此, 本研究以翹嘴鲌為實驗對象, 克隆了其血紅蛋白家族中Hba1/2和Hbb1/2 cDNA序列, 并運用了生物信息學方法分析其分子特征及與其他物種的系統發育關系, 為魚類的耐低氧生物學研究提供理論依據。
1 材料與方法
1.1 實驗魚與試劑
本實驗翹嘴鲌(42.5±3.7) cm來源于中國水產科學院長江水產研究所荊州窯灣基地。翹嘴鲌從池塘撈起后先禁食24h, 然后置于冰上用MS-222 (100 mg/L)麻醉, 迅速取樣, 包括腦、心臟、肝臟、脾臟、腸道組織、肌肉和血液, 取出的組織樣品用滅菌的DEPC 處理水沖洗, 并用液氮快速冷凍, 然后保存于-80℃冰箱備用。
主要實驗試劑有: 購自大連寶生物公司(TaKaRa)的RNA提取試劑盒、DNA聚合酶、逆轉錄試劑盒、3′-Full RACE Kit試劑盒、5′-Full RACE Kit試劑盒、瓊脂糖凝膠電泳試劑盒(DNA Marker)和DNA凝膠純化回收試劑盒等試劑; 購自Sigma公司的焦炭酸二乙酯(DEPC)和胰蛋白胨等試劑。
1.2 基因cDNA序列的克隆
所取翹嘴鲌各組織樣品中的總RNA嚴格按照試劑盒說明書步驟進行操作提取。提取所得總RNA的純度用核酸蛋白檢測儀(ND-2000)檢測, 其完整性用濃度為1.5%的瓊脂糖電泳檢測。以提取翹嘴鲌各組織樣品的總RNA為模板, 使用TaKaRa公司的PrimeScriptTMII 1st Strand cDNA Synthesis Kit試劑盒合成cDNA的第一條鏈。
基于GenBank和Ensembl中已報道的斑馬魚(Danio rerio)、鯉、虹鱒(Oncorhynchus mykiss)和犀角金線鲃(Sinocyclocheilus rhinocerous)的Hba1、Hba2、Hbb1和Hbb2基因cDNA序列, 設計克隆實驗用魚翹嘴鲌的核心序列簡并引物(表 1)。以合成的第一鏈cDNA為模板, 對翹嘴鲌cDNA核心片段進行擴增, PCR反應體系(20 μL): cDNA模板1 μL,10×Ex-TaqBuffer 2 μL, dNTP (2.5 mmol/L) 2 μL, 簡并引物各0.4 μL,Taq酶0.2 μL,ddH2O補足至20 μL。PCR反應條件: 94℃預變性4min; 94℃變性30s,56℃退火30s, 72℃延伸60s, 30個循環; 然后72℃延伸5min。PCR產物經過凝膠回收后進行拼接至EcoliDH5α感受態細胞, 并將PCR檢測為陽性的克隆產物菌液交武漢擎科生物技術有限公司測序。測序所得結果在NCBI上進行比對分析檢驗其同源性。根據克隆得到的基因cDNA核心序列分別設計3′和5′ RACE特異性引物(表 1)并進行巢式反應,Outer-PCR反應程序為: 94℃預變性3min; 94℃變性30s, 55℃退火30s, 72℃延伸60s, 25個循環; 然后72℃再延伸5min。Inner-PCR反應程序為: 94℃預變性3min; 94℃變性30s, 58℃退火30s, 72℃延伸60s, 30個循環; 然后72℃終延伸5min。

表1 Hba1、Hba2、Hbb1和Hbb2基因克隆所需引物序列Tab. 1 The primers used for the cDNAs cloning of Hba1, Hba2,Hbb1 and Hbb2 genes
1.3 序列分析及進化樹的構建
用DNAStar軟件將獲得的全部cDNA片段進行序列拼接, 得到各構型基因的cDNA全長序列。將得到的全長序列在NCBI中進行在線比對, 以確定所獲得的各序列所對應的基因類型(http://blast.ncbi.nlm.nih.gov/)。并運用NCBI中的開發閱讀框(Open Reading Frame, ORF)搜索服務器查找翹嘴鲌血紅蛋白基因的開發閱讀框并翻譯成氨基酸序列; 通過ExPAsy (https://web.expasy.org/protparam/)在線軟件對翹嘴鲌血紅蛋白序列進行分析; 運用在線軟件SMART (http://smart.embl-heidelberg.de/)預測翹嘴鲌血紅蛋白結構域; 序列比對和氨基酸同源性分析使用Clustal-W軟件; 使用MEGA7.0軟件進行進化分析, 以鄰接法(Neighbor-joining, NJ)構建系統進化樹, 每個節點的可信值重復次數為1000。
2 結果
2.1 Hba1/2和Hbb1/2 cDNA序列的分子特征
本研究通過RT-PCR和RACE方法獲取Hba1、Hba2、Hbb1和Hbb2基因的cDNA全長序列, 其長度分別為652、465、447和475 bp(表 2)。且序列分析表明cDNA序列ORF(開放閱讀框)分別為429、429、441和441 bp, 翻譯成蛋白后分別得到143、143、147和147個氨基酸。使用在線軟件Ex-PAsy預測得到Hbs蛋白分子量分別為15479.01、15971.59、16138.58和16335.91, 分子式分別為C707H1119N183O198S4、C729H1155N183O208S5、C731H1148N196O208S4和C744H1151N193O207S7, 理論等電點分別為8.81、6.91、8.95和6.50。Hba1蛋白富含丙氨酸(Ala, 11.2%)、亮氨酸(Leu, 9.8%)和賴氨酸(Lys,9.8%), Hba2蛋白富含亮氨酸(13.3%)、賴氨酸(9.1%)和纈氨酸(Val, 8.4%), 而Hbb1蛋白富含丙氨酸(12.2%)、亮氨酸(9.5%)和纈氨酸(9.5%), Hbb2蛋白富含丙氨酸(11.6%)、纈氨酸(10.9%)和亮氨酸(8.8%)。并利用在線軟件SMART預測蛋白二級結構域, 結果表明Hba1/2蛋白包括7個螺旋域、16個α1β1結合殘基、14個α1β2結合殘基、12個亞鐵血紅素結合殘基和6個Bohr效應殘基(圖 1), 而Hbb1/2蛋白包含8個螺旋域、16個α1β1結合殘基、13個α1β2結合殘基和16個亞鐵血紅素結合殘基(圖 2)。
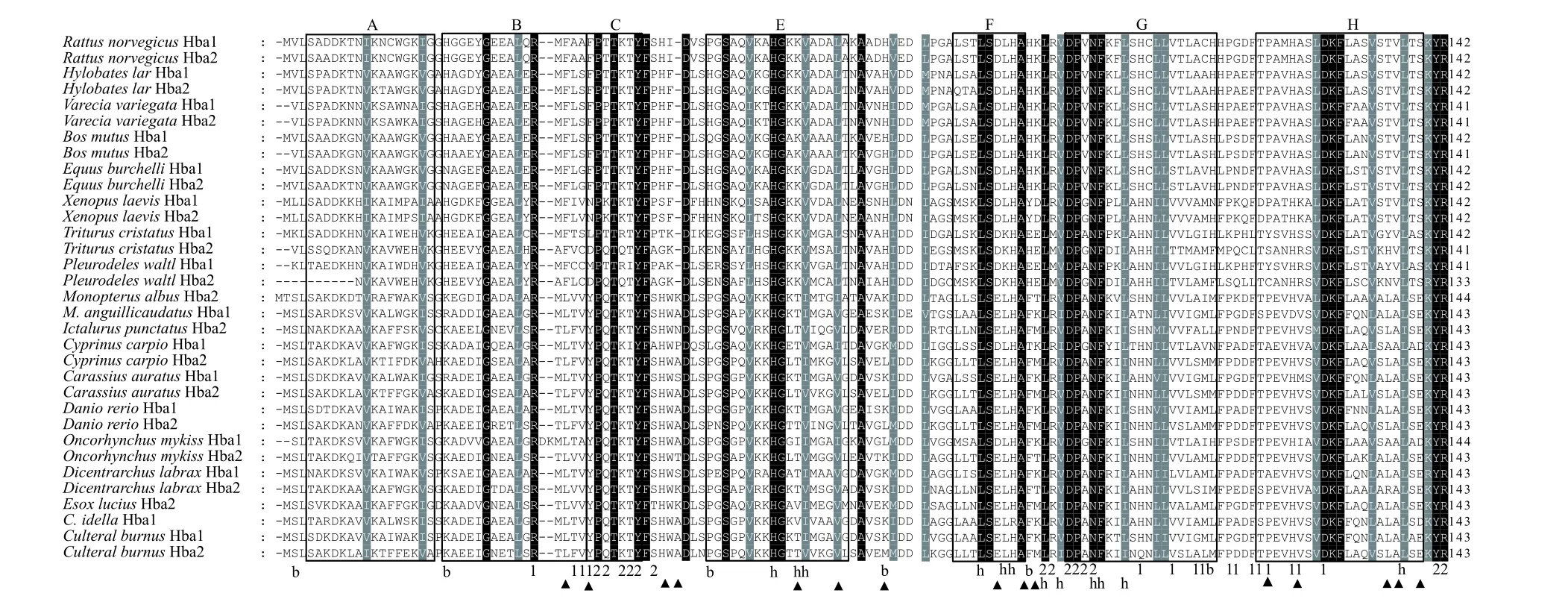
圖1 翹嘴鲌Hba1和Hba2氨基酸序列與哺乳類、兩棲類及其他硬骨魚類比對分析Fig. 1 Alignment of C. alburnus amino Hba1 and Hba2 amino acid sequences with mammalia, amphibian and other teleosts

圖2 翹嘴鲌Hbb1和Hbb2氨基酸序列與哺乳類、爬行類、兩棲類及其他硬骨魚類比對分析Fig. 2 Alignment of C. alburnus amino Hbb1 and Hbb2 acid sequences with mammalia, reptilia, amphibian and other teleosts
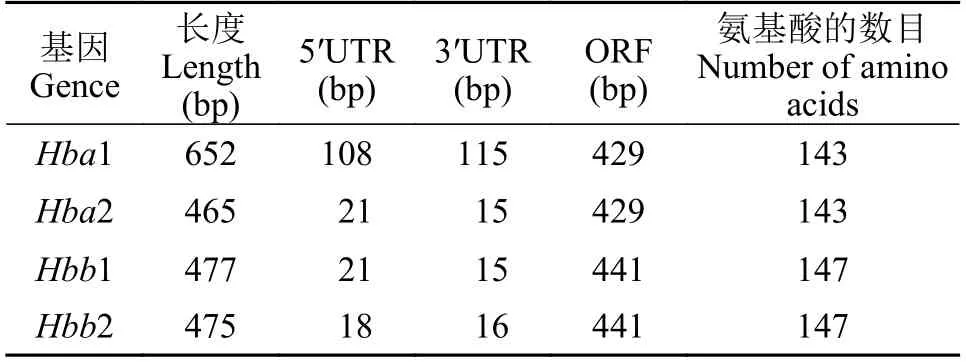
表2 翹嘴鲌Hba1、Hba2、Hbb1和Hbb2基因的cDNA全長序列信息Tab. 2 The information for full-length cDNA sequences of Hba1,Hba2, Hbb1 and Hbb2 from C. alburnus
2.2 Hba1/2和Hbb1/2蛋白多序列比對
將翹嘴鲌Hba1、Hba2、Hbb1和Hbb2氨基酸序列與其他魚類(斑馬魚和鯉)、兩棲類[非洲爪蟾(Xenopus laevis)]和哺乳類[大鼠(Rattus norvegicus)]相比, 我們發現其同源性分別為44.8%—93.0%、44.1%—88.8%、51.7%—87.1%和47.6%—89.8%(表 3)。其中翹嘴鲌Hba1、Hba2和Hbb2氨基酸序列與非洲爪蟾的同源性最低, 且其Hbb1氨基酸序列與大鼠的同源性最低。而翹嘴鲌Hba1/2氨基酸序列與斑馬魚同源性最高, 其Hbb1/2氨基酸序列與鯉同源性最高。
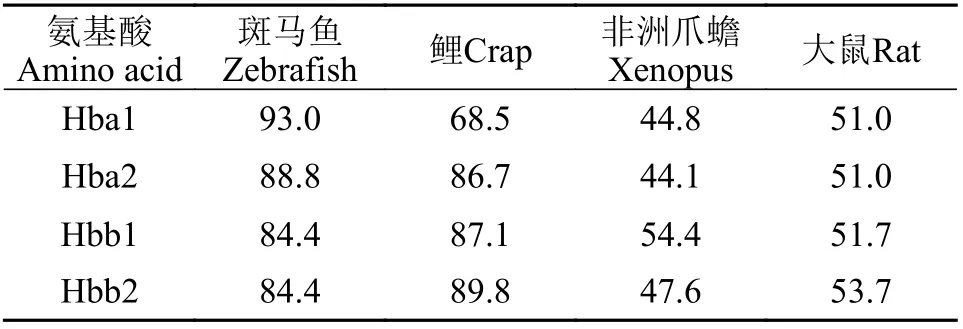
表3 翹嘴鲌Hba1、Hba2、Hbb1和Hbb2氨基酸序列與其他物種同源性(%)分析Tab. 3 Identity analysis of C. alburnus Hba1, Hba2, Hbb1 and Hbb2 amino acid sequence with other species (%)
2.3 Hba1/2和Hbb1/2基因系統進化分析
通過系統進化分析發現,Hba1/2基因在魚類、兩棲類和哺乳類各自聚成一支(圖 3)。其中魚類和蠑螈類的Hba1和Hba2基因各自聚到一起。在魚類中, 翹嘴鲌Hba1基因與斑馬魚親緣關系最近而與虹鱒和鯉關系相對較遠, 其Hba2基因也與斑馬魚親緣關系最近而與黃鱔(Monopterus albus)和歐洲鱸(Dicentrarchus labrax)關系相對較遠。此外,Hbb1/2基因也在魚類、兩棲類、爬行類和哺乳類各自聚成一支(圖 4)。其中魚類的Hbb1和Hbb2基因各自聚到一起。在魚類中, 翹嘴鲌Hbb1基因與白鰱(Hypophthalmichthys molitrix)和斑馬魚親緣關系最近而與鱖(Siniperca chuatsi)和歐洲鱸關系相對較遠,其Hbb2基因則與鯉和鯽(Carassius auratus)親緣關系較近而與黃鱔和虹鱒關系相對較遠。
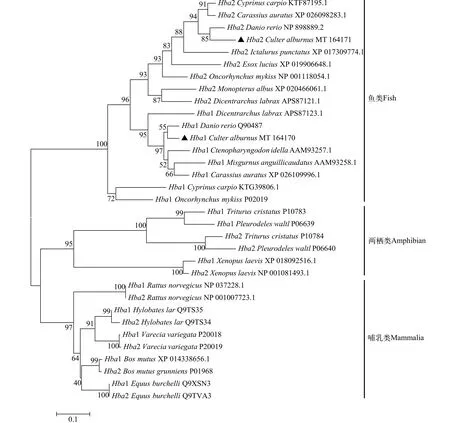
圖3 翹嘴鲌和其他脊椎動物Hba1和Hba2蛋白系統進化樹(▲所示為翹嘴鲌)Fig. 3 The phylogenetic tree of Hba1 and Hba2 from C. alburnus (▲) and other vertebrate species
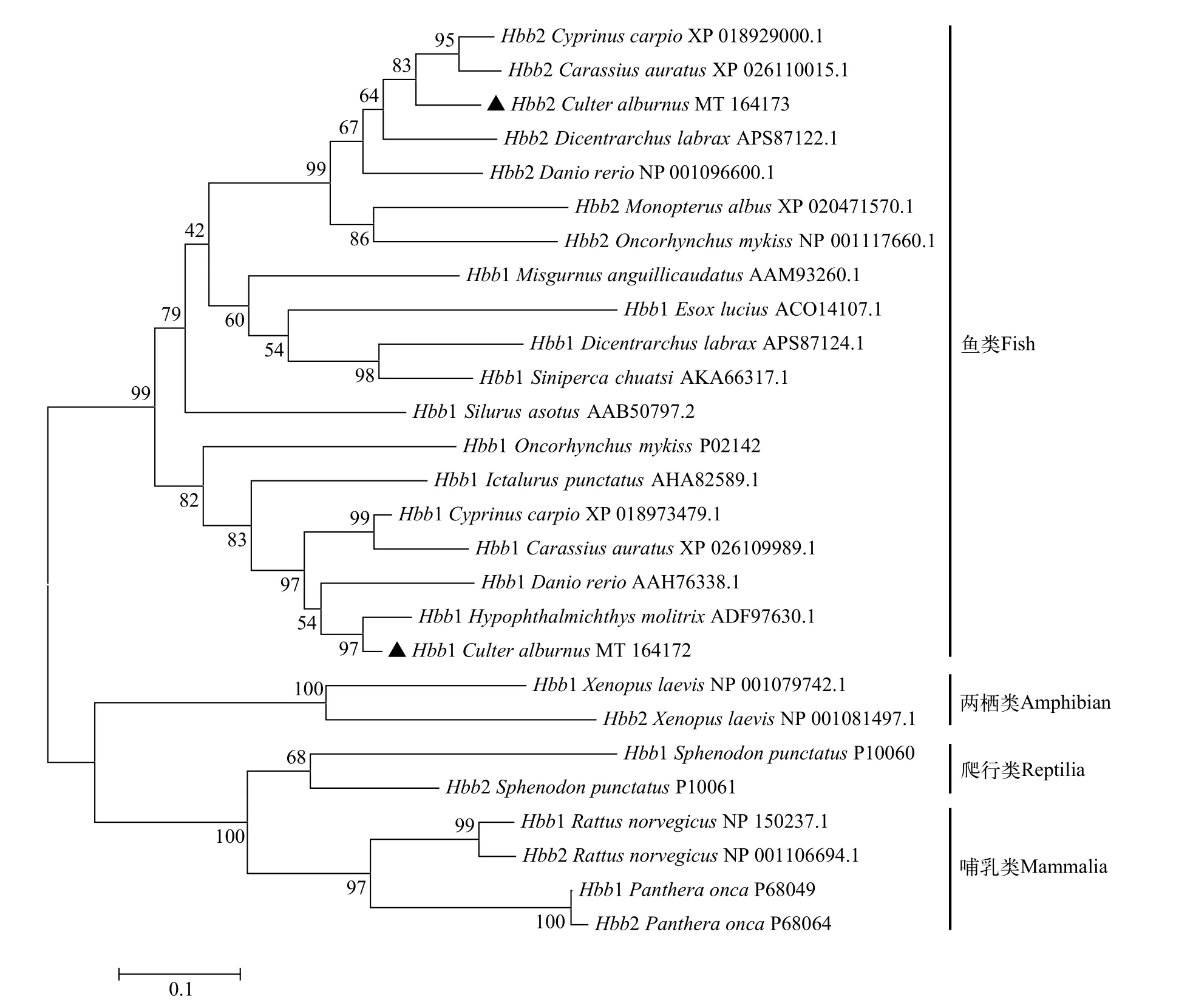
圖4 翹嘴鲌和其他脊椎動物Hbb1和Hbb2蛋白系統進化樹(▲所示為翹嘴鲌)Fig. 4 The phylogenetic tree of Hbb1 and Hbb2 from C. alburnus (▲) and other vertebrate species
3 討論
3.1 翹嘴鲌血紅蛋白的分子特征
為研究翹嘴鲌血紅蛋白分子特征, 我們克隆獲得Hba1、Hba2、Hbb1和Hbb2基因的cDNA全長序列。雖然這些基因的全長序列堿基數目不一樣, 但是翻譯成氨基酸序列后發現翹嘴鲌α和β球蛋白氨基酸數目分別為143(Hba1和Hba2)和147(Hbb1和Hbb2)(表 2), 且蛋白二級結構中Hba1/2和Hbb1/2蛋白分別包括7和8個螺旋域(圖 1), 此結果與草魚、鯉、鯽[26]、斑馬魚[27]、鱸[28]、黃河裸裂尻魚(Schizopygopsis pylzovi)[29]、半滑舌鰨(Cynoglossus semilaevis)[30]和大黃魚(Larimichthys crocea)[31]保持一致。與人類的α球蛋白多肽鏈[32]相比, 翹嘴鲌α球蛋白的α1β1結合殘基、α1β2結合殘基和亞鐵血紅素結合殘基數目是相似的, 除了6個Bohr效應殘基并不連續。且翹嘴鲌β球蛋白多肽鏈的α1β1結合殘基、α1β2結合殘基和亞鐵血紅素結合殘基數目與人類的β球蛋白[33]相比也是相似的。
3.2 血紅蛋白二級結構分析
在血紅蛋白二級結構比對分析中, 魚類[翹嘴鲌、草魚、白斑狗魚(Esox lucius)、歐洲鱸、虹鱒、斑馬魚、鯽、鯉、斑點叉尾鮰(Ictalurus punctatus)、泥鰍(Misgurnus anguillicaudatus)和黃鱔]的Hba蛋白氨基酸位點與兩棲類[非洲爪蟾、冠北螈(Triturus cristatus)和歐非肋突螈(Pleurodeles waltl)]和哺乳類[大鼠、長臂猿(Hylobates lar)、領狐猴(Varecia variegata)、牦牛(Bos mutus)和斑馬(Equus burchelli)]相比有15個氨基酸殘基發生替換,其中包括1個氨基酸位點的插入(圖 1)。在C-E螺旋區域間的第48位氨基酸上插入了丙氨酸(Ala, A)、賴氨酸(Lys, K)、天冬氨酸(Asn, N)、絲氨酸(Ser,S)、蘇氨酸(Thr, T)或脯氨酸(Pro, P), 而據報道其在鱸中插入的是色氨酸(Trp, W)[28], 在半滑舌鰨中是賴氨酸(Lys, K)[30], 在黃尾(Seriola lalandi)[34]和大黃魚[31]中是甘氨酸(Gly, G)。由于此氨基酸位點的插入是在螺旋間區, Miyata等[34]認為此次第48位氨基酸殘基的插入對于血紅蛋白的功能和三維結構的影響無關緊要。Okamot等[35]認為螺旋間區的氨基酸變化是由自然選擇壓力帶來的, 很可能對于蛋白功能沒有影響。與兩棲類和哺乳類相比, 魚類Hba蛋白15個氨基酸殘基替換位點有2個是在Bohr效應殘基上, 2個在α1β1結合殘基上, 10個在螺旋區域和5個在非螺旋區域。而魚類(翹嘴鲌、白鰱、白斑狗魚、鱖、虹鱒、斑馬魚、斑點叉尾鮰、歐洲鱸、鯽、鯉、大口鯰(Silurus asotus)、黃鱔和泥鰍)Hbb蛋白6個氨基酸殘基替換位點有5個在螺旋區域和1個在非螺旋區域。這些氨基酸位點的替換很可能是從低等脊椎動物魚類在水中用鰓呼吸, 進化到兩棲類再到高等的哺乳類具有利用空氣中氧氣的能力的重要原因[36,37]。遺憾的是, 相對耐低氧的魚類與不耐低氧魚類在Hba/b蛋白二級結構上并未發現一致的氨基酸殘基替換, 這表明魚類的相對耐低氧特征很可能是受到血紅蛋白上游通路的調控。
3.3 翹嘴鲌的系統發育分析
系統發育關系發現Hba1/2和Hbb1/2基因在魚類、兩棲類和哺乳類均各自聚成一支, 且魚類各基因亞型也單獨聚為一支(圖 3和圖 4)。一般認為有頜類的α和β球蛋白是在450—500 Ma奧陶紀時全基因組復制事件中從無頜類中一個古基因復制分化而來的[16,17], 這表明Hba1/2和Hbb1/2基因亞型的復制事件很可能發生在脊椎動物全基因組復制之后且硬骨魚類全基因組復制事件之前。有研究表明在硬骨魚類全基因組復制事件之前, 脊椎動物中的一些基因會發生重復復制和刪除[20,38,39]。在系統進化樹中, 翹嘴鲌的Hba1/2和Hbb1基因與斑馬魚親緣關系較近, 而與虹鱒、鯉及白斑狗魚親緣關系較遠。從魚類分類學上看, 虹鱒和白斑狗魚隸屬鮭形目(Salmoniformes), 而翹嘴鲌和斑馬魚隸屬鯉形目(Cypriniformes), 因此翹嘴鲌與斑馬魚親緣關系更近。對于鯉, 從生理學上看, 鯉在體長11.3—14.2 cm、水溫30℃時, 窒息點為0.29 mg/L[23]。而翹嘴鲌在平均體重0.44—0.51 g、水溫29℃時, 其窒息點達到0.57 mg/L, 當水溫21℃時其窒息點為0.41 mg/L[22];斑馬魚平均體重約0.23 g、水溫20℃時, 其窒息點為0.41 mg/L[40]。這表明翹嘴鲌和斑馬魚耐氧能力相近很可能導致其在Hba1/2和Hbb1基因上有更近的親緣關系。
總之, 本研究首次克隆了翹嘴鲌Hba1、Hba2、Hbb1和Hbb2基因的cDNA全長序列。分析翹嘴鲌和其他物種血紅蛋白二級結構發現, 與兩棲類和哺乳類相比, 魚類Hba和Hbb蛋白功能域上分別有10和5個氨基酸殘基替換位點, 這些替換位點很可能是魚類能適應水中低氧環境的原因。這也有待后續的基因功能試驗來進行驗證。通過血紅蛋白基因系統發育關系表明Hba1/2和Hbb1/2基因亞型的復制事件很可能發生在脊椎動物全基因組復制之后且硬骨魚類全基因組復制事件之前, 而這是由脊椎動物中的一些基因會發生重復復制和刪除事件造成的。值得注意的是從系統進化樹上看, 由于翹嘴鲌和斑馬魚同屬鯉形目且均不耐低氧, 所以其在Hba1/2和Hbb1基因上的親緣關系更近。這些發現為魚類的耐低氧生物學研究提供了理論基礎。

