大豆蚜Kazal型絲氨酸蛋白酶抑制劑基因AgKaSPI對蠟蚧刺束梗孢菌侵染的表達響應
陳雅茹, 楊洪佳, 李 澤, 車進明,2, 王澤群, 樊 東,*
(1. 東北農業大學農學院, 哈爾濱 150030; 2. 桂應祥沙里院農業大學, 朝鮮平壤 95003)
在節肢動物中,絲氨酸蛋白酶(serine protease)及其同源蛋白是蛋白酶中的一個超家族,其成員包括胰蛋白酶、胰凝乳蛋白酶和彈性蛋白酶,數量占全部蛋白酶的2/3,這些蛋白酶都是維持生物體正常生命活動不可或缺的,且受絲氨酸蛋白酶抑制劑(serine proteinase inhibitor, SPI)的嚴格調控(趙麗芳等, 2016)。Kazal型SPI(Kazal-type serine proteinase inhibitor, KaSPI)是最為保守的一類,其廣泛的生物學功能使其成為當今的研究熱點(van Hoefetal., 2013)。在黑腹果蠅Drosophilamelanogaster(Niimietal., 1999)、大錐蝽Panstrongylusmegistus(Meiseretal., 2010)、東方蜜蜂Apiscerana(Kimetal., 2013)、埃及伊蚊Aedesaegypti(Torquatoetal., 2017)等30余種昆蟲中發現了KaSPI,主要作用于對絲氨酸蛋白酶的調節,從而影響昆蟲正常的生長發育(Gubbetal., 2010)。如在家蠶Bombyxmori絲腺中的包含3個Kazal結構域的BmKaSPI能有效抑制枯草桿菌蛋白酶,推測其在家蠶抵抗病原體入侵方面發揮著重要作用(Zhengetal., 2007);從麗蠅蛹集金小蜂Nasoniavitripennis毒液中克隆獲得兩個Kazal類絲氨酸蛋白酶抑制劑基因NvKSPI-1和NvKSPI-2。NvkSPI-1能抑制胰蛋白酶的活性,而NvKSPI-2對胰凝乳蛋白酶、胰蛋白酶和蛋白酶K 3種絲氨酸酶的活性均無影響(Qianetal., 2015)。來自蜜蜂毒液的Kazal型絲氨酸蛋白酶抑制劑不僅抑制枯草桿菌蛋白酶A和枯草桿菌蛋白酶K,而且還表現出對革蘭氏陽性細菌和真菌的抗菌活性(Yangetal., 2017)。在其他昆蟲中,KaSPIs還有助于保護昆蟲免受微生物蛋白酶或宿主消化蛋白酶的侵害,同時還參與食物消化、凝血、抑菌作用以及先天免疫反應(Soaresetal., 2015; Gonellaetal., 2019)。
大豆蚜Aphisglycines隸屬于半翅目蚜科(Aphididae),與其他昆蟲不同,蚜蟲基因組缺失大量的免疫相關基因(Gerardoetal., 2010)。盡管如此,蚜蟲的免疫系統仍能夠有效地對抗病原菌的入侵(Parkeretal., 2017)。為深入揭示絲氨酸蛋白酶抑制劑KaSPI在病原真菌侵染大豆蚜過程中的作用,本研究克隆了大豆蚜KaSPI基因cDNA的序列,對該基因進行RNAi后利用蠟蚧刺束梗孢菌Akanthomyceslecanii(簡稱蠟蚧菌)侵染大豆蚜,以探究KaSPI在昆蟲病原真菌侵染大豆蚜中的作用,為進一步利用KaSPI通過生物技術手段防治害蟲奠定基礎。
1 材料與方法
1.1 供試材料
供試昆蟲:本實驗所用大豆蚜來源于東北農業大學向陽實驗示范基地。以盆栽大豆苗(黑農54)為寄主,在無任何殺蟲劑接觸的條件下置于人工氣候箱中培養,溫度為25±2℃,相對濕度為70%±5%,光周期為14L∶10D。每隔一周接到新的大豆葉片上。
供試菌株:蠟蚧刺束梗孢菌(菌種編號BNCC336750)購自北納創聯生物技術有限公司。購買的凍干菌粉經復蘇,在PDA培養基上活化1~2代,接種于PDA培養基上,置于25℃恒溫箱中培養7 d,待菌株充分產孢后保存于4℃冰箱中,備用。
1.2 Kazal型絲氨酸蛋白酶抑制劑基因的克隆及氨基酸序列分析
在無菌操作臺中分別收集未接觸任何藥劑的1-4齡大豆蚜若蟲和成蟲于1.5 mL EP管中,提取RNA,按ReverTra Ace qPCR RT Kit試劑盒進行反轉錄合成cDNA,由安諾優達基因科技有限公司進行轉錄組測序。在轉錄組數據庫中篩選出大豆蚜Kazal型絲氨酸蛋白酶抑制劑基因AgKaSPI,在NCBI(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)上進行同源性比對后,利用Primer Premier 5.0設計全長序列引物AgKaSPI-Full-F/AgKaSPI-Full-R(表1),進行PCR擴增,反應體系(25 μL): 10×Easy Taq Buffer 2.5 μL, 大豆蚜成蟲cDNA 0.5 μL, 上下游引物(10 umol/L)各1 μL, High Pure dNTPs 2.5 μL, Easy Taq DNA Polymerase 0.5 μL, ddH2O 17 μL。反應條件: 94℃預變性5 min; 94℃變性30 s, 50℃退火30 s, 72℃延伸4 min, 35個循環;最后72℃保存10 min。將產物進行膠回收,由哈爾濱新海基因檢測有限公司測序后與轉錄組測序獲得的基因進行對比,對克隆得到的AgKaSPI基因序列進行準確性校對。利用DNAMAN軟件預測AgKaSPI開放閱讀框并翻譯成氨基酸序列。利用ExPASy網站(http:∥ca.expasy.org/tools/)的compute pI/Mw工具軟件預測氨基酸的等電點和分子量,利用Signal P 4.1Server預測信號肽。利用SMART在線網站(http:∥smart.embl-heidelberg.de/)預測氨基酸序列的結構域;在NCBI網站搜索昆蟲KaSPI氨基酸序列,利用MEGA 5.1軟件中鄰接(neighbor-joining)法構建系統進化樹。
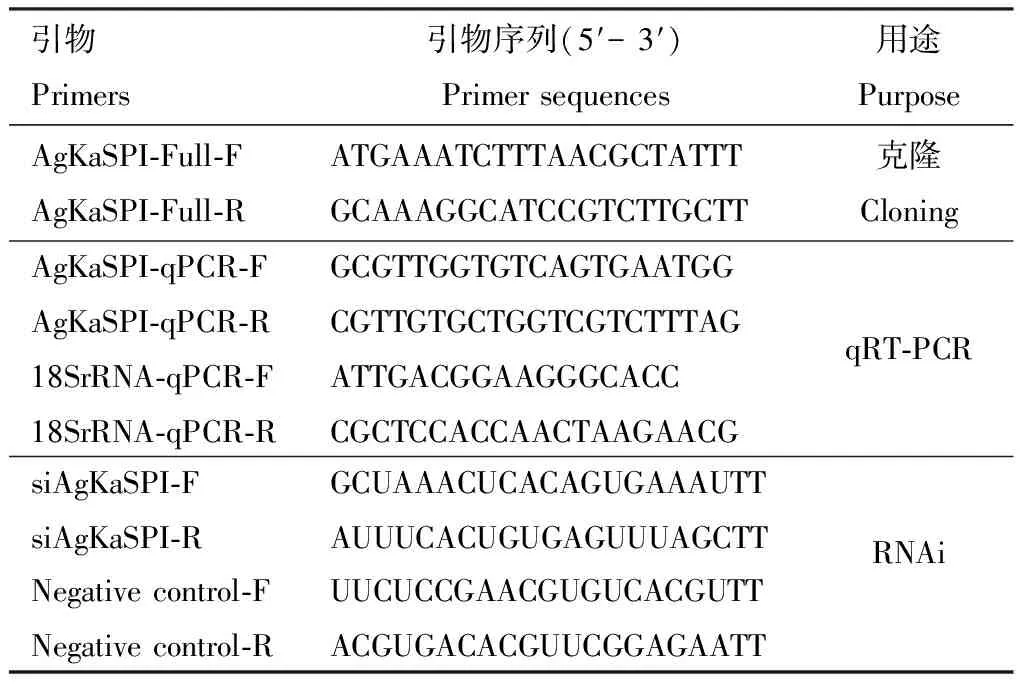
表1 引物信息Table 1 Primer information
1.3 AgKaSPI基因在大豆蚜不同齡期的表達模式分析
分別選取大豆蚜1-4齡若蟲和成蟲,30頭個體為一個生物學重復,設3個生物學重復。利用TRIzol法提取大豆蚜總RNA,每100 mg組織加入1 mL TRIzol?Reagent。提取的總RNA用紫外分光光度檢測,用1%瓊脂糖凝膠電泳鑒定RNA的純度和濃度,檢測合格后放入-80℃冰箱備用。取4 μg總RNA,按照ReverTra Ace qPCR RT Kit試劑盒進行反轉錄,合成cDNA第1鏈,-20℃保存。
根據1.2節克隆的AgKaSPIcDNA序列和內參基因18S rRNA基因(Bansaletal., 2012)設計qRT-PCR引物AgKaSPI-qPCR-F/AgKaSPI-qPCR-R和18SrRNA-qPCR-F/18SrRNA-qPCR-R(表1),大豆蚜不同發育階段的cDNA作為模板進行qRT-PCR,用熒光染料SYBR Primer Script RT-PCR Kit Mix(TOYOBO,日本)在Bio-Rad熒光定量PCR儀通過三步法進行qRT-PCR,反應體系(20 μL): SYBR qPCR Mix 10 μL, 上下游引物(10 pmol/μL)各0.6 μL, cDNA 2 μL, ddH2O 6.8 μL。反應程序: 94℃ 1 min; 95℃ 30 s, 59℃ 30 s, 72℃ 30 s, 40個循環。每發育階段3個生物學重復。
1.4 蠟蚧刺束梗孢菌侵染及AgKaSPI表達響應測定
供試孢子液的配制:收集1.1節已經在PDA培養基培養好的蠟蚧刺束梗孢菌分生孢子,經過濾后,用含0.1%吐溫80的無菌水分別配成1×108, 1×107, 1×106, 1×105和1×104孢子/mL的孢子懸浮液各50 mL備用,含0.1%吐溫80的無菌水作空白對照,采用浸漬法(Feng and Johnson, 1991)處理大豆蚜成蟲。連續觀察7 d,計算LC50,以此濃度浸漬法處理大豆蚜成蟲3, 6, 12, 24, 48和72 h,以含0.1%吐溫80的水溶液處理為對照,每個時間點取30頭大豆蚜為一個生生物學重復,設3個生物學重復,在液氮中快速冷凍并置于-80℃冰箱中保存備用。qRT-PCR(反應體系與條件同1.3節,下同)檢測大豆蚜經蠟蚧刺束梗孢菌侵染大豆蚜處理不同時間點AgKaSPI的表達,引物序列見表1。
1.5 AgKaSPI的RNAi
使用的AgKaSPI的siRNA(siAgKaSPI)和陰性對照(negative control, NC)siRNA(siNC)均是長度為21~23 bp的一段序列,由上海吉瑪公司設計并合成,均稀釋成濃度為20 μmol/L備用,陰性對照是與靶基因無同源性且在大豆蚜體內沒有生物學效應的基因序列,引物序列見表1。基于預試驗結果,將納米載體SPc(由中國農業大學植物保護學院昆蟲學系沈杰教授課題組提供)和siRNA以1∶1的體積比混合,然后加入總體積10%的洗滌劑(購自立白集團, 廣州)到混合液中,渦旋震蕩2~3次,室溫孵育30 min,使其充分結合形成穩定的復合體;取健康大豆蚜成蟲置于光學顯微鏡下,用顯微注射器吸取0.1 μL siRNA/SPc/洗滌劑復合體溶液,緩緩推出液滴,靠近大豆蚜背部,使液滴在表面活性劑作用下貼附于大豆蚜體壁表面,靜置10 min,對照組滴加等量的siNC。分別在處理3, 6, 12, 24和48 h時收集30頭大豆蚜成蟲置于1.5 mL EP管中,每處理3次重復,液氮速凍后置于-80℃冰箱中保存備用。通過qRT-PCR檢測不同時間的RNAi干擾效率,并記錄RNAi 12, 24, 48和96 h后的大豆蚜成蟲死亡數和產蚜量。
1.6 AgKaSPI蛋白含量測定
取1.4節蠟蚧刺束梗孢菌處理3, 6, 12, 24, 48和72 h及相應對照的大豆蚜成蟲,以及1.5節siAgKaSPI及siNC陰性對照處理3, 6, 12, 24和48 h的大豆蚜成蟲置于玻璃勻漿器中研磨5 min,在4℃條件下4 500 r/min離心15 min,收集上清液,即為待測酶液,備用。利用昆蟲Kazal型絲氨酸蛋白酶抑制劑酶聯免疫分析(ELISA)試劑盒(江蘇酶標生物科技有限公司),采用雙抗體夾心法測定蠟蚧刺束梗孢菌侵染和RNAi后大豆蚜體內AgKaSPI蛋白含量的變化,具體操作見說明書。每處理3個生物學重復,每樣品測定3次技術重復。
1.7 絲氨酸蛋白酶活性的測定
取1.4節蠟蚧刺束梗孢菌和對照處理3, 6, 12, 24, 48和72 h的大豆蚜成蟲,以及1.5節siAgKaSPI和siNC陰性對照處理 3, 6, 12, 24和48 h的大豆蚜成蟲,利用昆蟲絲氨酸蛋白酶(serine protease)、胰蛋白酶(trypsin)、胰凝乳蛋白酶(chymotrypsin)酶聯免疫分析(ELISA)試劑盒(江蘇酶標生物科技有限公司),采用雙抗體夾心法分別測定絲氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶的活性變化,具體操作見說明書,每處理3個生物學重復,每樣品測定3次技術重復。待測樣品的總蛋白質含量參照Bradford(1976)描述的考馬斯亮藍G-250染色法測定。樣品折算酶活力=樣品實際酶活力/樣品的總蛋白質含量,以樣品折算酶活力作為結果中樣品的酶活性。
1.8 RNAi后大豆蚜對蠟蚧刺束梗孢菌的敏感性變化測定
取1.5節siAgKaSPI處理6 h的30頭大豆蚜成蟲,用LC50濃度的蠟蚧刺束梗孢菌的孢子懸浮液,通過浸漬法處理存活的蚜蟲,方法同1.4節,12, 24, 48和96 h后觀察并記錄死亡情況。試驗重復3次。
1.9 數據分析
采用2-ΔΔCt法(Livak and Schmittgen, 2001)計算基因的相對表達量。利用SAS 9.0軟件單因素方差分析Duncan氏多重比較法進行各處理下不同時間點基因的相對表達量以及酶活性差異顯著性分析,死亡率的差異顯著性采用t檢驗法來分析,顯著性水平設置為P<0.05。數值計算及圖表制作利用Excel 2010進行。
2 結果
2.1 AgKaSPI基因序列特征
本實驗經在大豆蚜轉錄組數據庫中搜索、NCBI比對、保守結構域的查找及序列準確性校正,篩選出1條Kazal型絲氨酸蛋白酶抑制劑基因AgKaSPI的cDNA序列(GenBank登錄號: MK440557),長1 019 bp,開放閱讀框為324 bp,編碼107個氨基酸,含有197 bp的5′非編碼區和498 bp的3′非編碼區,N端含有21個氨基酸組成的信號肽。ExPASy分析所得氨基酸序列的蛋白質分子量為11.43 kD,等電點為9.24。通過SMART在線軟件對其結構域進行預測,發現AgKaSPI蛋白含有一個典型的Kazal結構域,該結構域具有6個半胱氨酸殘基(圖1)以特定模式(CysI-CysV, CysII-CysIV和CysIII-CysVI)形成3個二硫鍵,從而形成緊密的三維構象。

圖1 大豆蚜AgKaSPI基因cDNA序列及推導的氨基酸序列Fig. 1 cDNA and deduced amino acid sequences of AgKaSPI of Aphis glycines起始密碼子ATG和終止密碼子TAA用方框標注,信號肽序列用雙下劃線標注,保守半胱氨酸殘基加方框用灰色陰影標注。The start codon (ATG) and stop codon (TAA) are boxed. The signal peptides are double underlined. Conserved cysteine residues are indicated by gray shade.
2.2 AgKaSPI與其他昆蟲KaSPI氨基酸序列比對及系統進化關系
將AgKaSPI的氨基酸序列在NCBI中搜索,與獲得的其他昆蟲的KaSPI氨基酸序列構建系統發育樹(圖2),AgKaSPI與同屬半翅目蚜科的昆蟲棉蚜Aphisgossypii的ApKaSPI (GenBank登錄號: XP_027843052)、苜蓿蚜Aphiscraccivora的AcKaSPI (GenBank登錄號: KAF0767270)、豌豆蚜Acyrthosiphonpisum的ApKaSPI (GenBank登錄號: NP_001156573)和高粱蚜Melanaphissacchari的MsKaSPI (GenBank登錄號: XP_025194394)等親緣關系較近,與其他目昆蟲如柞蠶Antheraeapernyi的ApKaSPI (GenBank登錄號: AHZ90949)、家蠶Bombyxmori的BmKaSPI (GenBank登錄號: NP_001040250)和埃及伊蚊Aedesaegypti的AaKaSPI (GenBank登錄號: XP_001658905)等親緣關系較遠,昆蟲Kazal型絲氨酸蛋白酶抑制劑之間的系統進化關系與形態特征的系統進化關系具有一定的相關性。
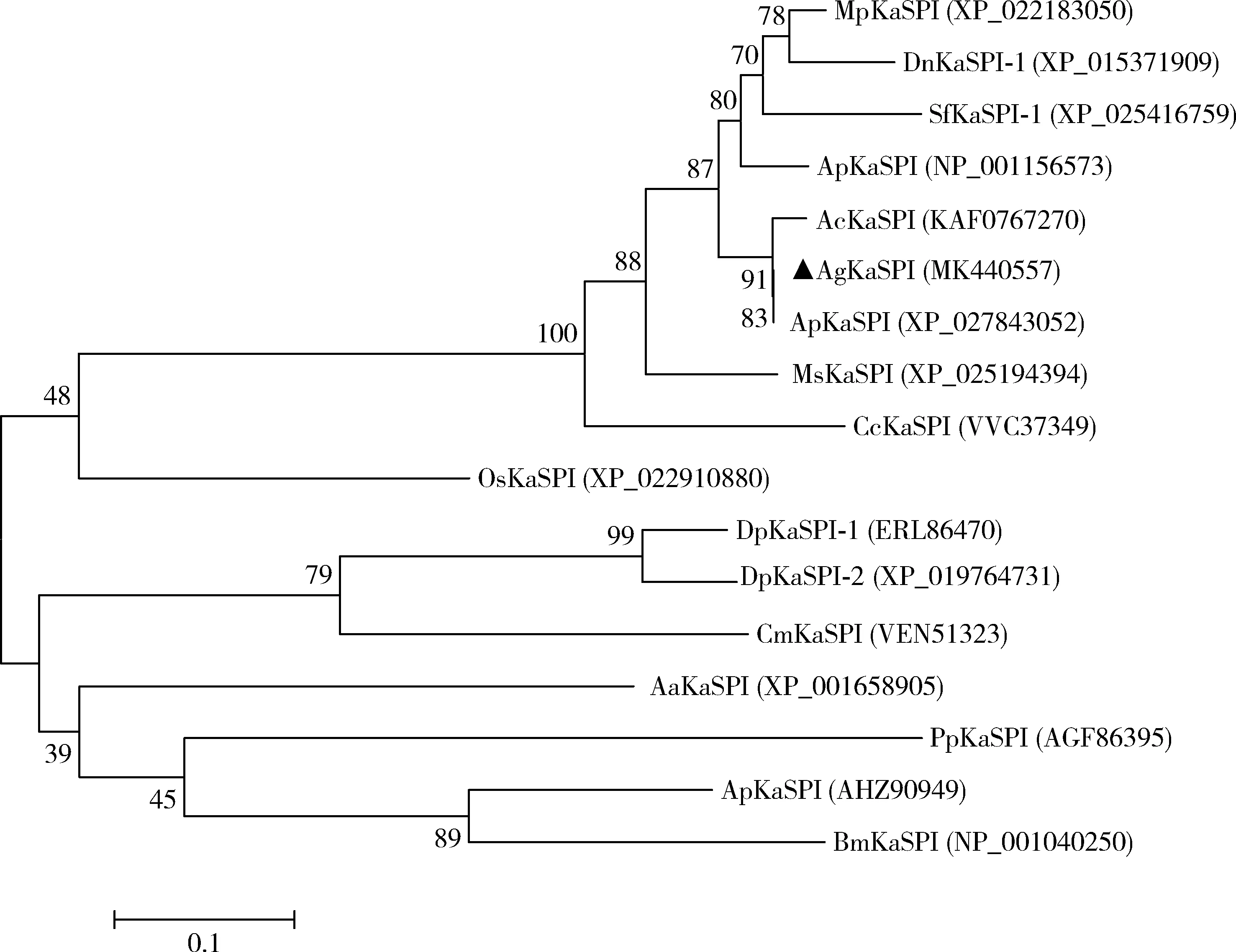
圖2 鄰接法構建的基于氨基酸序列的大豆蚜與其他昆蟲KaSPI的系統進化樹(1 000次重復)Fig. 2 Phylogenetic tree of KaSPI proteins from Aphis glycines and other insectsby neighbor-joining method based on amino acid sequence (1 000 replicates)KaSPI蛋白來源物種Origin species of KaSPI proteins: MpKaSPI: 桃蚜Myzus persicae; DnKaSPI-1: 麥雙尾蚜Diuraphis noxia; SfKaSPI-1: 甘蔗黃蚜Sipha flava; ApKaSPI: 豌豆蚜Acyrthosiphon pisum; AcKaSPI: 苜蓿蚜Aphis craccivora; AgKaSPI: 大豆蚜Aphis glycines; ApKaSPI: 棉蚜Aphis gossypii; MsKaSPI: 高粱蚜Melanaphis sacchari; CcKaSPI: 雪松長足大蚜Cinara cedri; OsKaSPI: 牛頭嗡蜣螂Onthophagus taurus; DpKaSPI-1, DpKaSPI-2: 中歐山松大小蠹Dendroctonus ponderosae; CmKaSPI: 四紋豆象Callosobruchus maculatus; AaKaSPI: 埃及伊蚊Aedes aegypti; PpKaSPI: 靜食白蛉Phlebotomus papatasi; ApKaSPI: 柞蠶Antheraea pernyi; BmKaSPI: 家蠶Bombyx mori.
2.3 AgKaSPI在大豆蚜不同發育階段的表達
利用qRT-PCR檢測大豆蚜1-4齡若蟲以及成蟲體內AgKaSPI的表達水平,結果表明該基因在大豆蚜不同發育階段皆有表達,在1齡若蟲體內的表達量最高,分別為其在2-4齡若蟲體內表達量的1.90, 2.37和2.12倍(P<0.05),但與在成蟲體內的表達量差異不顯著(P>0.05)(圖3)。
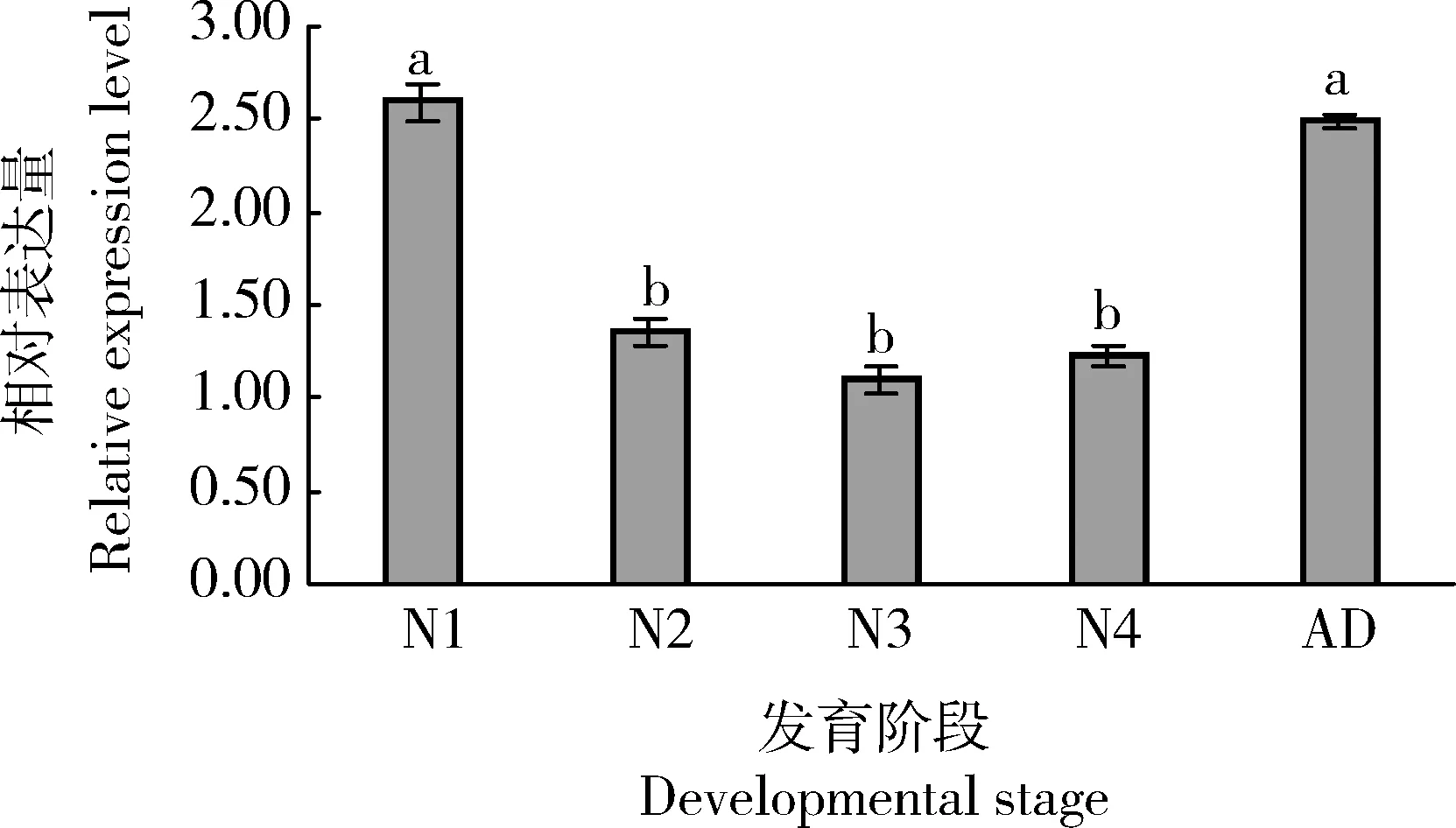
圖3 AgKaSPI在大豆蚜不同發育階段的相對表達量Fig. 3 Relative expression levels of AgKaSPI at differentdevelopmental stages of Aphis glycinesN1-N4: 分別為1-4齡若蟲1st-4th instar nymphs, respectively; AD: 成蟲Adult. 圖中數據為平均值±標準誤;柱上不同小寫字母表示基因表達量在不同發育階段間差異顯著(P<0.05, Duncan氏多重比較法)。Data in the figure are means±SE. Different lowercase letters above bars indicate significant difference in the gene expression level at different developmental stages (P<0.05, Duncan’s multiple range test).
2.4 蠟蚧刺束梗孢菌侵染大豆蚜對AgKaSPI表達的影響
通過預實驗蠟蚧刺束梗孢菌對大豆蚜室內毒力測定得到的LC50(4.05×106孢子/mL)的孢子懸浮液侵染大豆蚜成蟲,qRT-PCR檢測大豆蚜感染72 h內AgKaSPI的表達水平呈現先升高后降低的趨勢,侵染12, 24和48 h時,AgKaSPI表達量顯著上調(P<0.05),分別為對照組的2.23, 4.31和2.38倍(圖4),說明蠟蚧刺束梗孢菌侵染誘導了AgKaSPI的表達。
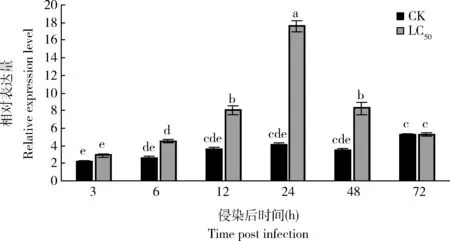
圖4 蠟蚧刺束梗孢菌侵染大豆蚜成蟲后AgKaSPI的表達量Fig. 4 Expression levels of AgKaSPI in Aphis glycines adults after infection by Akanthomyces lecanii用對大豆蚜成蟲LC50為4.05×106孢子/mL的孢子懸浮液進行侵染,含0.1%吐溫80的無菌水作空白對照(CK)。圖中數據為平均值±標準誤;柱上不同小寫字母表示基因表達量在不同處理時間點間差異顯著(P<0.05, Duncan氏多重比較法)。下圖同。The spore suspension with the LC50 value of 4.05×106 spores/mL against A. glycines adults was used for infection, and sterile water containing 0.1% Tween 80 was used as the blank control (CK). Data in the figure are means±SE. Different lowercase letters above bars indicate significant difference in the gene expression level among different treatment time points (P<0.05, Duncan’s multiple range test). The same for the following figures.
如圖5所示,經蠟蚧刺束梗孢菌侵染12, 24和48 h時大豆蚜AgKaSPI蛋白含量與對照組差異均顯著(P<0.05),分別為對照組的2.20, 1.69和1.98倍,但經蠟蚧刺束梗孢菌侵染72 h時與對照組蛋白含量差異不顯著(P>0.05)。可見該基因可能通過調節絲氨酸蛋白酶抑制劑的含量來參與大豆蚜對蠟蚧刺束梗孢菌的免疫應答。
2.5 蠟蚧刺束梗孢菌侵染對大豆蚜成蟲體內絲氨酸蛋白酶活性的影響
蠟蚧刺束梗孢菌侵染后大豆蚜成蟲體內絲氨酸蛋白酶(圖6: A)、胰蛋白酶(圖6: B)和胰凝乳蛋白酶(圖6: C)活性總體均呈先降低再升高的趨勢。侵染12, 24和48 h時,絲氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶活性顯著下降(P<0.05);侵染72 h時酶活力增強,但與對照差異不顯著(P>0.05)。結合圖5和圖6可知,蠟蚧菌可能通過短期誘導AgKaSPI蛋白的過表達抑制了大豆蚜體內絲氨酸蛋白酶的活性。
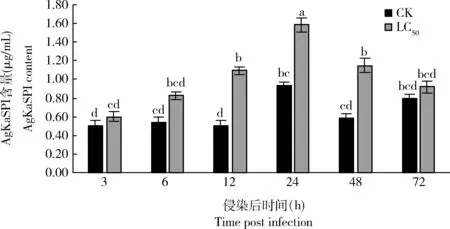
圖5 蠟蚧刺束梗孢菌侵染對大豆蚜成蟲體內AgKaSPI蛋白含量的影響Fig. 5 Effects of Akanthomyces lecanii infection on the AgKaSPI content in Aphis glycines adults

圖6 蠟蚧刺束梗孢菌侵染對大豆蚜成蟲絲氨酸蛋白酶(A)、胰蛋白酶(B)和胰凝乳蛋白酶(C)活性的影響Fig. 6 Effects of Akanthomyces lecanii infection on the activities of serine proteinase (A),trypsin (B) and chymotrypsin (C) in Aphis glycines adults
2.6 AgKaSPI的RNAi效果
RNAi后,AgKaSPI基因被成功沉默,AgKaSPI表達量在干擾6, 12和48 h時均有不同程度的下降,表達量分別下降了71.05%, 36.22%和21.05%,且6和12 h時與對照組相比差異均顯著(P<0.05)(圖7)。
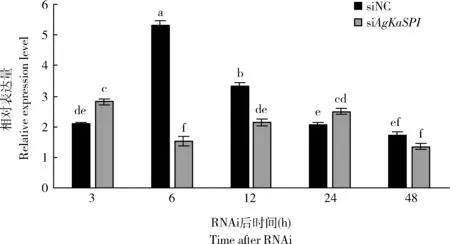
圖7 RNAi對大豆蚜成蟲體內AgKaSPI表達的影響Fig. 7 Effects of RNAi on the expression of AgKaSPI in Aphis glycines adultsNC: 陰性對照Negative control. 下同The same below.
RNAi干擾AgKaSPI24, 48和96 h時大豆蚜成蟲死亡率處理組與陰性對照組相比差異均顯著(P<0.05)(表2),分別增加了5.11%, 8.02%和10.12%。表明AgKaSPI干擾對大豆蚜具有一定的致死效應。
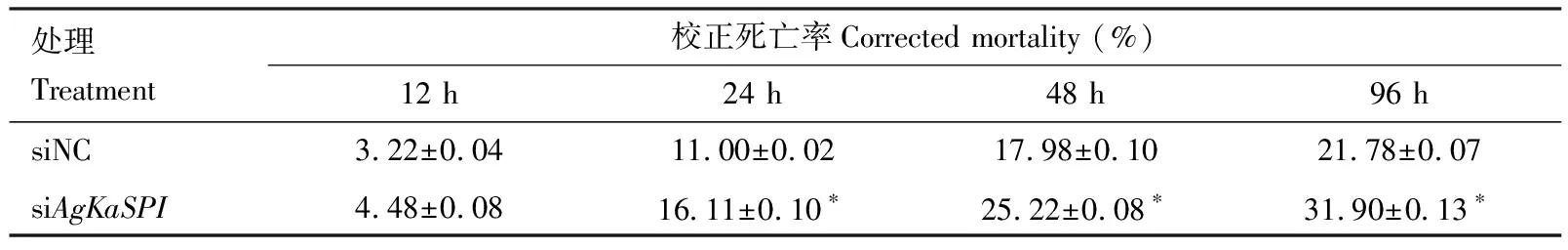
表2 RNAi干擾AgKaSPI后不同時間大豆蚜成蟲的校正死亡率Table 2 Corrected mortality of Aphis glycines adults at different time after RNAi of AgKaSPI
RNAi干擾AgKaSPI24, 48和96 h時對照組大豆蚜每百頭產蚜量分別為449±38, 505±48和749±74頭,處理組分別為400±45, 476±60,和708±78頭,24和96 h時處理組均顯著低于對照組(P<0.05),說明AgKaSPI沉默對大豆蚜的繁殖具有一定的影響(圖8)。
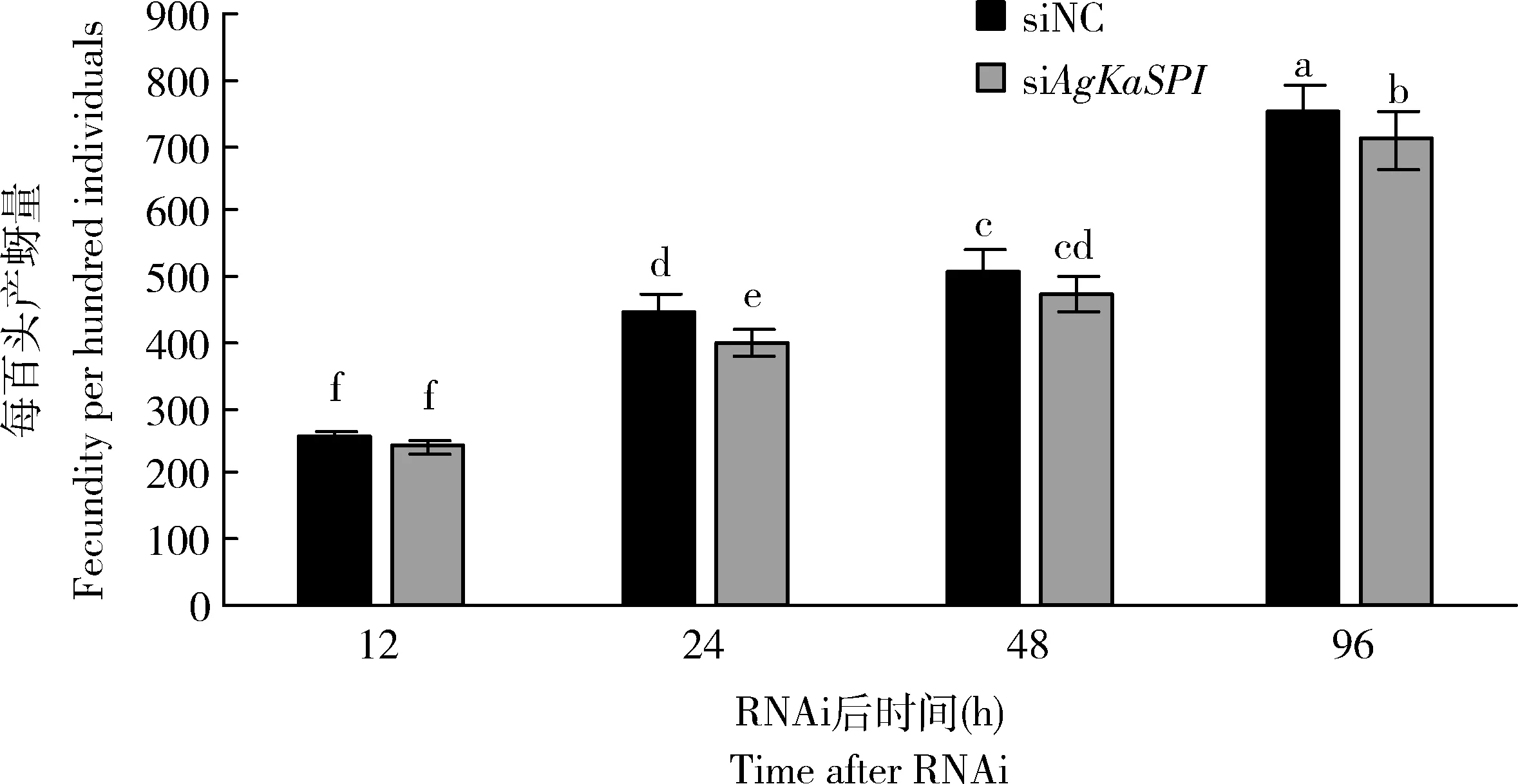
圖8 AgKaSPI的RNAi對大豆蚜產蚜量的影響Fig. 8 Effects of RNAi of AgKaSPI on the fecundity of Aphis glycines
為進一步研究AgKaSPI在大豆蚜相應蠟蚧刺束梗孢菌侵染的代謝中的作用,用雙抗體夾心法檢測了RNAi干擾AgKaSPI3, 6, 12, 24和48 h時大豆蚜成蟲體內AgKaSPI蛋白含量的變化。如圖9所示,RNAi干擾不同時間點,AgKaSPI蛋白含量均有不同程度的減少,12和24 h時AgKaSPI蛋白含量與對照組相比差異顯著(P<0.05),AgKaSPI蛋白含量分別下降了51.11%和44.52%。
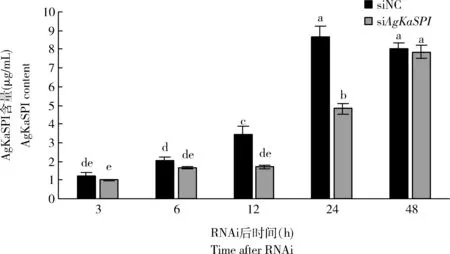
圖9 RNAi干擾AgKaSPI對大豆蚜成蟲體內AgKaSPI蛋白含量的影響Fig. 9 Effects of RNAi of AgKaSPI on the AgKaSPI content in Aphis glycines adults
2.7 干擾AgKaSPI對大豆蚜成蟲體內絲氨酸蛋白酶活性的影響
干擾AgKaSPI后絲氨酸蛋白酶(圖10: A)、胰蛋白酶(圖10: B)和胰凝乳蛋白酶(圖10: C)活性總體呈先升高再降低趨勢。干擾12 h時,絲氨酸蛋白酶和胰凝乳蛋白酶活性開始增加,干擾24 h時,絲氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶活性顯著增強。通過AgKaSPI沉默減少絲氨酸蛋白酶抑制劑的含量可增強大豆蚜絲氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶的活性,說明AgKaSPI可能通過調節絲氨酸蛋白酶抑制劑的含量對絲氨酸蛋白酶進行有效的調控。
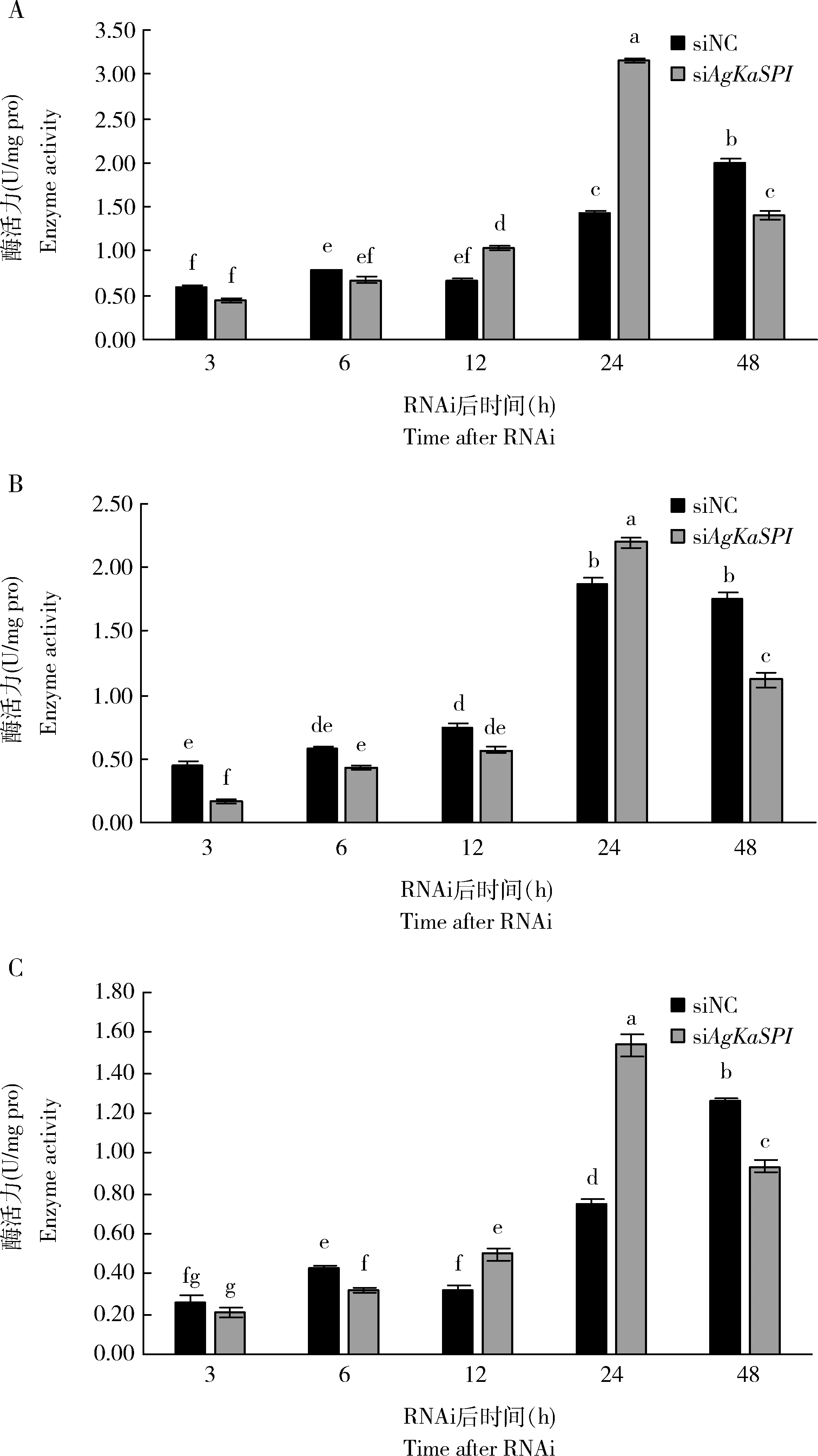
圖10 RNAi干擾AgKaSPI對大豆蚜成蟲體內絲氨酸蛋白酶(A)、胰蛋白酶(B)和胰凝乳蛋白酶(C)活性的影響Fig. 10 Effects of RNAi of AgKaSPI on the activities of serine proteinase (A),trypsin (B) and chymotrypsin (C) in Aphis glycines adults
2.8 AgKaSPI沉默對大豆蚜對蠟蚧刺束梗孢菌敏感性的影響
AgKaSPI沉默后(RNAi 6 h)的大豆蚜成蟲經蠟蚧刺束梗孢菌侵染24, 48和96 h后,大豆蚜成蟲死亡率與對照組相比差異均顯著(P<0.05),分別提高了8.90%, 20.88%和21.48%(表3),證明AgKaSPI沉默后蠟蚧刺束梗孢菌對大豆蚜的侵染率顯著提高。
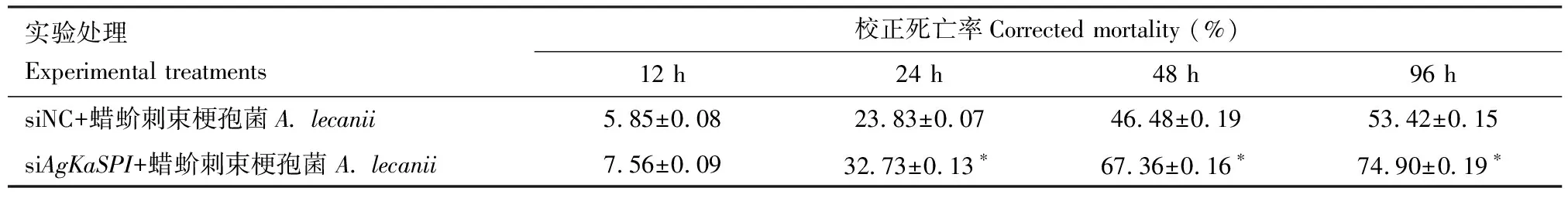
表3 RNAi干擾AgKaSPI后蠟蚧刺束梗孢菌侵染大豆蚜成蟲的校正死亡率Table 3 Corrected mortality of Aphis glycines adults after infection by Akanthomyces lecanii following RNAi of AgKaSPI
3 討論
本研究獲得一條大豆蚜的具Kazal結構域的絲氨酸蛋白酶抑制劑基因的cDNA序列,命名為AgKaSPI(GenBank登錄: MK440557)。根據Aymara最新分類方式(Cabrera-Muozetal., 2019),AgKaSPI屬于經典型KaSPI,其推導的氨基酸序列含有一個保守的Kazal結構域。
AgKaSPI在大豆蚜不同發育階段均有表達(圖3)。昆蟲絲氨酸蛋白酶抑制劑基因表達受病原菌正調控,大豆蚜經蠟蚧刺束梗孢菌孢子懸浮液處理后,AgKaSPI基因表達量顯著上調(圖4),AgKaSPI蛋白含量增加(圖5),絲氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶活性受到抑制(圖6),說明AgKaSPI可能通過調節體內絲氨酸蛋白酶的活性來參與大豆蚜抵制病原菌的侵入;有研究表明,KaSPI不僅可以調節內源性絲氨酸蛋白酶,也可調控外源性絲氨酸蛋白酶(Wangetal., 2009),故也可能是AgKaSPI抑制了在蠟蚧刺束梗孢菌感染時分泌的真菌來源的絲氨酸蛋白酶的活性,使測得的絲氨酸蛋白酶的活性下降。柞蠶ApKTSPI基因在核型多角體病毒(nuclear polyhedrosis virus, NPV)、大腸桿菌Escherichiacoli和白僵菌免疫刺激后表達量都能上調(王磊等, 2014)。埃及伊蚊KaSPI在病毒的免疫刺激后表達量上調(Soaresetal., 2018)。這些研究結果均說明昆蟲蛋白酶抑制劑參與了昆蟲的免疫反應。
為進一步研究AgKaSPI在蠟蚧刺束梗孢菌誘導代謝中的作用,利用RNAi技術對AgKaSPI進行功能研究。Yan等(2020)采用dsRNA/納米載體/洗滌劑配方,通過體壁滲透法可有效地抑制大豆蚜靶基因(dsATPD+dsATPE)的表達,沉默效率可達86.86%,死亡率高達81.67%。本研究通過將體外合成的siRNA/納米載體/洗滌劑復合液滴至大豆蚜成蟲的背部進行RNAi。qRT-PCR結果表明AgKaSPI表達量(圖7)和KaSPI蛋白含量(圖9)均明顯下降,同時絲氨酸蛋白酶和胰凝乳蛋白酶活性顯著增強(圖10),產蚜量明顯降低(圖8),說明AgKaSPI沉默會引起相關蛋白和酶活性的變化,甚至對大豆蚜的繁殖產生影響。在東亞飛蝗Locustamigratoriamanilensis中也發現了一種與生殖有關的Kazal型絲氨酸蛋白酶抑制劑基因Greglin,通過降低蝗蟲雌蟲中Greglin的含量,導致東亞飛蝗卵母細胞成熟受阻,卵巢生長停滯和卵泡上皮細胞萎縮,以及產卵量和孵化率下降,表明該基因參與了蝗蟲的生殖過程(Guoetal., 2019)。本研究中AgKaSPI沉默后進行蠟蚧刺束梗孢菌侵染,大豆蚜成蟲的死亡率明顯提高(表3),推斷AgKaSPI對蠟蚧刺束梗孢菌具有抑制作用。在其他昆蟲中也報道了KaSPI的抑菌作用,如在家蠶中發現包含3個Kazal結構域的BmSPI能有效抑制枯草桿菌蛋白酶,推測其在家蠶抵抗病原體入侵方面發揮著重要作用(Zhengetal., 2007);蜜蜂AcVSPI可與細菌和真菌表面結合,并表現出對真菌以及革蘭氏陽性和革蘭氏陰性細菌的抗微生物活性(Kimetal., 2013),可見昆蟲中KaSPI在抵抗病原菌入侵方面起著重要作用。
本研究測定分析了蠟蚧刺束梗孢菌處理對大豆蚜AgKaSPI基因表達水平以及AgKaSPI酶活性的影響,結果說明AgKaSPI能夠作為負調控因子控制病原真菌對大豆蚜侵染引起的免疫反應。利用體壁滲透法進行的RNAi將在病蟲害防治領域顯示出了很大的潛力,將推動基于RNAi的害蟲防治的實踐與發展。

