副干酪乳桿菌與芽孢桿菌屬共培養種間關系對產細菌素的影響
姜雪雍,岳元春,孫養存,高冬妮,平文祥,葛菁萍
(1黑龍江大學農業微生物技術教育部工程研究中心,哈爾濱150080;2微生物黑龍江省高校重點實驗室/黑龍江大學生命科學學院,哈爾濱150500)
0 引言
刺激次生代謝產物生物合成的一種方法是用生物脅迫來挑戰給定的微生物,該脅迫可以通過與其他微生物共培養來實現[1]。共培養可以提高菌株活性,也可以在基礎水平上提高代謝物的產量[2]。然而在自然環境中,微生物在共培養狀態下的生態學關系繁雜多變,微生物之間的協同代謝、互惠共生、相互競爭、代謝物中的信號分子等的相互作用,都對共培養體系中目標產物產量和新物質的產生有影響[3]。在一定條件下,微生物共培養時的代謝活動會偏利于其中一方或二者互惠共生,從而提高目的產物的產量[4]。以乳酸菌和芽孢桿菌的共培養來說,分泌細菌素和產生芽孢都是爭奪營養及空間的有效方式[5-6],乳酸菌和芽孢桿菌種類的不同、共培養中菌群密度的改變,在某種程度上會影響二者的生態關系[6-7]。研究證明,枯草芽孢桿菌(Bacillus subtilis)BN會促進乳酸桿菌的生長,二者共培養具有互利共生的關系[8]。當納豆芽孢桿菌與干酪乳桿菌的接種比例為1:2時,關系為偏利共生,代謝產物納豆激酶(NK)活力及吡咯喹啉醌(PQQ)含量得到顯著提升[9]。將蠟樣芽孢桿菌(Bacillus cereus)NVH 45與干酪乳桿菌(Lactobacillus casei)2756進行共培養時,B.cereus的生長被抑制并且無芽孢形成,體現對其偏害的生態關系,但與嗜酸乳桿菌(Lactobacillus acidophilus)NCFB 1748共培養時B.cereus僅略有減少并有芽孢形成,體現互利共生的生態關系,其中乳酸菌的接種量(107cfu/mL)遠高于B.cereus(102cfu/mL)[10]。將青春雙歧桿菌(Bifidobacterium adolescentis)ATCC 15703與B.cereus ATCC 9634共培養,當B.adolescentis的接種量遠高于B.cereus時,B.adolescentis的生長速率遠高于純培養對照,而B.cereus的菌數顯著下降,此時二者形成的是對B.adolescentis偏利而對B.cereus偏害的生態關系[11]。將保加利亞乳桿菌(Lactobacillus bulgaricus)接入培養至48 h的枯草芽孢桿菌(Bacillus subtilis)中,L.bulgaricus的生長受到抑制,在這種條件下是對L.bulgaricus偏害的生態關系,然而將同等比例的L.bulgaricus和B.subtilis同時接種,二者均可進入穩定生長期,并能提高代謝產物紅豆抗氧劑的濃度[12]。
副干酪乳桿菌(Lactobacillus paracasei)HD1.7可以產生細菌素Paracin1.7,其抑菌能力比Nisin更廣泛,具有抑菌譜廣等特點,是一種極具應用潛力的天然防腐劑[13-14]。L.paracasei HD1.7與B.subtilis以1:1(%,v/v)的接種比例共培養時,B.subtilis能促進L.paracasei HD1.7的生長、細菌素Paracin 1.7產量增加與群體感應相關基因基因luxS、prcK和prcR的上調表達,然而L.paracasei HD1.7則抑制B.subtilis的生長、芽孢形成及芽孢形成相關基因spo0A、sigE、sigF和sigG的表達[15]。此條件下L.paracasei HD1.7對B.subtilis偏害,而B.subtilis對L.paracasei HD1.7偏利。為了促成B.subtilis與L.paracasei HD1.7協同合作的種間關系,以及確定芽孢桿菌屬微生物分泌的信號物質對L.paracasei HD1.7產細菌素的促進作用是否具有普遍性,本文旨在探究芽孢桿菌初始接種比例和種類的不同對于共培養體系中種間關系穩定以及對L.paracasei HD1.7產細菌素的影響,通過提高芽孢桿菌的初始接種量,探究在此條件下二者的生態學關系。
1 材料與方法
1.1 試驗材料
1.1.1 供試菌株 副干酪乳桿菌(Lactobacillus paracasei)HD1.7是從東北酸菜發酵液中分離得到的菌株[14],用作實驗菌種。枯草芽孢桿菌(Bacillus subtilis)(ATCC 11774)為共培養實驗菌種以及抑菌試驗指示菌,地衣芽孢桿菌(Bacillus licheniformis)、短小芽孢桿菌(Bacillus pumilus)、蠟樣芽孢桿菌(Bacillus cereus)、側孢芽孢桿菌(Bacillus laterosporus)以及蘇云金芽孢桿菌(Bacillus thuringiensis)為共培養實驗菌種,探究芽孢桿菌屬與L.paracasei HD1.7種間關系。以上菌種均保藏于黑龍江大學微生物重點實驗室。
1.1.2 培養基 MRS(De Man,Rogosa and Sharp)培養基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母浸粉5 g,磷酸氫二鉀2 g,檸檬酸銨2 g,無水亞硫酸鈉0.1 g,硫酸鎂0.2 g,硫酸錳0.05 g,無水乙酸鈉5 g,吐溫-80 1 mL,補蒸餾水至1000 mL,pH 5.5,108℃高壓滅菌20 min,用于L.paracasei HD1.7的活化。在MRS固體培養基(含2%瓊脂的液體培養基)上培養48 h,得到菌落計數。
BP(Beef Extract Peptone)培養基:牛肉膏3 g,蛋白胨10 g,氯化鈉5 g,瓊脂20 g,加蒸餾水至1000 mL,pH 7.0,121℃高壓滅菌15 min,作為芽孢桿菌屬的種子液培養基。在BP固體培養基(含2%瓊脂的液體培養基)上測定菌落數和芽孢數。在抑菌試驗中,使用BP半固體培養基(含0.75%瓊脂的液體培養基)為上層培養基,下層為水瓊脂培養基:瓊脂20 g,補蒸餾水至1000 mL,pH自然,121℃滅菌15 min。
CO培養基:酵母提取物10 g,葡萄糖20 g,磷酸二氫鉀2.5 g,硫酸鎂0.2 g,1 mol/L硝酸鈣1 mL,0.1 mol/L氯化錳1 mL,1 mmol/L硫酸亞鐵1 mL,pH 6.5,加蒸餾水至 1000 mL,108℃滅菌 20 min,作為 L.paracasei HD1.7與芽孢桿菌屬共培養的發酵培養基。
1.1.3 擴增引物 熒光定量PCR試驗所用引物由Invitrogen技術有限公司合成,群體感應相關基因引物序列:luxS-up:5′-ATGGCAAAAGTT GAAAGTTTCA C-3′和 luxS-down:5′-CTAGACAACCTGACGCGT GTACG-3′;prcK-up:5′-AAGATGGTATTTGGATGTC GGC-3′和 prcK-down,5′-GCTCGTCGTGATTCATTG GTG-3′;prcR-up:5′-AGGGATGTCAATGTCCAGC AG-3′和 prcR-down:5′-GCCGAAATCAAATTCACC ACTC-3′。芽孢形成相關基因引物序列:spo0A-up:5′-ATGGAAGTGATCGGCGTTGC-3′和 spo0A-down:5′-CTTCCTGCCCAAAGGCTGTC-3′;sigE-up:5′-CTGC TGATGAAACTTGGGCTG-3′和 sigE-down:5′-CGG GAGGCATAGGTAGCAAGC-3′;sigF-up:5′-CCAAA ATGGCGACCAGCAG-3′和 sigF-down:5′-CGCGC CGGATTTTGTTTC-3′;sigG-up:5′-CTTGTAAACG GGAACTTGCG-3′和 sigG-down:5′-CGGCTCCTTG CTTGTCTCAC-3′。
1.2 菌體及芽孢計數
取0.5 mL各發酵時期的L.paracasei HD1.7和B.subtilis接觸共培養的發酵液于4.5 mL無菌水中進行梯度稀釋后,取0.1 mL涂布于BP及MRS固體培養基中,置于37℃的恒溫培養箱中,分別培養24 h(芽孢桿菌)和 48 h(L.paracasei HD1.7),進行菌落計數[16-17]。取不同時期發酵液1.5 mL置于2 mL離心管中,80℃水浴鍋中加熱20 min(確保將營養體全部殺死),稀釋涂布于BP固體培養基中,置于37℃培養箱中培養24 h,進行芽孢計數。
1.3 細菌素Paracin 1.7粗制液的制備
將取得的發酵液樣品于12000 r/min、4℃離心10 min,去除沉淀并將上清液用0.22 μm細菌濾器進行過濾除菌,所得的發酵上清液即為含有Paracin 1.7的粗制液[18-20]。使用杯碟法檢測發酵上清液的抑菌活性[21],其中細菌素Paracin 1.7對指示菌B.subtilis抑菌圈直徑差值(x)與細菌素效價對數值(y)之間的標準曲線(1)[22]。

1.4 共培養實驗
首先,將B.subtilis與L.paracasei HD1.7的初始接種比例調整為3:1、5:1和5:2(%),分別接種于100 mL的CO培養基中,接觸性共培養60 h,37℃、160 r/min,每隔4 h進行取樣,以接種量為1%和2%單培養的L.paracasei HD1.7以及3%和5%單培養的B.subtilis為對照,檢測各組分發酵液pH、活菌數、產芽孢數以及細菌素的抑菌活性,在發酵培養36 h時,采用qRT-RCR檢測L.paracasei HD1.7群體感應相關基因luxS、prcK和prcR以及B.subtilis芽孢形成相關基因sigE,sigF,sigG和spo0A的基因表達差異情況。確定最佳的接種比例后,將該比例應用于L.paracasei HD1.7與芽孢桿菌屬微生物的共培養中,進而驗證二者在調整比例后的生態學關系。
1.5 熒光定量PCR檢測基因轉錄水平變化
使用RNA prep Pure細菌總RNA提取試劑盒提取菌液RNA,通過Nanodrop 2000核算分析儀檢測RNA樣本的純度和濃度。利用BioRT cDNA第一鏈合成試劑盒反轉錄合成cDNA。以2種菌株單獨培養為對照組,共培養為實驗組,每組取適量cDNA作為模板,添加特異性引物、SYBR Solution/RealMasterMix和去離子水,擴增群體感應相關基因luxS、prcK和prcR以及芽孢形成相關基因spo0A、sigE、sigF和sigG。獲得各樣品的CT值以相對定量2-△△CT法進行分析,以內參基因16S rRNA校正[23]。
1.6 試驗數據的統計學分析
利用SPSS(StatisticalProductandService Solutions)軟件對試驗數據進行統計學分析,以X±SD表示。采用T-TEST對試驗數據進行差異顯著性分析,當P<0.05為差異顯著,用*表示;當P<0.01為差異極顯著,用**表示。利用Canoco 5(version 5.0)進行理化因子與微生物的相關性分析。
2 結果與分析
2.1 B.subtilis接種率對共培養體系的影響
L.paracasei HD1.7單培養以及與B.subtilis共培養時,各組pH表現出一致的變化規律,均在0~24 h呈現下降趨勢,24~60 h趨于平穩,最后都達到了3.2~3.8之間,其中當B.subtilis與L.paracasei HD1.7的接種比例為5%:1%時,pH的降低被延緩,最終為3.79。當B.subtilis單培養時,pH的趨勢為先下降后上升再下降(圖1A)。說明隨著B.subtilis接種比例提高可能消耗部分乳酸,減緩共培養體系內pH的降低[24]。
從B.subtilis的活菌數來看(圖1B),不同比例共培養相對于其各自單培養而言,其活菌數均下降,并且3%:1%和5%:2%均在36 h后檢測不到菌體。然而,接種量比例為5%:1%時,在60 h依然有活菌的存在,為1.70±0.31 log10(CFU/mL),說明該比例條件可以有效的延長芽孢桿菌的存活時間。

圖1 不同接種比例單培養以及共培養體系中pH的變化(A)和B.subtilis活菌數(B)
對于L.paracaseiHD1.7而言(圖2A),5%:1%共培養的比例下其活菌數從6.30±0.08 log10(CFU/mL)開始上升至12 h后出現緩慢下降并于36 h達到穩定,為8.00±0.09 log10(CFU/mL),而3%:1%和5%:2%共培養的比例下,活菌數均先上升至24 h后下降,在60 h時活菌數分別為8.32±0.16 log10(CFU/mL)和8.43±0.13 log10(CFU/mL)。說明此接種比例提高會抑制共培養體系內L.paracaseiHD1.7的生長,促使其活菌數減少。
3%:1%、5%:1%和5%:2%三種不同比例的共培養相對于單培養而言,細菌素的產生時間均從12 h提前到8 h,并且均在36 h達到穩定,其產量相對于單培養而言分別提高了1.18、1.21和1.34倍,差異均極顯著(圖2B)。與此同時,對于3種不同比例共培養后B.subtilis產芽孢量均出現提高,分別為其單培養的3.68、5.95和4.88倍(表1)。

表1 不同接種比例共培養與單培養中B.subtilis產芽孢數之比
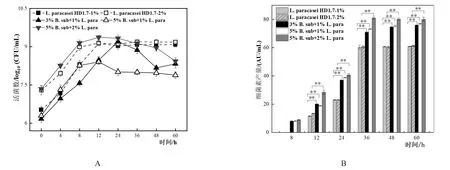
圖2 不同接種比例單培養以及共培養體系中L.paracasei HD1.7活菌數(A)及其抑菌活性(B)
由共培養體系中物種與環境變量相關關系的冗余分析(RDA()圖3)可知,細菌素的產生與發酵時間、芽孢數、L.paracaseiHD1.7活菌數呈正相關,與B.subtilis活菌數、pH及B.subtilis比L.paracaseiHD1.7的接種比例呈負相關關系。從投影長度來看,發酵時間、B.subtilis活菌數以及芽孢數對L.paracaseiHD1.7產細菌素的相關性最高。
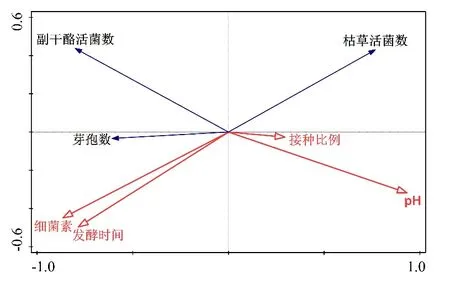
圖3 L.paracasei HD1.7與B.subtilis共培養體系中物種與環境變量相關關系的冗余分析(RDA)
綜合以上結果可知,共培養體系中B.subtilis營養體及芽孢的存在都對L.paracaseiHD1.7產細菌素有刺激作用。當調整二者的接種比例后,隨著B.subtilis促進L.paracaseiHD1.7產細菌素的同時,其自身也形成更多的芽孢來回避細菌素的攻擊,形成協同合作的種間關系,最適比例為5%:1%。
2.2 不同比例下群體感應及芽孢形成相關基因mRNA的表達
2.2.1L.paracaseiHD1.7群體感應相關基因檢測 由圖4A可知,5%:1%和3%:1%共培養的接種比例下,其luxS、prcK和prcR基因的轉錄水平均高于1%單培養的L.paracaseiHD1.7,其中luxS表達水平分別提高3.14倍和2.91倍,prcK表達水平提高4.98和4.03倍,prcR表達水平提高5.41和4.90倍。而5%:2%共培養的接種比例下相對于2%單培養的L.paracaseiHD1.7而言,其luxS、prcK和prcR基因的轉錄水平分別提高了3.19、5.06和5.46倍,其相對于各自的對照組而言均差異極顯著。
2.2.2B.subtilis芽孢形成相關基因檢測 由圖4B可知,5%:1%和5%:2%共培養的接種比例下,B.subtilis芽孢形成相關基因spo0A、sigE、sigF和sigG基因的轉錄水平均高于5%單獨培養的B.subtilis,其中spo0A轉錄水平提高2.37倍和2.17倍,sigE基因的轉錄水平提高2.71倍和2.35倍,sigF基因的轉錄水平提高3.15倍和3.03倍,sigG基因的轉錄水平提高2.56倍和2.13倍。而3%:1%共培養的接種比例下相對于3%單培養的B.subtilis而言,其spo0A、sigE、sigF和sigG基因的轉錄水平分別提高了2.02、1.43、2.47和2.08倍。
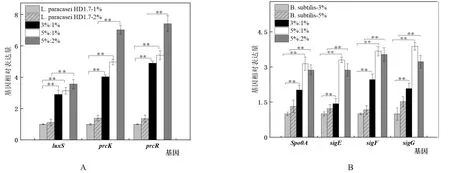
圖4 不同比例下L.paracasei HD1.7群體感應相關基因luxS、prcK和prcR(A)以及B.subtilis芽孢形成基因spo0A、sigE、sigF和sigG(B)相對表達量的差異
結果表明,將L.paracaseiHD1.7與B.subtilis的接種比例調整為3%:1%、5%:1%和5%:2%三種不同的接種比例后,相對于單培養而言L.paracaseiHD1.7群體感應相關基因均上調,并且B.subtilis芽孢形成相關基因也均上調,與2.1中發酵試驗結果一致,由此可以說明:在此條件下L.paracaseiHD1.7與B.subtilis共培養時,既提高了細菌素產量,B.subtilis也通過形成更多的芽孢回避細菌素的攻擊,協同合作最佳的接種比例是B.subtilis:L.paracaseiHD1.7為5%:1%,將此接種比例應用于芽孢桿菌屬中,探究在此比例下,二者的協同合作關系在芽孢桿菌屬中是否為普遍現象。
2.3 芽孢桿菌屬與L.paracasei HD1.7以5%:1%比例共培養
將6種芽孢桿菌屬5%的接種量單培養于CO培養基中,除B.pumilus發酵液pH從最初的大約6.07下降到24 h(pH為4.65)隨后迅速上升至6.65外,其余5株芽孢桿菌的發酵液pH的總趨勢均下降且B.cereus、B.megaterium、B.laterosporus、B.licheniformis和B.thuringiensis等發酵液pH 分別降至4.76、4.61、4.63、4.65和4.54(圖5A)。當芽孢桿菌屬與L.paracaseiHD1.7接種比例為5%:1%時,其發酵液的pH隨著時間的推移而下降,其中B.cereus、B.megaterium、B.pumilus、B.laterosporus、B.licheniformis和B.thuringiensis分別下降至3.67、3.74、3.17、3.81、4.09和4.12,由于引入產酸的L.paracaseiHD1.7因此共培養的發酵液pH均低于其5%單培養(圖5B)。
將6種芽孢桿菌屬以5%的接種量單培養于CO培養基中,在8 h前,各體系活菌數均上升,B.pumilus于36 h后又出現緩慢上升的趨勢直至48 h后穩定,其余芽孢桿菌均降至大約36 h后趨于穩定(圖6A)。共培養體系中,各芽孢桿菌活菌數也與其單培養一樣出現先上升后下降的趨勢,并且培養至60 h時,B.licheniformis、B.megaterium和B.pumilus仍然有活菌的存在,而B.cereus、B.thuringiensis和B.laterosporus分別在36、48和60 h檢測不到活菌(圖6B),同時其共培養情況下產芽孢量相對于單培養而言也無顯著提升(表2)。芽孢桿菌屬在共培養中,B.pumilus芽孢的產生量相對于單培養而言提升最多,在60 h其共培養的產孢量約是單培養的4.88倍。
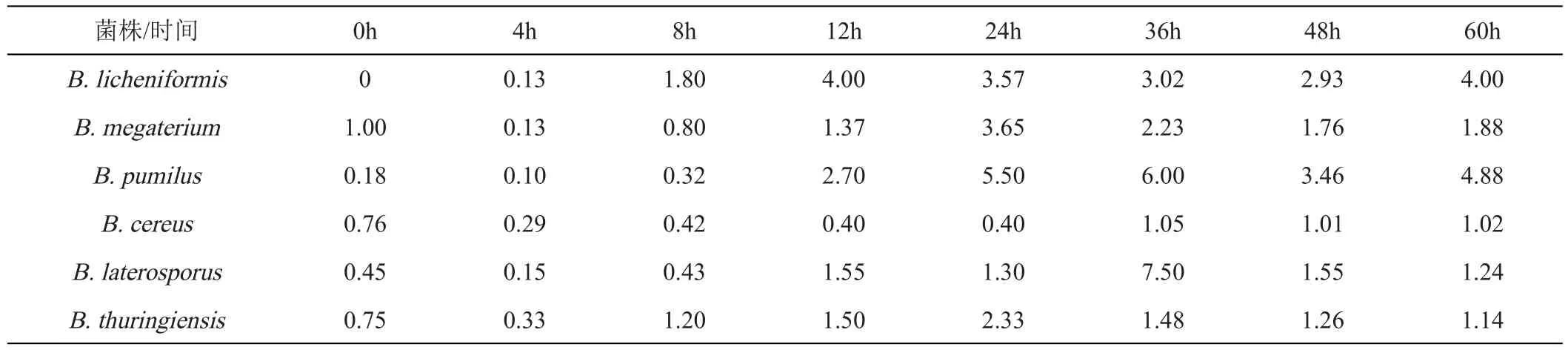
表2 芽孢桿菌屬產芽孢共培養與單培養之比
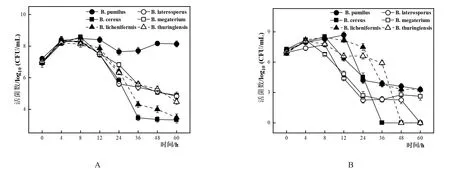
圖6 6種芽孢桿菌5%接種量單培養(A)及與L.paracasei HD1.7以5%:1%的比例共培養(B)菌體生長變化情況
當6種芽孢桿菌與L.paracaseiHD1.7以5%:1%的比例進行共培養時,與B.cereus和B.pumilus共培養的L.paracaseiHD1.7的活菌數分別上升至9.08±0.21 log10(CFU/mL)和 9.46±0.19 log10(CFU/mL)后趨于穩定 ,而 與B.megaterium、B.laterosporus、B.licheniformis和B.thuringiensis等芽孢桿菌共培養的L.paracaseiHD1.7活菌數均先上升至8~12 h后下降(圖7A)。
L.paracaseiHD1.7與6種芽孢桿菌以5%:1%共培養時,與B.pumilus共培養的L.paracaseiHD1.7所產細菌素隨時間的增加而擴大,在60 h其細菌素產量達到最大,為77.46±0.38 AU/mL是單培養的1.27倍,而與其他芽孢桿菌共培養時細菌素產量均下降(圖7B),并且與B.licheniformis和B.thuringiensis共培養時,其細菌素的產生被抑制。
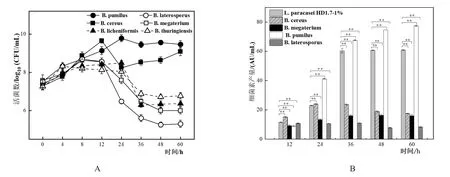
圖7 L.paracasei HD1.7與6種芽孢桿菌以5:1的比例共培養L.paracasei HD1.7菌體生長情況以及產細菌素情況
當6種芽孢桿菌屬微生物與L.paracaseiHD1.7以5%:1%的比例共培養時,B.pumilus與L.paracaseiHD1.7的共培養組中,細菌素產量提升的同時B.pumilus也形成更多的芽孢,二者之間形成的是協同合作關系。B.licheniformis和B.thuringiensis與L.paracaseiHD1.7共培養時,芽孢的產量僅略有提升,但卻完全抑制了細菌素的產生,它們形成的是對L.paracaseiHD1.7偏害的生態關系。B.cereus、B.megaterium和B.laterosporus而言,芽孢桿菌產孢量提升,細菌素的產量減少,形成的是對B.cereus、B.megaterium和B.laterosporus偏利并對L.paracaseiHD1.7偏害的生態關系。
3 討論與結論
代謝產物的合成需要產生菌達到一定的菌體密度時才能合成[25]。Mehdi等[26]將乳酸乳球菌(Lactococcus lactis)與解脂耶氏酵母(Yarrowia lipolytica)以不同接種比例共培養,接種比例為1:1的條件下,可獲得最高的乳酸鏈球菌素產量。當Y.lipolytica與L.lactis的接種比例大于1時,Y.lipolytica的生長速度和底物的利用率降低。Zhu等[27]證明共培養體系中巨大芽孢桿菌(Bacillus megaterium)孢子形成和孢子穩定性是促進普通生酮基古龍酸菌(Ketogulonigenium Vulgare)生長以及合成2-酮-L-古洛糖酸(2-KLG)的重要因素。可以見得,接種比例和產芽孢量的不同都會對共培養下的菌群結構造成影響。本實驗中調整L.paracasei HD1.7與B.subtilis共培養的比例,二者的生態關系確實隨之改變。當B.subtilis:L.paracasei HD1.7為5%:1%時,形成了協同合作的生態關系,細菌素的產生為單培養的1.21倍,芽孢的產生為單培養的5.95倍,提高了二者在種群間的競爭力,維系了產細菌素的L.paracasei HD1.7與B.subtilis間的穩定,使二者處于相互平衡的生態關系。
接種比例相同但菌種不同會產生不同的生態關系,Bertrand等[28]發現,將釀酒酵母(Saccharomyces cerevisiae)與解淀粉芽孢桿菌(Bacillus amyloliquefaciens)04BBA15共培養時出現了對S.cerevisiae偏利的共生關系以及與發酵乳桿菌(Lactobacillus fermentum)04BBA19進行共培養時,體現為互利共生關系。與同一屬中的不同種細菌進行共培養時,生態關系也不盡相同。Tremonte等[29-30]指出將清酒乳桿菌(Lactobacillus sakei)與兩種凝固酶陰性葡萄球菌:木糖葡萄球菌(Staphylococcus xylosus)和變異微球菌(Kocuria varians)進行共培養時,每二者之間均形成了協同合作的關系,且前者促進了后者的蛋白水解活性。本文研究結果說明,L.paracasei HD1.7與芽孢桿菌屬的共培養中,在同一條件下與不同種的芽孢桿菌之間形成的生態關系也是不相同的,既有與之共培養后對L.paracasei HD1.7偏利的芽孢桿菌,同樣也存在對其偏害的芽孢桿菌。

