男性生殖道感染睪丸異常改變的MR 表現及臨床意義
王毓 唐廣磊 伏文皓 劉鋒 曹明明 關鍵
生殖道感染是導致男性不育的重要原因[1,2],可導致梗阻性無精子癥(obstructive azoospermia,OA),如果影響到睪丸,進而造成生精功能受損,繼而導致非梗阻性無精子癥(nonobstructive azoospermia,NOA)。OA 被歸因于生殖道的機械性阻塞,由于精子發生完好,有相對良好的預后;而NOA 則可能需要輔助生殖技術(assisted reproductive techniques,ART)[3]。雖然繼發性NOA 可以通過早期醫療干預來預防或在疾病的早期發現并逆轉,但由于對于NOA 的認識不足,大多數患者查不到明確病因[4]。睪丸炎是導致NOA 的重要原因[5,6],也有一些相關的MR 研究報道,例如Peng等[7,8]利用磁共振功能成像檢出腮腺炎病毒性睪丸炎后遺生精功能減低的改變。筆者在臨床工作中發現男性生殖道感染患者的睪丸MR 信號異常的發生率較高,因此本研究回顧一組男性生殖道感染的病例,對其睪丸MR 影像及臨床資料進行分析,旨在探討男性生殖道感染者睪丸信號異常的臨床意義。
資料與方法
1.研究對象
回顧性分析2018 年10 月~2021 年3 月中山大學附屬第一醫院確診男性生殖道感染患者。按照以下納入標準:(1)經臨床及實驗室檢查確診為生殖道感染;(2)有完整的MR 檢查資料,包括小線圈睪丸成像資料;(3)于1 周內完成MR 檢查、常規精液檢查和精漿彈性蛋白酶檢測。共納入42例患者,年齡19~61 歲(中位年齡31 歲)。
所有患者均完成外生殖器臨床檢查,重點觸診雙側睪丸大小、形態、軟硬度,有無硬結、觸痛等。
2.磁共振檢查
全部患者按照常規盆腔MRI 檢查準備,檢查前禁欲3 d 以上。受檢者排尿后取仰臥位,毛巾卷折后墊于會陰與大腿之間,托起陰囊;陰莖上翻、陰莖背側貼近腹中線(適當固定),放置磁共振小線圈及體線圈并固定。掃描設備及主要序列:檢查采用采用3.0 T 超導MR 掃描儀(Magnetom Trio,Siemens Medical Solutions),掃描范圍自腹主動脈分叉處至陰囊下方。掃描序列包括:自旋回波序列(spin echo,SE)軸位非壓脂T1WI(TR/TE:600/13 ms);快速自旋回波序列(fast spin echo,FSE)T2WI 壓脂矢狀位、軸位、冠狀位3 個層面(TR/TE:4380~4880/73~84 ms)。增強掃描采用SE 序列T1WI 掃描,掃描方位及層厚、層間距與平掃T1WI 相對應;對比劑采用釓噴替酸葡甲胺(Gd-DTPA,用量0.1 mmol/kg),注射流率為1 ml/s,總量10~15 ml。
3.圖像分析
由兩位擅長泌尿生殖系統醫生協商后得出統一意見,觀察內容包括:睪丸的大小、形態,白膜是否增厚,病灶的形態、信號及累及范圍,是否合并輸精管道的異常改變等。統計并分析男性生殖道感染者睪丸異常改變的MRI 特點。
結果
42 例男性生殖道感染患者,精漿彈性蛋白酶均提示生殖道感染[9-12],其中隱性感染23 例(290~1000 ng/ml),顯性感染19 例(>1000 ng/ml)。體檢睪丸觸痛、隱痛10 例,睪丸硬結、結節7 例,睪丸腫大4 例。42 例中無精子癥13 例,其中隱性生殖道感染5 例,顯性感染患者8 例。
小線圈MR 發現睪丸異常改變者31 例(73.8%),其中單側10 例,雙側21 例。31 例睪丸異常者小線圈MRI 表現為雙側睪丸欠對稱,其中22 例睪丸輕度變形,表面欠光整,白膜不均勻增厚,睪丸實質信號欠均勻(圖1、2),呈按睪丸分葉分布的實質信號異常。分為三度:(1)輕度改變15 例(單側3 例,雙側12 例),病灶呈斑點狀,散在分布,按睪丸小葉分布不明顯,累及1~2 個睪丸小葉,相比睪丸實質T1WI 等或稍低信號,T2WI 稍低信號(圖3);(2)中度改變9 例(單側3 例,雙側6 例),病灶呈條片狀,按睪丸小葉分布較明顯,累及超過3 個睪丸小葉,T1WI 等或稍低信號,T2WI 稍低信號,邊界較輕度更明顯(圖4);(3)重度改變7 例(單側4例,雙側3 例),病灶呈片狀,部分呈分葉狀,填充睪丸小葉,累及超過4 個睪丸小葉,T1WI 及T2WI呈低信號,T2WI 病變信號明顯減低(圖5)。增強后病灶強化程度均較正常睪丸實質低,從輕到重逐漸明顯(表1)。

圖1 32 歲,冠狀位壓脂T2WI 示左側睪丸增大變形,包膜欠光滑,左側附睪頭囊狀高信號影(箭頭),邊界清晰;雙側睪丸中度異常信號改變(箭)圖2 33 歲,冠狀位壓脂增強示右側睪丸腫大,包膜欠光滑,雙側附睪頭腫脹(箭),強化明顯且不均勻信號不均;雙側睪丸實質間斑片狀低強化灶,累及多個小葉
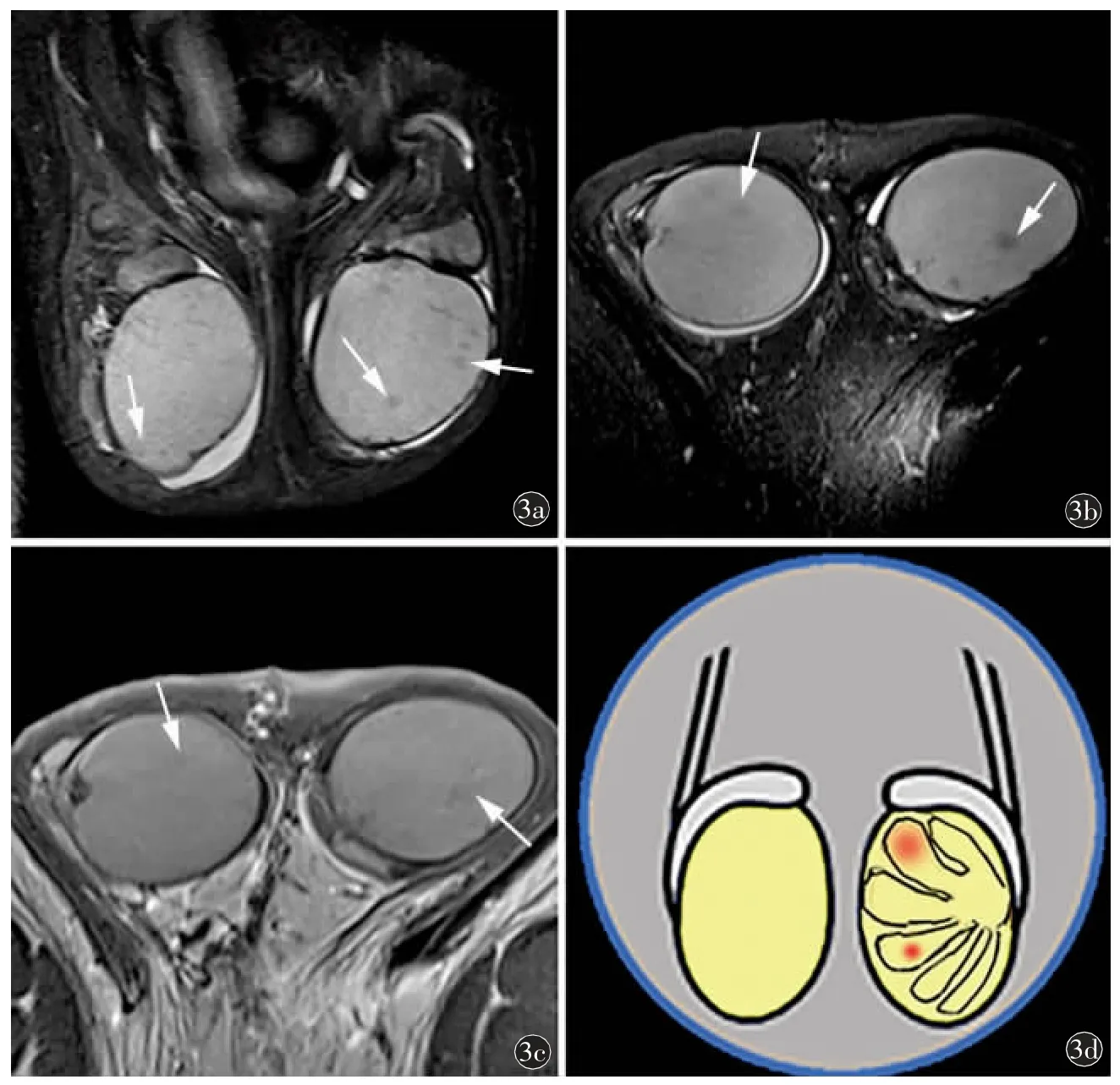
圖3 47 歲,雙側睪丸輕度異常改變,小線圈掃描。a)冠狀位壓脂T2WI 及b)軸位壓脂T2WI 示雙側睪丸形態欠規則,實質信號不均,可見散在小斑片狀低信號影(箭);雙側附睪頭輕度腫脹;c)增強掃描雙側睪丸強化欠均勻,可見小斑片狀弱強化影(箭);d)輕度睪丸異常信號改變模式圖
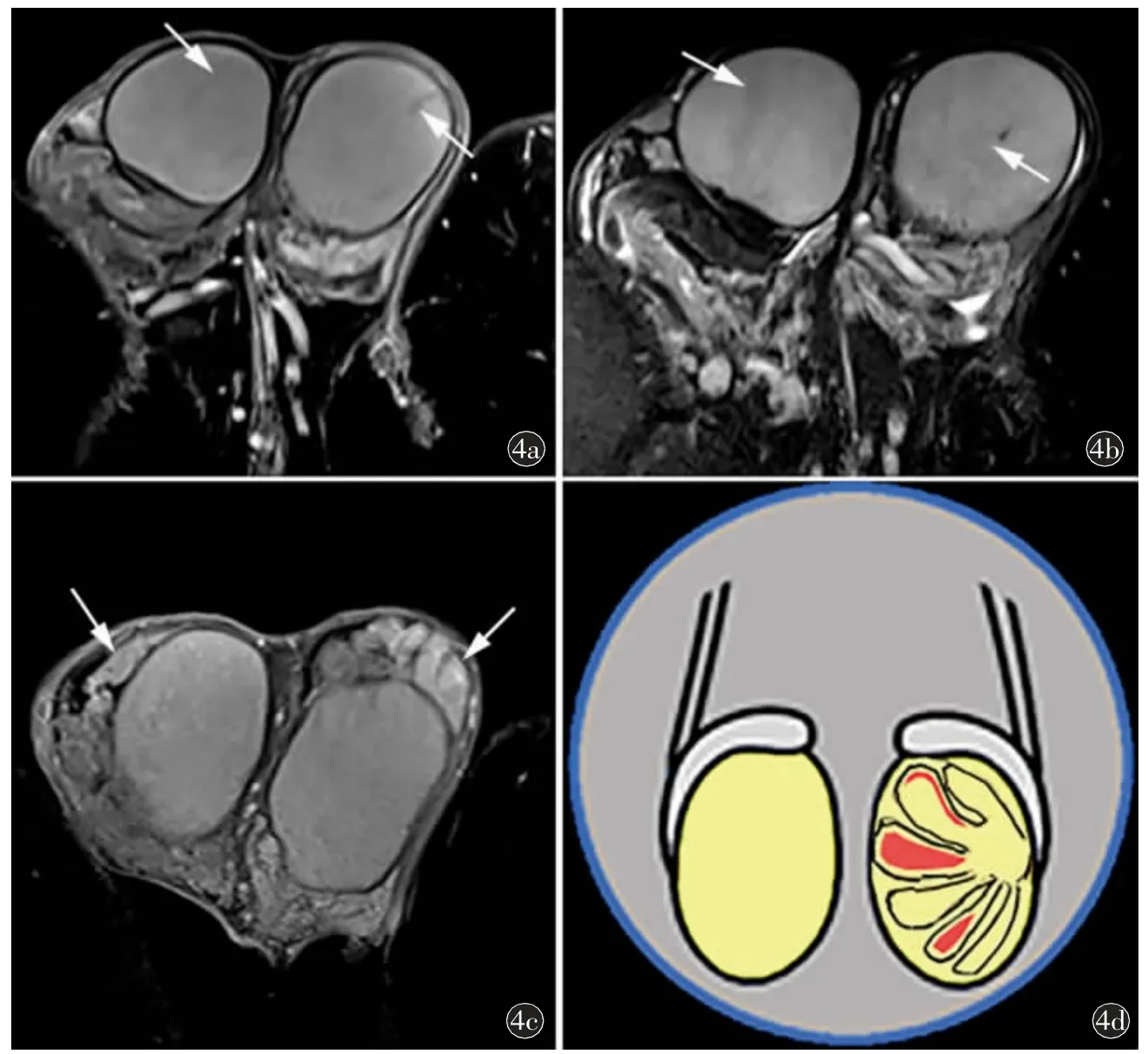
圖4 30 歲,雙側睪丸中度異常改變,小線圈掃描。a)和b)軸位壓脂T2WI 不同層面示雙側睪丸實質信號不均勻,可見多發按小葉分布的條片狀低信號影(箭);c)軸位增強示雙側睪丸實質強化欠均勻,可見多發條片狀按小葉分布呈低強化影,雙側附睪強化欠均勻(箭);d)中度睪丸異常信號改變模式圖
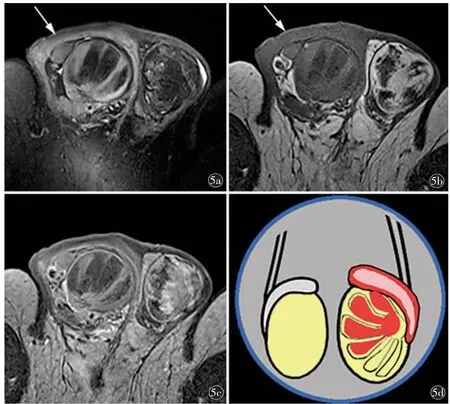
圖5 61 歲。a)軸位壓脂T2WI 示右側睪丸鄰近陰囊壁水腫為彌漫性較高信號(箭),右側睪丸包膜增厚,右側睪丸多發片狀明顯低信號影,病灶呈分葉狀,累及多個睪丸小葉;b)軸位T1WI 示右側睪丸鄰近陰囊壁水腫為彌漫性較低信號(箭),右側睪丸內多發明顯低信號與T2WI 對應;c)增強掃描示平掃異常信號強化程度明顯減低,陰囊水腫區無明顯強化;d)重度睪丸異常信號改變模式圖

表1 不同分度睪丸異常改變小線圈MRI 表現
13 例無精子癥中7 例雙側睪丸重度異常,1 例合并精索靜脈曲張;6 例為雙側睪丸輕、中度異常,均合并精索靜脈曲張,其中1 例可見陰囊膿腫。
輸精管道異常:25 例附睪病變MRI 表現為附睪(頭、體、尾單一或任意組合)腫脹,信號不均,7例合并附睪囊腫(表現為附睪內類圓形水樣信號影,邊界清晰)、2 例精液淤積(表現為附睪部輸精管結腸樣擴張),增強掃描附睪不均勻強化(圖1、2);3 例輸精管異常,MRI表現為陰囊段、盆腔段輸精管走行迂曲,管壁毛糙,管徑擴張,壓脂序列可見高信號的精液淤積;10 例精囊異常,MRI 表現為單側或雙側精囊擴張、形態大小不一,擴張的精囊囊壁增厚、毛糙,增強掃描囊壁強化,囊內容物不強 化;1例射精管異常,MRI 表現為單側或雙側射精管擴張,管壁毛糙增厚。
討 論
1.小線圈MR 在男性生殖系統檢查的優勢
NOA 可繼發于男性生殖道感染[1,5,6,13],從而導致男性不育。NOA 是指睪丸缺乏產生活精子能力的病理狀態,約占男性不育的10%~15%[14,15],大多數NOA的患者查不到明確病因[2],所以尋找病因是治療不育的重點。近年來,磁共振成像因為其高空間及軟組織分辨力的標準化及綜合的圖像,越來越多的應用于男性生殖系統的檢查[16,17]。Peng等[7]、Parker 等[18]利用磁共振小線圈成像,發現能幫助確定陰莖、陰囊或睪丸炎癥或創傷損傷的程度。本研究對男性生殖道感染的小線圈MRI 資料回顧性分析時,發現除了輸精管道的異常改變之外,這些患者常合并睪丸的信號異常。
本組患者MR 檢查均采用體線圈加小線圈掃描,得益于小線圈的高分辨力對微細結構顯示的優勢,睪丸異常的發現率超過70%。利用小線圈MRI 還能對睪丸的信號異常進行分度。因此對于臨床診斷生殖道感染的患者,行小線圈MR 檢查是有必要的。
2.睪丸異常小線圈MRI 表現分析
本組所有睪丸異常改變均表現為按睪丸小葉分布的異常信號改變;均有不同程度的睪丸白膜增厚,其中22 例睪丸變形。這些改變歸因于睪丸的解剖特點,睪丸的表面有三層膜,由表及里依次為鞘膜、白膜和血管膜,在影像上無法區分。白膜為一層厚而堅韌的纖維膜,厚約0.5 mm,在睪丸后緣處增厚且伸入睪丸實質內形成楔狀的睪丸縱隔,從睪丸縱隔發出許多睪丸間隔呈扇形伸入睪丸實質,末端連于睪丸白膜,將睪丸實質分為多個大小不等扇形或錐形的睪丸小葉。睪丸白膜及小葉間隔作為一層堅硬的纖維膜,在MRI 表現為線狀低信號[7],由于小葉間隔的屏障作用,導致病變按睪丸小葉分布。輕度改變病灶較小且散在,累及較少睪丸小葉,故按照睪丸小葉分布的特征不明顯,中、重度改變病灶較大,累及部分或整個睪丸小葉,在小葉間隔的襯托下,按小葉間隔分布的特征明顯。生精小管間充填有疏松結締組織(即睪丸間質),感染累及睪丸時會導致水腫或充血,以及血管周圍和間質中淋巴細胞的浸潤[19,20],白膜內面的血管膜被覆于睪丸縱隔及睪丸小隔內表面,并直接與睪丸間質連續,受影響的血管膜可以發生不規則增厚,小線圈MRI 則表現為不同程度的睪丸白膜增厚,當發生纖維化時,甚至引發睪丸萎縮或變形[21]。
3.生殖道感染睪丸異常與無精子癥的關系
本組13 例無精子癥患者中7 例睪丸重度異常改變者,均為雙側發病,且均出現了無精子癥;因此筆者推測雙側睪丸重度異常信號改變也許是睪丸實質破壞的直接表現,反映了生精上皮大量破壞,繼而導致NOA 的發生。另6 例則為輕中度睪丸異常信號改變,同時合并了雙側精索靜脈曲張,鑒于精索靜脈曲張也可導致男性不育[22],因此這6 例的無精子癥的原因可能是多重因素共同作用所致。
本組病例除睪丸的異常改變,常合并輸精管道其他器官的異常,包括附睪、輸精管、精囊腺、射精管及前列腺。輸精管道的病原體逆行上升是睪丸感染最常見的途徑[12,23],生殖道感染者的睪丸異常改變由精道的逆行感染所致可能性大,所以影像檢查要重視睪丸的信號改變。流行性病學研究表明[24],越來越多不育男性罹患急慢性的泌尿生殖道炎癥,且通常發生在無任何癥狀的情況下。然而,恰恰是無癥狀的病程和非特異性的臨床體征,阻礙了大多數患者的診斷[25]。
精漿彈性蛋白酶是判斷男性生殖道感染以及嚴重程度的重要指標之一[8]。本研究發現顯性感染患者出現無精子癥的幾率要高于隱性感染患者(61.5%,8/13 比37.9%,11/29)。而睪丸信號異常的程度與精漿彈性蛋白酶的升高具有一致性,間接說明睪丸異常信號與生殖道炎癥是存在關聯的。
4.研究的局限性
本研究缺乏病理證實,原因在于睪丸活檢并無必要,也難以接受。因此睪丸異常信號的本質沒有得到確認,只能間接認為與精道感染相關。其次,本研究中大部分患者沒有睪丸MR 復查資料,缺乏睪丸異常信號的對比。
綜上,在成年男性生殖道感染者中,MR 除了可顯示輸精管道異常改變之外,還可以檢出睪丸的異常信號并進行程度區分。值得注意的是雙側睪丸重度信號異常改變者,其無精子癥發生率較高。