基于超聲聯合血清學指標的列線圖模型早期預測乳腺癌術后化療患者心臟毒性風險
李英華 郭 強 蔣金全 曾 軍 崔文婷 劉 怡 笪應芬
蒽環類化療藥物在發揮高效抗腫瘤作用的同時也帶來了較嚴重的心臟毒性。化療藥物引起的心臟毒性具有進展性和不可逆性,因此早期監測和調整化療方案能夠減少心臟毒性事件發生[1]。已有指南[2]將左室射血分數(LVEF)減少超過10%作為診斷化療相關心臟毒性的截斷值。但實際上LVEF用于早期診斷心臟毒性常不敏感,化療藥物導致的左室舒張功能受損、左室順應性減低及僵硬度增加往往早于LVEF變化[3-4]。目前有研究[5-7]基于組織多普勒、心肌MRI、三維超聲心動圖、血清學指標檢測等檢查手段提出了多項用于監測心臟毒性的指標,如心肌做功指數、心肌細胞外容積、左房容積、N末端B型利鈉肽前體(NT-proBNP)等。然而這些檢測方法由于準確性有限或難以大范圍普及等原因均存在一定的局限性。為探索一種能夠及早發現心臟毒性發生的方法,本研究擬基于常規超聲心動圖及血清學檢測指標建立列線圖預測模型,旨在早期預測乳腺癌患者化療期間出現心臟毒性的風險。
資料與方法
一、研究對象
選取2017年8月至2019年8月在我院乳腺外科經術后病理確診為乳腺癌,且在我院接受蒽環類藥物化療的女性患者148例,年齡25~65歲,平均(47.83±7.29)歲;病理類型均為浸潤性導管癌。納入標準:①25歲以上女性乳腺癌患者;②同期未接受放射治療;③患者化療前常規心臟超聲及心功能評價未見異常,且預計其生存期>24個月;④東部腫瘤協作組(ECOG)評分≤2分;⑤臨床資料完整。排除標準:①既往有其他腫瘤病史或接受過其他抗腫瘤治療;②既往有高血壓病及糖尿病等病史;③患有胸廓及脊柱畸形、呼吸系統疾病等影響超聲圖像質量者。本研究經我院醫學倫理委員會批準,所有患者均簽署知情同意書。
二、儀器與方法
1.超聲心動圖檢查:使用GE Vivid E 95、E 9彩色多普勒超聲診斷儀,M5SC相控陣探頭,頻率1.4~4.6 MHz。患者取左側臥位,平靜呼吸。獲取胸骨旁左室長軸標準切面M型超聲心動圖像,測量左室舒張期內徑(LVDd)、左室收縮期內徑(LVDs)、左房內徑(LAd)。調整探頭,獲取標準心尖四腔心切面和兩腔心切面,記錄二尖瓣舒張早晚期峰值流速比值(E/A)、雙平面Simpson法記錄LVEF、E與二尖瓣環側壁組織運動速度(e’)比值、左室短軸縮短率(LVFS)。在常規超聲心動圖的基礎上連接心電圖,連續采集左室心尖四腔心、兩腔心和三腔心切面至少3個心動周期的動態圖像,通過二維斑點追蹤(2D-STI)及EchoPAC工作站對患者心內膜進行描記,獲得左室收縮期整體縱向峰值應變(GLS)及應變率(GLSR)。以上操作均由兩名具有10年以上工作經驗的超聲醫師共同協商完成。
2.血清學指標測定:患者抽取空腹肘靜脈血于4℃下按10 000 r/min離心5 min,取上清液用于檢測。采用西門子ADVIA Centaur CP全自動化學發光免疫分析儀及配套試劑檢測肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、B型利鈉肽(BNP)、高敏感性心肌肌鈣蛋白I(hs-cTnI)、NT-proBNP水平。檢測流程嚴格按照儀器及試劑盒說明書。
3.治療方案:所有患者在我院行乳腺癌根治術,術后2周開始接受以蒽環類藥物為主的聯合化療方案。其中蒽環類藥物(鹽酸多柔比星,輝瑞制藥有限公司,國藥準字:H20000496)用藥劑量為50 mg/m2,每次化療間隔21 d,均完成4個化療周期。根據以往文獻[7-8]報道,接受化療的患者血清學指標及影像學指標多于化療第3周期開始出現有統計學意義的差異。因此本研究記錄化療前及化療第3周期后的血清學及超聲心動圖指標,計算化療前后的差值(ΔCK、ΔCK-MB、ΔBNP、Δhs-cTnI、ΔNT-proBNP、ΔLVEF、ΔLAd、ΔLVDd、ΔLVDs、ΔLVFS、ΔE/e’、ΔE/A、ΔGLS、ΔGLSR),并進行分析,以預測潛在的心臟毒性。
4.隨訪:在4個周期化療全部結束后,所有患者每隔3個月進行一次門診隨訪,共隨訪1年。隨訪時,使用超聲心動圖檢測患者LVEF,終點事件定義為隨訪期間發現ΔLVEF>10%(ΔLVEF=化療前LVEF-化療后LVEF),則納入毒性組,若患者隨訪結束時仍然ΔLVEF≤10%則納入無毒性組。分析兩組的基線資料、血清學指標、常規超聲心動圖及2D-STI指標的差異。
三、統計學處理
結 果
直至隨訪結束,148例患者中共失訪2例,其中128例至隨訪結束仍然未發生終點事件,平均LVEF為(62.72±4.29)%,納入無毒性組;18例出現終點事件,平均LVEF為(55.25±5.83)%,納入毒性組。Kaplan-Meier生存曲線顯示,隨著時間延長,全體患者中ΔLVEF>10%的出現例數增多,在隨訪的第6個月和9個月發生心臟毒性的例數增長較為明顯,其總體出現心臟毒性的概率為12.3%。見圖1。
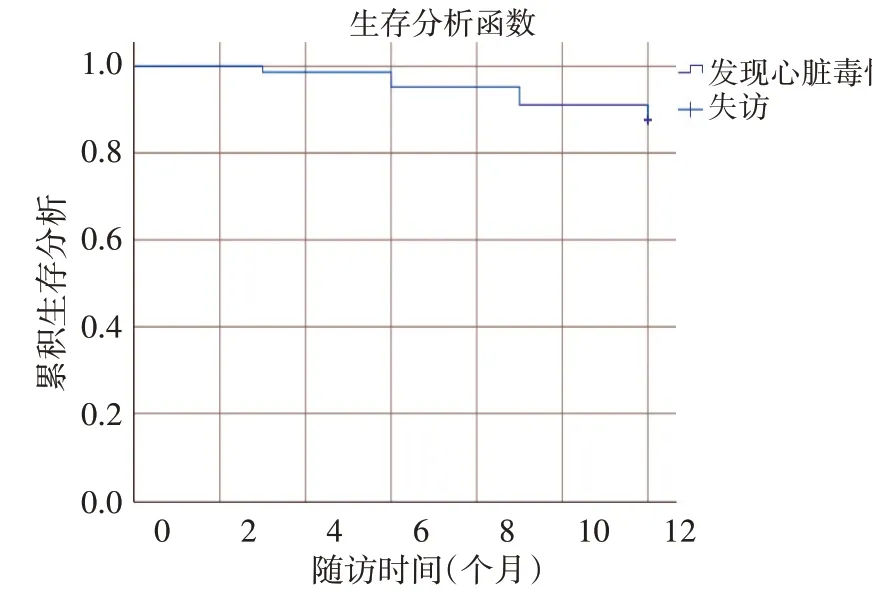
圖1 患者心臟毒性發生情況(Kaplan-Meier法)
一、兩組患者基線資料、血清學指標、超聲心動圖指標比較
毒性組患者除年齡水平明顯高于非毒性組,差異有統計學意義(P=0.048)外,其余資料比較差異均無統計學意義。化療前兩組患者血清學及超聲心動圖指標比較差異均無統計學意義。化療第3周期后,兩組ΔNT-proBNP、Δhs-cTnI、ΔGLS比較差異均有統計學意義(均P<0.05)。見表1~3和圖2。
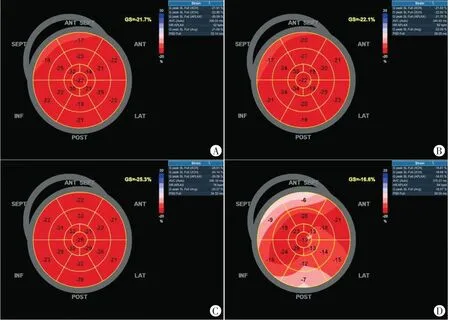
圖2 無毒性組和毒性組患者2D-STI圖像
表1 無毒性組與毒性組患者基線資料比較(±s)
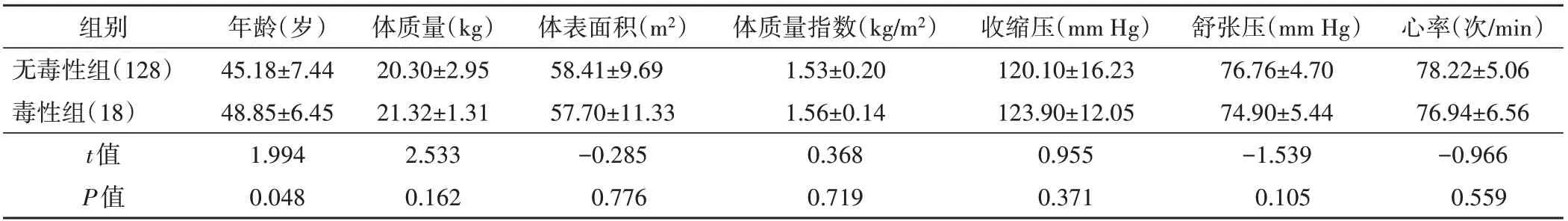
表1 無毒性組與毒性組患者基線資料比較(±s)
1 mm Hg=0.133 kPa
組別無毒性組(128)毒性組(18)t值P值體質量指數(kg/m2)1.53±0.20 1.56±0.14 0.368 0.719體表面積(m2)58.41±9.69 57.70±11.33-0.285 0.776心率(次/min)78.22±5.06 76.94±6.56-0.966 0.559年齡(歲)45.18±7.44 48.85±6.45 1.994 0.048體質量(kg)20.30±2.95 21.32±1.31 2.533 0.162收縮壓(mm Hg)120.10±16.23 123.90±12.05 0.955 0.371舒張壓(mm Hg)76.76±4.70 74.90±5.44-1.539 0.105
二、提示早期心臟毒性的潛在指標分析
表2 無毒性組與毒性組患者化療前血清學及超聲心動圖指標比較(±s)

表2 無毒性組與毒性組患者化療前血清學及超聲心動圖指標比較(±s)
CK:肌酸激酶;CK-MB:肌酸激酶同工酶;BNP:B型利鈉肽;hs-cTnI:高敏感性心肌肌鈣蛋白I;NT-proBNP:N末端B型利鈉肽前體;LVEF:左室射血分數;LAd:左房內徑;LVDd:左室舒張期內徑;LVFS:左室短軸縮短率;E/e’:二尖瓣舒張早期峰值流速與二尖瓣環側壁組織運動速度比值;E/A:二尖瓣舒張早、晚期峰值流速比值;GLS:整體縱向峰值應變;GLSR:整體縱向峰值應變率
血清學指標超聲心動圖指標組別E/e’6.56±0.84 6.60±0.77 E/A 1.51±0.57 1.45±0.32 CK-MB(U/L)11.95±2.09 12.26±1.90 GLS(%)-21.52±1.45-21.18±1.49 GLSR(s-1)-1.39±0.21-1.38±0.20 BNP(ρg/ml)49.58±29.89 53.68±29.37 CK(U/L)38.95±4.56 40.48±4.35 hs-c TnI(ρg/ml)11.22±2.32 10.97±3.13 NT-proBNP(ng/ml)25.85±2.12 24.54±3.15 LVEF(%)66.15±6.21 64.37±4.94 LAd(mm)3.33±0.61 3.24±0.43 LVDd(mm)4.86±0.71 4.59±0.85 LVDs(mm)25.34±5.48 25.34±5.99 LVFS(%)33.71±3.68 36.39±3.86無毒性組毒性組
表3 無毒性組與毒性組患者化療前與化療3周期血清學及超聲心動圖指標差值比較(±s)
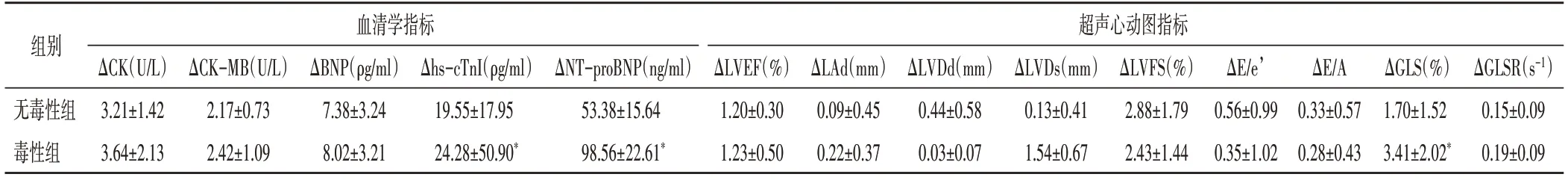
表3 無毒性組與毒性組患者化療前與化療3周期血清學及超聲心動圖指標差值比較(±s)
與無毒性組比較,*P<0.05。ΔCK:肌酸激酶差值;ΔCK-MB:肌酸激酶同工酶差值;ΔBNP:B型利鈉肽差值;Δhs-cTnI:高敏感性心肌肌鈣蛋白I差值;ΔNT-proBNP:N末端B型利鈉肽前體差值;ΔLVEF:左室射血分數差值;ΔLAd:左房內徑差值;ΔLVDd:左室舒張期內徑差值;ΔLVFS:左室短軸縮短率差值;ΔE/e’:二尖瓣舒張早期峰值流速與二尖瓣環側壁組織運動速度比值差值;ΔE/A:二尖瓣舒張早、晚期峰值流速比值差值;ΔGLS:整體縱向峰值應變差值;ΔGLSR:整體縱向峰值應變率差值
血清學指標超聲心動圖指標組別ΔCK-MB(U/L)2.17±0.73 2.42±1.09 ΔE/e’0.56±0.99 0.35±1.02 ΔE/A 0.33±0.57 0.28±0.43 ΔGLS(%)1.70±1.52 3.41±2.02*ΔBNP(ρg/ml)7.38±3.24 8.02±3.21 Δhs-c TnI(ρg/ml)19.55±17.95 24.28±50.90*ΔNT-proBNP(ng/ml)53.38±15.64 98.56±22.61*ΔLVEF(%)1.20±0.30 1.23±0.50 ΔLAd(mm)0.09±0.45 0.22±0.37 ΔLVDd(mm)0.44±0.58 0.03±0.07 ΔLVDs(mm)0.13±0.41 1.54±0.67 ΔLVFS(%)2.88±1.79 2.43±1.44 ΔGLSR(s-1)0.15±0.09 0.19±0.09無毒性組毒性組ΔCK(U/L)3.21±1.42 3.64±2.13
通過單因素COX回歸分析發現,年齡、ΔNT-proBNP、Δhs-cTnI、ΔGLR 4項指標是篩選早期心臟毒性的潛在指標(P<0.1)。對以上潛在指標進行進一步的多因素COX回歸分析發現,Δhs-cTnI、ΔNTproBNP和ΔGLS可獨立提示接受化療的乳腺癌患者出現心臟毒性的風險。見表4。

表4 提示患者發生心臟毒性風險的潛在指標
三、列線圖預測模型的建立與評價
基于多因素分析結果建立用于預測心臟毒性風險的列線圖,見圖3。將各指標在圖中對應的軸上找到對應的點,然后通過該點做垂直于橫軸的直線,該直線在評分標尺上的交點讀數即為該指標的分數。將各指標的分數相加即為總分,按照同樣的方法,總分在風險值上的交點讀數即為該患者發 生心臟毒性的概率。列線圖的C-index為0.904,顯示出良好的辨別力(>0.75),且校準測試表明無明顯的偏離(χ2=8.170,P=0.417,Hosmer-Lemeshow檢驗)。
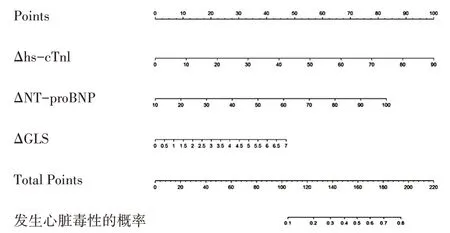
圖3 提示患者發生心臟毒性風險的列線圖
四、ROC曲線分析
ROC曲線分析顯示,列線圖預測心臟毒性的曲線下面積(0.904)顯著高于ΔGLS、ΔNT-proBNP及ΔhscTnI單獨診斷的曲線下面積(0.864、0.709、0.704),差異均有統計學意義(均P<0.05)。見圖4。
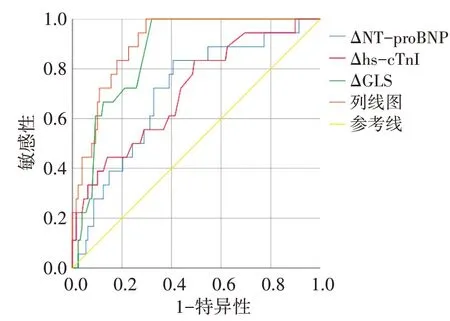
圖4 ΔGLS、Δhs-cTnI、ΔNT-proBNP及列線圖預測早期心臟毒性風險的ROC曲線圖
討 論
化療藥物導致的心臟毒性嚴重影響乳腺癌患者的預后。早期的心臟毒性往往是可逆的,及早對心臟毒性進行準確預測,采取干預措施對于減輕心臟損傷有重要意義。心內膜活檢是目前評估化療藥物所致心臟毒性敏感性和特異性最高的方法,但由于其為有創檢查,臨床應用率低[9]。血清心肌標志物雖敏感性較高,但特異性不高,診斷價值有限。組織多普勒雖然較常規超聲心動圖更敏感,但其存在角度依賴性,重復性欠佳,能否進一步應用于臨床診斷心臟毒性仍需進一步探究。三維超聲心動圖、三維斑點追蹤技術等盡管能克服以上缺點,但其在各級醫院普及程度不高,臨床推廣價值有限。2D-STI是一項能夠量化心肌功能的技術,無角度依賴性、可重復性好被廣泛應用于心臟功能的評估。本研究采用ΔGLS評估早期心臟功能改變,并聯合Δhs-cTnI、ΔNT-proBNP的列線圖預測接受化療的乳腺癌患者發生心臟毒性風險,以期及早發現并干預化療藥物導致的心臟損傷。
早期化療藥物導致的心肌損傷輕微,由于心臟強大的代償機制,往往難以檢測出心臟受損后產生的細微差異。為了能夠及時發現這些變化,早期預測化療藥物導致的心臟毒性,根據患者發生心臟毒性的概率及時調整化療方案,本研究通過多因素COX回歸分析結果顯示ΔNT-proBNP、Δhs-cTnI及ΔGLS是提示患者早期出現心臟毒性的獨立風險指標。而臨床其他常用的評估心臟功能指標均非獨立風險指標,難以用于早期心臟毒性的診斷,這亦反映出目前臨床早期評估心臟毒性具有困難性。
多因素分析結果提示化療第3個周期后ΔNTproBNP、Δhs-cTnI水平升高可以作為預測心臟毒性的有效指標。與BNP相比,NT-proBNP半衰期更長,穩定性更好,敏感性更高,更適合于臨床應用[10]。Kara等[11]研究表明,NT-proBNP在發現無癥狀性左室功能異常,以及診斷輕微的收縮或舒張期心力衰竭方面,較常規超聲學指標更有優勢。hs-cTnI在預測接受蒽環類藥物化療的乳腺癌患者心臟毒性中也具有較高價值[12-13]。Cardinale等[14]以80 ng/L作為hs-cTnI檢測閾值,經過為期3年的隨訪發現,接受化療期間hs-cTnI升高的患者中心力衰竭等心臟毒性癥狀發生率為44%,而hs-cTnI未明顯升高的患者中,發生率僅為0.1%。這也提醒臨床醫師在化療期間需密切關注患者血清NT-proBNP、hs-cTnI,對于保護患者的心臟功能,以及提高患者預后有的重要指導意義。
本研究使用2D-STI技術對左室心肌進行定量分析,發現化療第3周期毒性組患者ΔGLS值較無毒性組顯著下降(P<0.05)。歐洲心臟病學會在2016版指南中推薦,將ΔGLS>15%作為提示化療所致心臟毒性的指標[15]。目前多推薦將GLS≥-19%作為正常的截斷值[16]。本研究認為,患者本身可能存在基礎的心血管系統疾病,對GLS會造成一定影響。若僅依靠GLS≥-19%作為正常的截斷值來預測患者是否會發生心臟毒性并不準確。通過對比化療前后GLS下降幅度,以患者自身為參照不受基礎疾病的影響,預測蒽環類藥物所致心臟毒性更準確,更適合于臨床應用。
本研究基于統計分析所得獨立風險指標,首次構建預測化療藥物所致心臟毒性風險的列線圖,其預測早期心臟毒性風險的準確性出色(C-index=0.904),且與實際發生情況一致性較好。Chang等[17]和Florescu等[18]使用分層斑點追蹤技術發現患者最早于化療的第3周期發現心內膜縱向應變發生明顯改變,敏感性和特異性均較高,可以作為預測早期心臟毒性的指標。同樣是在化療的第3周期,Fatima等[19]通過99mTC多門控掃描測量發現,ΔLVEF為5%即可提示患者發生心臟毒性。盡管以上方法均可在化療早期發現心臟毒性,但是由于技術要求高,在基層醫院無法開展,且對于患者而言重復檢查價格昂貴,以上方法均未作為首選或常規檢查方案。Dranitsaris等[20]根據患者累積化療周期數、患者年齡和體質量等資料建立了評估發生心臟毒性風險的預測模型,ROC的曲線下面積為0.84。相較傳統預測模型,列線圖可以聯合多個臨床上常用且易于開展的常規檢查指標,量化為心臟毒性發生率,為臨床醫師提供簡易且較準確的診斷工具。如當患者Δhs-cTnI為50ρg/ml、ΔNT-proBNP為70 ng/ml、ΔGLS為6%時,列線圖的總分約為150分,提示該患者發生心臟毒性的概率約40%。臨床醫師可以據此選擇適當的治療方式,有助于臨床及早干預、及時調整治療方案,避免或降低不可逆性心臟損傷的可能性。
綜上所述,ΔGLS聯合ΔNT-proBNP及Δhs-cTnI繪制的列線圖有助于早期評估使用化療藥物患者發生心臟毒性的風險,有望幫助臨床及時準確診斷及干預化療藥物所致的可逆性心臟損傷。后期尚需前瞻性、大樣本、多中心研究對列線圖的準確性和可靠性進一步驗證。

