焦磷酸鈉與谷氨酰胺轉氨酶對氧化損傷肌原纖維蛋白凝膠性能的協同改善效應
李保玲,李穎,范鑫,馬文慧,曹云剛
焦磷酸鈉與谷氨酰胺轉氨酶對氧化損傷肌原纖維蛋白凝膠性能的協同改善效應
李保玲,李穎,范鑫,馬文慧,曹云剛
陜西科技大學食品與生物工程學院,西安 710021
【】探究焦磷酸鈉(sodium pyrophosphate,PP)、谷氨酰胺轉氨酶(transglutaminase,TG)及其組合(PP+TG)對氧化損傷豬肉肌原纖維蛋白(myofibrillar protein,MP)凝膠性能的影響,為改善氧化損傷蛋白的功能特性提供理論依據。從豬背最長肌中提取MP,采用亞油酸-脂肪氧合酶氧化體系誘導MP發生氧化,然后分別添加PP(1 mmol?L-1)、TG(E﹕S=1﹕500)及其組合(PP+TG)。采用圓二色譜探究不同添加處理對氧化損傷MP溶液二級結構的影響;通過內源性色氨酸熒光測定探究MP三級結構的變化;通過粒度、溶解度及SDS-PAGE探究不同處理對MP交聯聚集情況的影響;借助物性測試儀探究MP凝膠強度的變化;采用離心法測定凝膠持水性的變化;通過分光測色計測定其白度變化;借助掃描電鏡觀察MP凝膠的微觀結構。PP處理明顯改變了氧化損傷MP的構象,使氧化MP的平均粒徑明顯減小、溶解度顯著增強,在增強凝膠強度的同時顯著提高了其持水性能(<0.05),凝膠的微觀結構也明顯比氧化損傷MP凝膠更規則、均勻、細膩和致密。TG處理顯著改善了MP凝膠強度,但對其持水性能并無積極影響;凝膠的微觀結構孔徑變小、結構致密的同時,仍存在形狀不規則、表面粗糙等問題。綜合來看,PP+TG協同使用效果最好,氧化損傷MP的凝膠強度及持水性顯著增強,且明顯好于未氧化MP的凝膠性能。焦磷酸鈉與谷氨酰胺轉氨酶的協同使用可以有效改善氧化損傷MP的凝膠性能。
肌原纖維蛋白;焦磷酸鈉;谷氨酰胺轉氨酶;氧化;凝膠性能
0 引言
【研究意義】原料肉富含脂肪和蛋白質,在長期儲藏及加工過程中,氧化是不可避免的自然現象。蛋白氧化通常會導致肉蛋白溶解度下降,進而引起加工性能(乳化性和凝膠性等)劣變,最終導致產品得率降低、品質下降[1-3]。因此,有效防控蛋白氧化或改善氧化損傷肉蛋白的功能特性具有重要的商業意義。【前人研究進展】現有研究聚焦于采用不同包裝技術、添加抗氧化劑等手段降低儲藏過程中原料肉的氧化損傷。真空包裝能夠降低脂肪和蛋白氧化速率,延長肉品貨架期,但其對肉品的色澤及外觀等影響較大[4-5]。Zhang等[6]研究發現魚糜加工水解物可有效延緩魚糜的氧化,顯著提高其初始凝膠性能,降低凍藏造成的膠凝性能損失。Xu等[7]研究發現在飼糧中添加番茄紅素可以有效地抑制蛋白和脂質氧化,提高羊肉的貯藏品質。JONGBERG等[8]研究發現在70% N2/30% CO2以及100% N2條件下白葡萄提取物(WGE)可有效阻止肉餅中的脂質氧化,且對蛋白氧化有一定的抑制作用,但在高氧包裝(70% O2/30% CO2)條件下卻會促進蛋白氧化。李艷青[9]研究發現在魚糜漂洗時添加沒食子酸丙酯可以抑制蛋白羰基的生成,但添加抗壞血酸鈉反而促進了蛋白氧化的發生。CAO等[10]研究發現適量綠原酸的添加能有效抑制蛋白羰基含量的上升,且有利于肌原纖維蛋白凝膠網絡的形成,但高濃度綠原酸具有負面影響。這些策略在控制脂肪氧化方面非常有效,但是在控制蛋白氧化方面卻存在一定局限性。肌原纖維蛋白是肉蛋白的主要成分,約占整個肌肉蛋白含量的55%—60%,對肉制品的凝膠性能及感官品質起決定性作用[11]。原料肉中富含脂肪,脂肪氧化產物是誘導蛋白發生氧化的重要因素。大量研究表明,焦磷酸鈉能有效改變肌原纖維蛋白的結構、解離肌動球蛋白、有效提高其溶解度并改善其凝膠性能和持水性[12-13];谷氨酰胺轉氨酶能高效催化蛋白共價交聯提高蛋白凝膠性能[14]。TG催化蛋白交聯的效果取決于可利用反應底物谷氨酰胺和賴氨酸殘基的含量,而蛋白質構象的變化通常導致可利用反應底物含量的改變。因此,推測焦磷酸鈉結合谷氨酰胺轉氨酶能協同改善氧化損傷肉蛋白的凝膠性能。【本研究切入點】雖然焦磷酸鈉及谷氨酰胺轉氨酶添加對MP凝膠性能的影響已有一些研究,但二者復配對氧化損傷MP凝膠性能的協同改善研究尚未見報道。【擬解決的關鍵問題】本研究使用脂肪氧化體系制造氧化損傷的肌原纖維蛋白,探究焦磷酸鈉結合谷氨酰胺轉氨酶改善氧化損傷肌原纖維蛋白凝膠性能的協同作用,并探討其內在機制,為改善損傷蛋白的功能特性提供理論依據。
1 材料與方法
試驗于2019年12月至2020年8月在陜西科技大學食品與生物工程學院實驗樓進行。
1.1 主要材料與試劑
豬外脊肉()分3個批次購于西安市未央區潤家超市(n=3),置于冰盒中運至實驗室,每批次分別剔除肉眼可見的脂肪和結締組織,逆肌纖維走向切成約100 g肉片,真空包裝后置于-20℃冰箱備用。
脂肪氧合酶(soybean lipoxidase)、水溶性維生素E(Trolox)購于Sigma公司,亞油酸(>95%)購于上海阿拉丁試劑有限公司,谷氨酰胺轉氨酶(TG,1 000 U?g-1)購于北京索萊寶科技有限公司,焦磷酸鈉(PP)購于上海源葉生物科技有限公司。其他化學試劑均為國產分析純。
1.2 主要儀器與設備
HR/T20MM立式高速冷凍離心機,湖南赫西儀器裝備有限公司;UV2900紫外可見分光光度計,上海舜宇恒平科學儀器有限公司;TA.Plus物性測試儀,英國Stable Micro System公司;Fluoro Max-4熒光分光光度計,日本Horiba公司;CM-5分光測色計,柯尼卡美能達(中國)投資有限公司;Mastersizer 2000激光粒度分析儀,英國Malvern Instruments有限公司;FEI Q45+EDAX Octane Prime環境掃描電子顯微鏡,美國FEI公司;圓二色光譜儀,英國Applied Photophysics公司。
1.3 試驗方法
1.3.1 MP的提取 將冷凍樣品在4℃解凍,切成長條后參照PARK等[15]的方法進行MP的提取,提取過程溫度保持在0—4℃,將提取的MP置于碎冰中并在48 h內用完。
1.3.2 MP的氧化以及PP和TG處理 使用25 mmol?L-1磷酸鹽緩沖液(含0.4 mol?L-1NaCl,pH 6.2)將MP膏稀釋并添加脂肪氧化體系(LOS:3 750 U?mL-1的脂肪氧合酶,10 mmol?L-1亞油酸)于4℃氧化12 h。氧化反應通過添加Trolox(1 mmol?L-1)終止,隨后將PP(1 mmol?L-1)、TG(E﹕S=1﹕500)以及PP+TG添加到氧化后的MP(30 mg?mL-1)分散液中并在4℃反應2 h待用,所提及濃度均為最終濃度。未氧化以及氧化后未經PP和TG處理的MP分散液分別作為空白對照(NonOx)和氧化對照(Ox)。
1.3.3 圓二色譜測定 不同處理MP二級結構的變化采用圓二色譜光譜儀進行分析。使用25 mmol?L-1磷酸鹽緩沖液(含0.4 mol?L-1NaCl,pH 6.2)將MP樣品稀釋至0.2 mg?mL-1,以120 nm?min-1的速率從200 nm掃描至260 nm,累計掃描3次取其平均值并扣除緩沖液背景,使用CDNN軟件計算蛋白二級結構含量。
1.3.4 內源性色氨酸熒光測定 使用25 mmol?L-1磷酸鹽緩沖液(含0.4 mol?L-1NaCl,pH 6.2)將MP樣品稀釋為0.4 mg?mL-1,以283 nm作為激發波長利用Fluoro Max-4 熒光分光光度儀記錄290—400 nm的發射光譜,激發和發射狹縫寬度均為1.5 nm。相同條件下記錄樣品緩沖液發射光譜,并從樣品發射光譜中扣除,以排除干擾。
1.3.5 粒度測定 在25℃下使用Mastersizer 2000采用靜態光散射法對不同處理的MP樣品(2 mg?mL-1)的平均粒徑進行分析,將稀釋后的MP樣品分散在蒸餾水(分散介質)中,直至遮光效果達到10%—13%,以避免多次散射。設置MP顆粒折射率為1.434,分散劑折射率為1.330,重復測定3次,取其平均值。
1.3.6 SDS-PAGE 使用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)對MP組分的氧化交聯、聚合或降解情況進行分析。參考CAO等[10]的方法并適當修改,使用4%濃縮膠和12%分離膠在還原(+DTT)和非還原(-DTT)條件下進行凝膠電泳,每孔上樣量為20 μg,染色脫色后拍照,對電泳條帶進行分析。
1.3.7 溶解度測定 使用25 mmol?L-1磷酸鹽緩沖液(含0.4 mol?L-1NaCl,pH 6.2)將MP樣品稀釋至2 mg?mL-1,在5 000×條件下離心15 min,采用雙縮脲法測定上清液的蛋白濃度,溶解度計算公式如下所示:

1.3.8 MP熱誘導凝膠的制備 準確稱取5 g脫氣后的MP樣品(30 mg?mL-1)于玻璃瓶中,封口后置于水浴鍋中以1℃?min-1的升溫速率從20℃加熱至75℃,并在75℃保溫10 min,取出后立刻置于冰水混合物中冷卻30 min,隨后放入4℃冰箱冷藏過夜。在測定MP樣品凝膠性能之前,需將樣品提前取出在室溫下平衡2 h。
1.3.9 MP凝膠白度的測定 參照XIA等[16]的方法,分光測色計經自檢及零點、白板校正后,進行樣品測定。每個樣品3組平行,取平均值。凝膠白度值按下式計算:
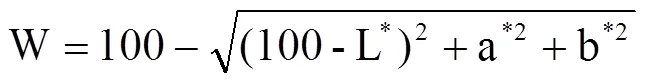
式中,L*為亮度值;a*為紅度值(正值表示偏紅,負值表示偏綠);b*為黃度值(正值表示偏黃,負值表示偏藍)。
1.3.10 MP凝膠持水性能的測定 將凝膠置于離心管中于4℃下離心(6 000×,15 min),記錄離心管質量(m)以及離心前離心管和凝膠總重量(m1)和離心后去除離心管中水分后總重量(m2)。持水性的計算公式如下:
WHC(%)=×100
1.3.11 MP凝膠強度的測定 樣品凝膠強度用TA-XT Plus物性分析儀進行測定。測定模式:測前速率為5 mm?s-1,測中速率為1 mm?s-1,測后速率為5 mm?s-1;下壓距離為8 mm,探頭型號為P/0.5。凝膠強度定義為刺破凝膠所需的初始壓力(N)。
1.3.12 MP凝膠微觀結構的觀察 參照張興等[17]的方法并略做修改。將MP凝膠樣品切成小方塊后使用含2.5%(v/v)戊二醛的磷酸鹽緩沖液(0.1 mol?L-1,pH 7.4)固定4 h,使用pH 7.4的磷酸鹽緩沖液清洗數次,然后通過一系列濃度的乙醇溶液(50%、70%、90%、95%、100%)進行梯度脫水,每次30 min。在-70℃對樣品進行冷凍干燥,將干燥的樣品噴金后使用掃描電鏡觀察其微觀結構,加速電壓15 kV,放大倍數為4 000。
1.4 統計分析
使用Statistix 9.0分析軟件通用線性模型程序(Analytical software, Tallahassee, FL, USA)對試驗數據進行方差分析。采用LSD全配對多重比較方法進行顯著性分析,值設置為0.05。試驗數據以平均數±標準差(SD)表示,使用SigmaPlot 12.5軟件繪圖。
2 結果
2.1 PP和TG處理對氧化損傷MP二級結構的影響
使用圓二色譜對不同處理MP二級結構的變化進行測定,結果如圖1所示。未氧化MP的CD圖譜在208和222 nm處有兩個負峰,表明樣品中-螺旋含量豐富。氧化后這兩個峰明顯變小,這是因為氧化使肌球蛋白尾部的超螺旋結構解開,導致其-螺旋含量下降[11]。不同添加劑處理對氧化損傷MP的CD圖譜和二級結構含量產生了明顯影響,PP處理下氧化損傷MP樣品的-螺旋含量顯著提高(<0.05),TG和PP+TG處理下氧化損傷MP的兩個負峰大小進一步降低,同時-螺旋含量也進一步降低,表明TG交聯導致MP二級結構的變化。
2.2 PP和TG處理對氧化損傷MP三級結構的影響
蛋白質色氨酸殘基的熒光特性對其所處的微環境極其敏感,經常被用來反映蛋白質三級結構的變化。如圖2所示,未氧化MP處于折疊狀態,色氨酸殘基被包圍在MP內部疏水性環境中,具有較大的熒光強度。與之相比,氧化損傷MP樣品的熒光強度顯著降低,說明氧化導致MP結構展開;TG處理促進了氧化損傷MP熒光強度的降低,PP和PP+TG處理均使氧化損傷MP的熒光強度顯著增強,說明添加PP引起了氧化損傷MP構象的變化,但這種構象變化明顯區別于TG引起的變化。
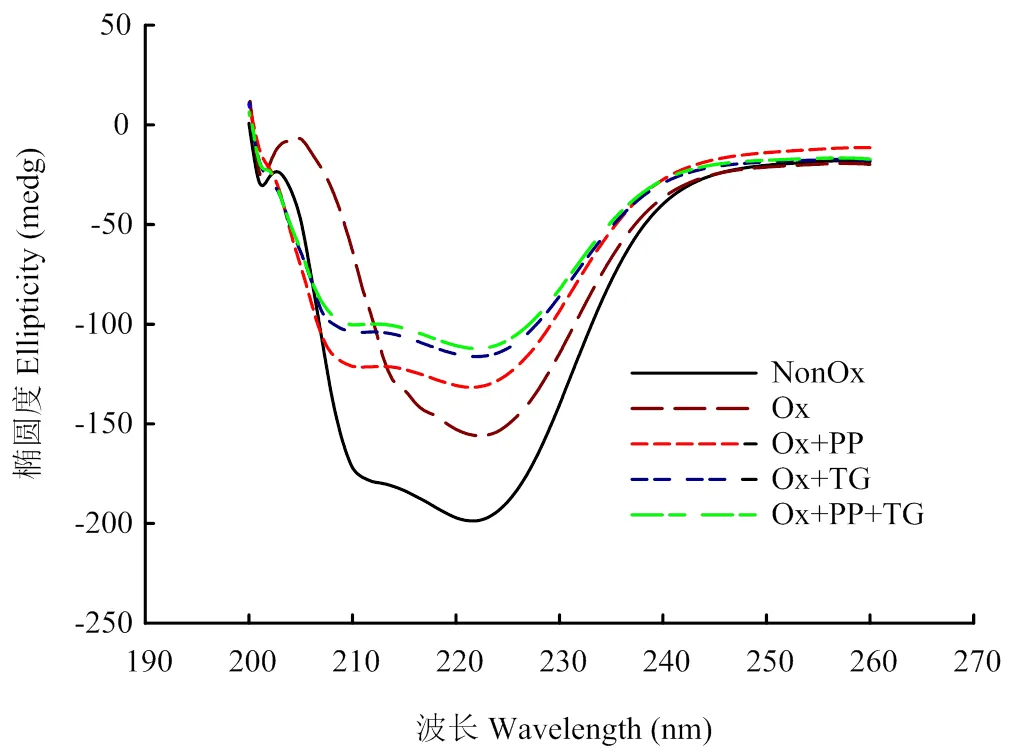
NonOx:未氧化 Non-oxidized;Ox:氧化 Oxidized;Ox+PP:氧化+焦磷酸鈉 Oxidized+sodium pyrophosphate;Ox+TG:氧化+谷氨酰胺轉氨酶 Oxidized+transglutaminase;Ox+PP+TG:氧化+焦磷酸鈉+谷氨酰胺轉氨酶 Oxidized+sodium pyrophosphate+transglutaminase。下同 The same as below
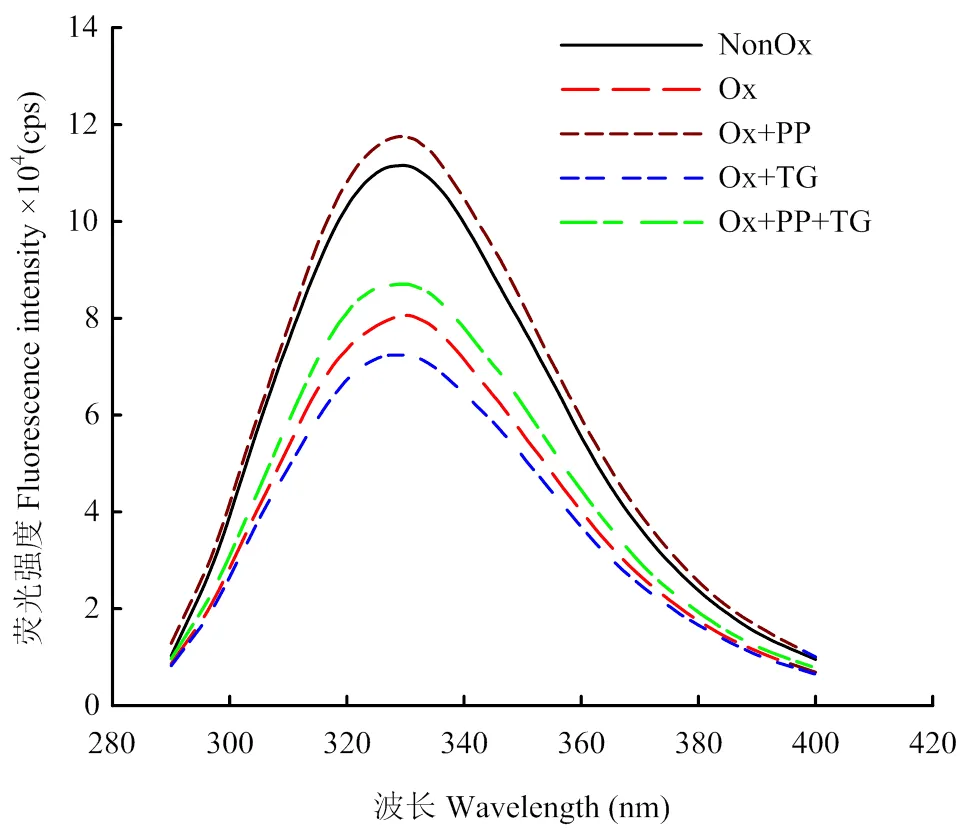
圖2 不同處理對MP內源性色氨酸熒光的影響
2.3 PP和TG處理對氧化損傷MP粒徑的影響
與未氧化的MP相比,氧化損傷MP的d3,2值和d4,3值均顯著增加15%以上(<0.05)。PP的加入使氧化損傷MP的d3,2值和d4,3值分別降低了28.0%和32.9%;TG處理使氧化損傷MP的d3,2值和d4,3值分別下降7.0%和8.3%;PP+TG處理下的氧化損傷MP的平均粒徑值分別下降11.6%和19.2%(圖3)。上述結果表明,PP能顯著降低氧化損傷MP的粒徑,這主要是因為PP能解離肌動球蛋白為肌球蛋白和肌動蛋白。TG對氧化MP粒徑的影響可能要歸因于其對MP構象的影響(圖1、圖2)。
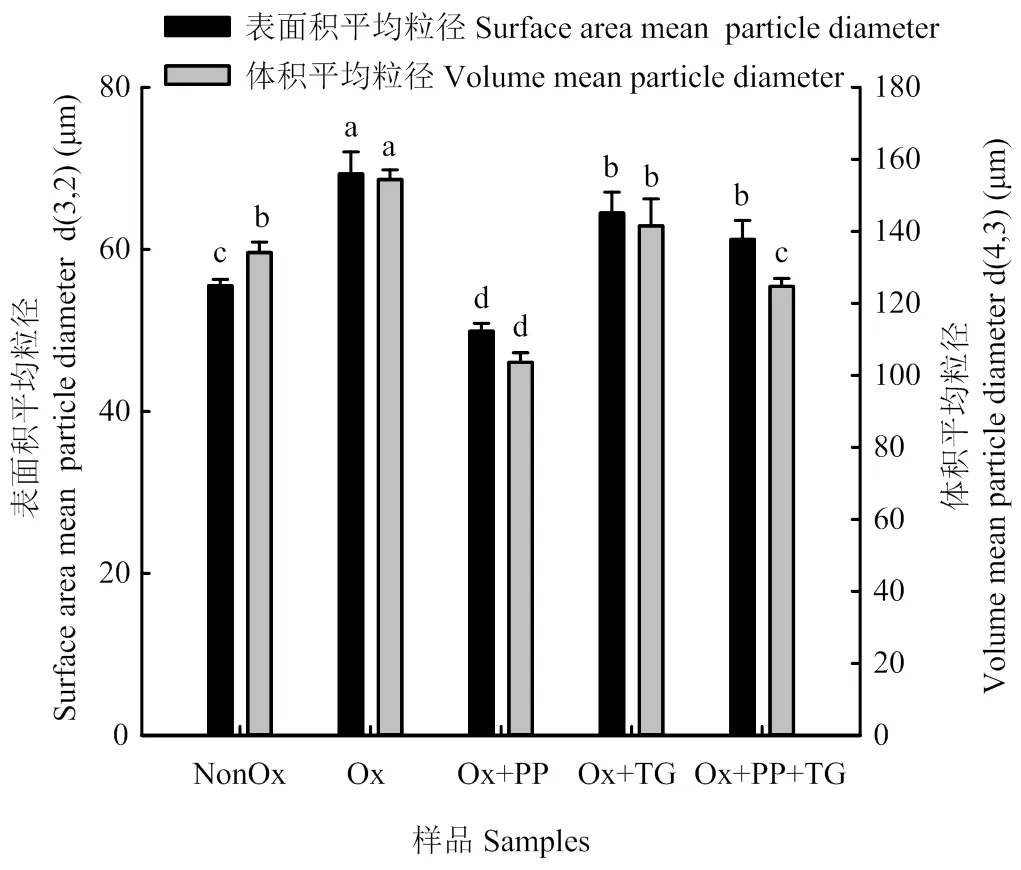
不同小寫字母表示差異顯著(P<0.05)。下同
2.4 PP和TG處理對氧化損傷MP交聯聚集行為的影響
在非還原條件下(圖4-A),與未氧化MP相比,氧化MP的肌球蛋白重鏈(myosin heavy chain,MHC)和肌動蛋白(Actin)的條帶強度明顯降低,同時在濃縮膠的頂端出現了蛋白聚集體;在還原條件下(圖4-B),氧化損傷MP的MHC和Actin條帶損失完全恢復,說明氧化誘導的聚合物主要與肌球蛋白重鏈和肌動蛋白有關[6,18],同時也表明這些聚合物主要通過二硫鍵的交聯形成[19]。PP和TG單獨使用時均未對氧化損傷MP的MHC和Actin條帶強度產生顯著影響,PP+TG處理下的MHC和Actin條帶強度顯著減弱。在還原條件下,PP處理下的氧化損傷MP頂端聚集物完全消失,而TG和PP+TG處理的MP頂端聚集物未完全消失,這表明部分聚集體是由TG催化形成的非S-S共價鍵連接產生,如-(-谷氨酰基)賴氨酸異肽鍵[20]。
2.5 PP和TG處理對氧化損傷MP溶解度的影響
溶解度可以間接反映蛋白分子間以及蛋白與水分子間的相互作用力。如圖5所示,與未氧化MP相比,氧化處理后MP的溶解度下降了40.0%以上。與氧化損傷MP相比,PP處理后氧化損傷MP的溶解度顯著增加31.5%(<0.05),這一結果與圖3中PP處理后顯著降低的MP粒徑相符;TG處理下氧化損傷MP的溶解度顯著降低,而PP+TG處理因PP的存在使得氧化損傷MP溶解度增長約20.0%。
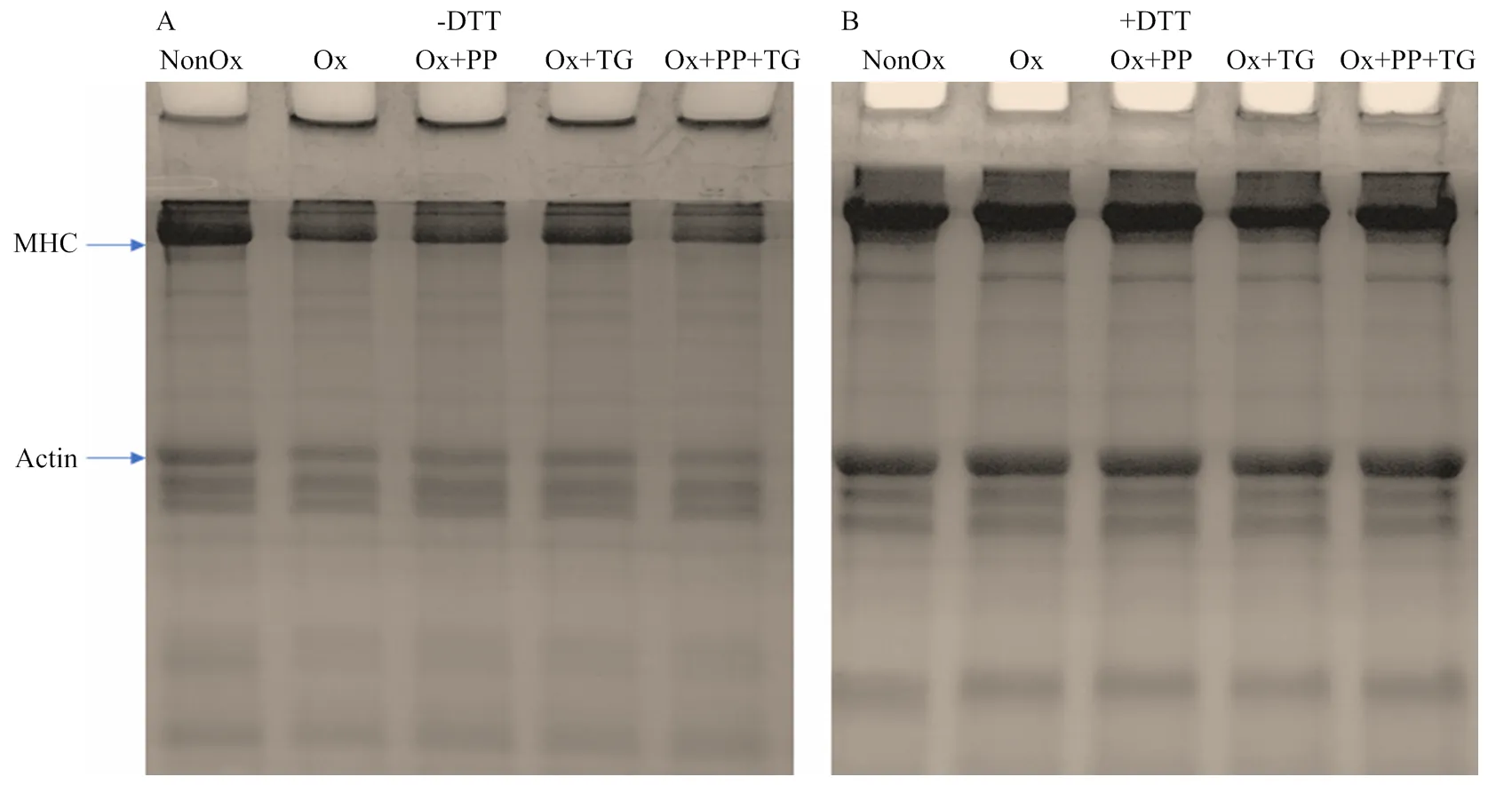
圖4 不同處理對MP交聯聚集情況的影響
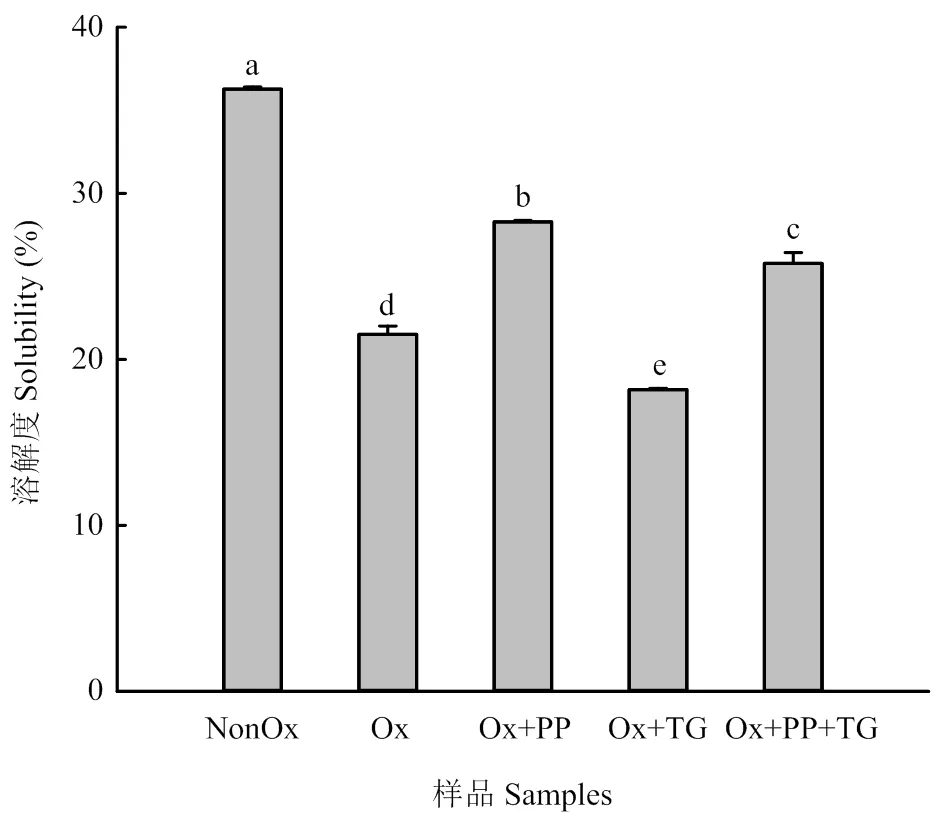
圖5 不同處理對MP溶解度的影響
2.6 PP和TG處理對氧化損傷MP凝膠性能的影響
凝膠的持水性指凝膠在外力作用下保持自身水分或者補充水分的能力[21],它與凝膠內部微觀結構緊密相關。與未氧化MP相比,氧化后MP的凝膠白度有所降低,凝膠的持水性能和凝膠強度分別下降了16.0%和23.8%,推測是MP氧化變性導致。PP、TG和PP+TG處理對氧化損傷MP凝膠的白度均無顯著影響,但是PP以及PP+TG的加入使氧化損傷MP凝膠的持水性分別上升了28.6%和10.4%,單獨添加TG對氧化損傷MP凝膠的持水性無顯著影響。PP、TG和PP+TG處理分別使氧化損傷MP的凝膠強度提高了18.8%、58.3%和97.9%(圖6)。
2.7 PP和TG處理對氧化損傷MP凝膠微觀結構的影響
凝膠的微觀結構與其持水性和凝膠強度密切相關,不同處理MP凝膠的微觀結構特征如圖7所示。未氧化MP凝膠呈現出一種致密、均勻、連續的三維網狀結構,而氧化MP凝膠的微觀結構粗糙多孔、不規則、不均勻,這也導致氧化MP凝膠的持水性降低(圖6)。與氧化MP凝膠相比,PP和PP+TG處理均使凝膠的微觀結構更加細膩、均勻,這很好地解釋了二者明顯增強的凝膠強度及持水性能(圖6)。單獨添加TG使氧化損傷MP的凝膠結構更加緊致,但蛋白不規則聚集體分布并不均勻,伴有“溝壑”的形成。因此,TG處理下氧化損傷MP凝膠擁有較好的凝膠強度,但持水性能卻未得到明顯改善(圖6)。
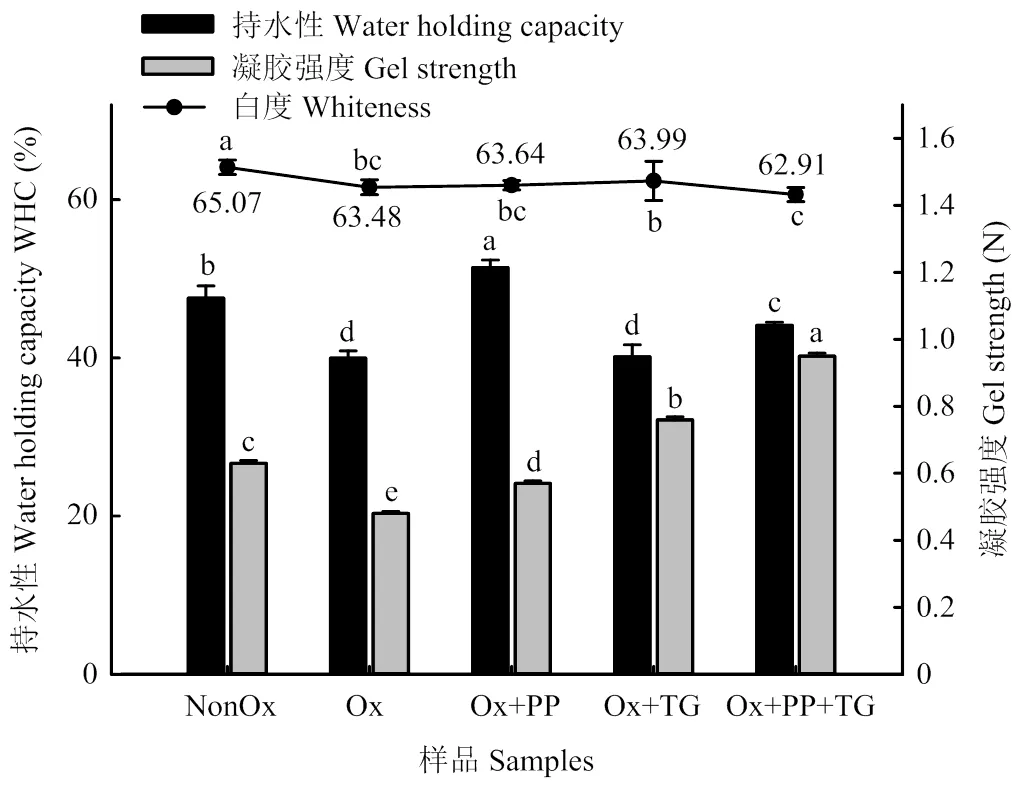
圖6 不同處理對MP凝膠性能的影響
3 討論
3.1 PP和TG處理改變了氧化損傷MP的結構
MP的結構與功能性質密切相關,氧化導致MP的構象發生變化,表現為CD圖譜及內源性色氨酸熒光強度的變化。本研究中氧化損傷MP的-螺旋含量減少,同時伴隨著-折疊、-轉角以及無規則卷曲含量的上升。與之類似,CAO等[22]發現羥自由基氧化體系誘導MP構象改變以及-螺旋含量降低。王策等[23]研究發現羥自由基誘導牛血清蛋白氧化也導致其二級結構發生變化。PP處理下氧化損傷MP的-螺旋含量顯著上升,孫悅[24]研究也發現在羥自由基氧化體系下PP的加入會引起MP樣品的-螺旋含量上升。TG和PP+TG處理導致氧化損傷MP的-螺旋含量稍有下降,推測是TG處理催化了MP分子內及分子間的共價交聯,導致MP二級結構的變化,這與HERRERO等[25]的研究結果一致。
由于色氨酸殘基對其周圍微環境非常敏感,內源性色氨酸熒光特性通常用于反映蛋白質構象的變化[26-27]。與CD結果相對應,氧化后MP因其結構的展開導致熒光強度降低,TG處理引起MP中氨基酸殘基間的共價交聯使熒光強度進一步下降,而PP和PP+TG處理因為PP對氧化MP構象的影響導致熒光強度顯著增強。CAO等[28]研究發現在羥自由基氧化體系下,PP的加入反而促進了氧化引起的MP熒光強度的降低,不一致的原因可能是由氧化誘導體系、PP添加濃度以及添加順序等的不同造成。
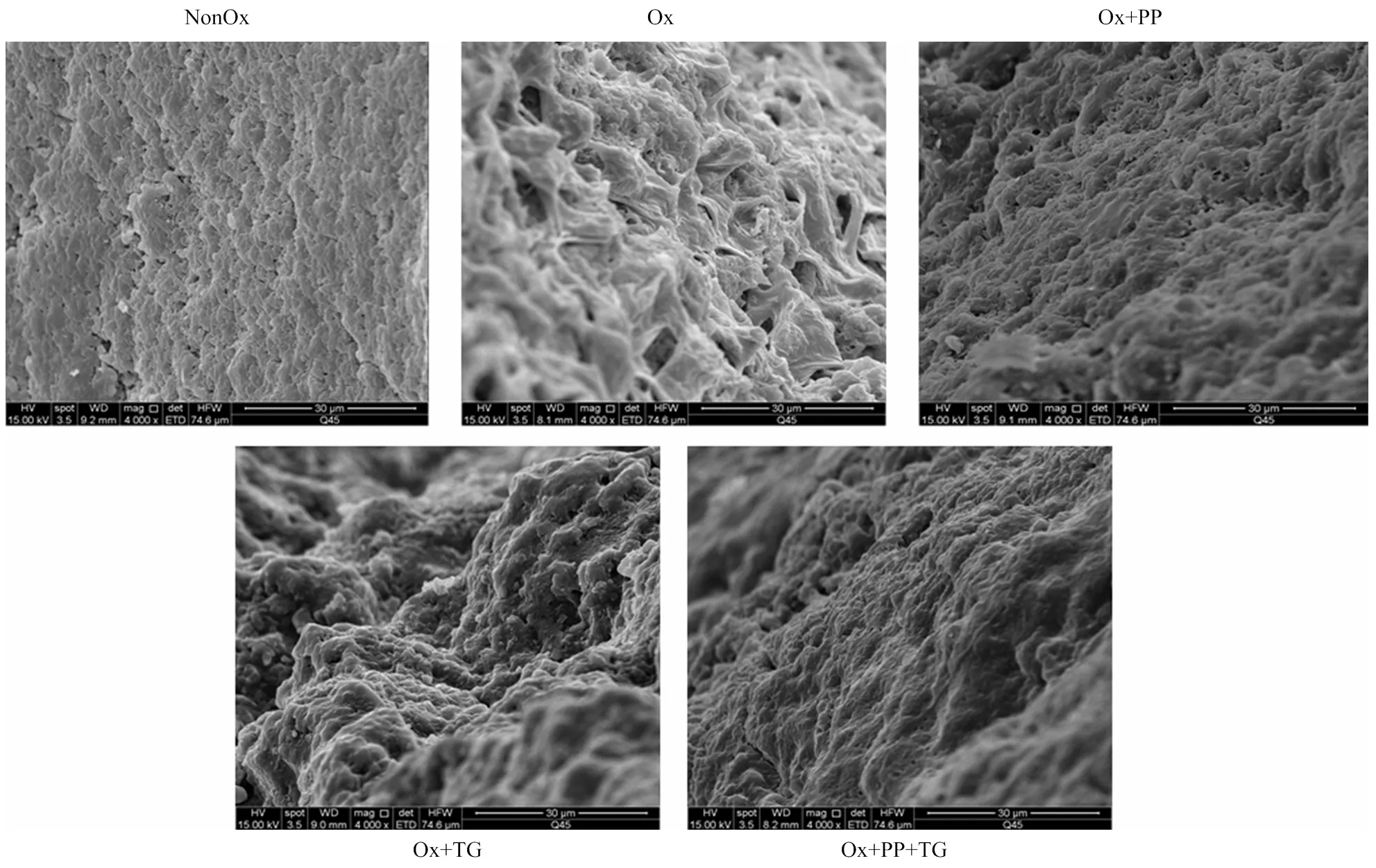
圖7 不同處理對MP凝膠微觀結構的影響
3.2 PP和TG處理改變了氧化損傷MP的交聯聚集效應、提高了其溶解度
氧化會對MP分子內及分子間的共價交聯類型以及交聯程度造成影響,進而對MP的溶解度、凝膠及乳化性能造成影響。本研究中,脂肪氧化體系誘導MP結構展開,MP分子間S-S形成及疏水相互作用增強、蛋白質交聯聚集加劇,導致MP的平均粒徑顯著增大、溶解度顯著降低。前人使用次氯酸鈉、羥自由基等不同體系誘導MP氧化也得到了類似的研究結果[29-31]。TG處理導致氧化損傷MP粒徑略微變小,這可能與TG引起的蛋白分子內及分子間共價交聯導致的MP構象變化有關。值得關注的是,本研究中TG對氧化MP的SDS-PAGE圖譜影響不明顯,但使氧化MP溶解度明顯降低。類似地,LI等[32]在羥基自由基生成系統中研究發現TG處理導致氧化肌球蛋白溶解度進一步損失。PP處理對氧化損傷MP的SDS-PAGE無明顯影響,但導致其平均粒徑顯著降低,這主要是由于PP的加入引起了肌動球蛋白解離為肌球蛋白和肌動蛋白,進而導致MP樣品的顆粒尺寸減小、溶解度增大(圖3、圖5)。CAO等[28]在羥自由基氧化體系中研究發現,當H2O2濃度在0—3 mmol?L-1時,PP添加對MHC和Actin條帶強度無明顯影響;當H2O2濃度為10 mmol?L-1時,添加PP顯著促進了蛋白的共價交聯;但在所有H2O2濃度條件下,添加PP均顯著提高了MP的溶解度。PP+TG處理導致氧化損傷MP中MHC和Actin條帶強度顯著降低(圖4),說明PP的存在促進了TG引起的蛋白組分間的共價交聯;但同時PP的存在使其蛋白粒徑仍低于氧化損傷對照,因此溶解度增大(圖5)。
3.3 PP和TG處理增強了氧化損傷MP的凝膠性能
氧化后MP的凝膠白度有所下降,推測是蛋白氧化變性導致,HWANG等[33]研究發現蛋白的凝膠白度與蛋白質的變性程度有關。PP、TG和PP+TG處理均未對氧化損傷MP的凝膠白度產生負面影響。與未氧化MP相比,氧化后MP凝膠的微觀結構變得粗糙、多孔、松散、不規則,因而其凝膠強度及持水性也顯著下降。類似氧化導致MP凝膠蒸煮損失增大,持水性能下降的結論已有諸多研究報道[34-36]。這可能是由于氧化導致蛋白分子內和分子間相互作用增強,進而形成蛋白大分子聚集體,導致加熱成膠過程中蛋白展開速度低于交聯速度,難以形成穩定有序的三維網絡結構,從而降低了氧化MP的凝膠性能。PP處理后的氧化損傷MP凝膠的微觀結構變得更加細膩、光滑、規則,孔徑也較小,持水性能也顯著增強,凝膠強度也有一定提升,這可能與PP引起的肌動球蛋白解離和溶解度增加有關[28,37-38]。PP與TG復配處理時,氧化損傷MP凝膠的微觀結構致密均勻、凝膠性能增強效果也更好,進一步解釋了 PP與TG間的協同作用。
4 結論
焦磷酸鈉(PP)處理使氧化損傷豬肉肌原纖維蛋白(MP)凝膠的微觀結構更加均勻、細膩,持水性能顯著增強,但凝膠強度增加幅度有限;谷氨酰胺轉氨酶(TG)處理顯著改善了氧化損傷MP的凝膠強度,但其持水性無明顯改善,其凝膠微觀結構存在粗糙、不規則、不均勻等問題;PP+TG處理使氧化損傷MP凝膠性能顯著改善,表現為凝膠三維網絡結構更加細密、均勻,凝膠強度和持水性能均顯著增加。綜上,PP和TG協同使用效果最好,可以有效改善氧化損傷肌原纖維蛋白的凝膠性能。因此,在肉品加工業中,PP和TG復配有望改善氧化損傷原料肉的加工性能,提高肉品品質和企業經濟效益。
[1] Xiong Y L. Protein Oxidation and ImpIications for MuscIe Food QuaIity. Antioxidants in Muscle FoodsNutritional Strategies to Improve Quality New York: Wiley and Sons,2000: 85-90.
[2] Lund M N, Heinonen M, Baron C P, Este?vez M. Protein oxidation in muscle foods: A review. Molecular Nutrition & Food Research, 2011, 55(1): 83-95.
[3] 周非白. 氧化修飾對豬肉肌原纖維蛋白結構與功能特性的調控研究[D]. 廣州: 華南理工大學, 2016.
ZHOU F B, Oxidative modification on porcine myofibrillar protein in relation to structural changes and functional properties [D]. Guangzhou: South China University of Technology, 2016. (in Chinese)
[4] MILLS J, DONNISON A, BRIGHTWELL G. Factors affecting microbial spoilage and shelf-life of chilled vacuum-packed lamb transported to distant markets: A review. Meat Science, 2014, 98(1): 71-80.
[5] 駱雙靈, 張萍, 高德. 肉類食品保鮮包裝材料與技術的研究進展. 食品與發酵工業, 2019, 45(4): 220-228.
LUO S L, ZHANG P, GAO D. Research progress on the packaging materials and technology used for meat foods. Food and Fermentation Industries, 2019, 45(4): 220-228. (in Chinese)
[6] ZHANG L T, LI Q, HONG H, LUO Y K. Prevention of protein oxidation and enhancement of gel properties of silver carp () surimi by addition of protein hydrolysates derived from surimi processing by-products. Food Chemistry, 2020, 316: 126343.
[7] XU C C, QU Y H, HOPKINS D L, LIU C, WANG B, GAO Y F , LUO H L. Dietary lycopene powder improves meat oxidative stability in Hu lambs. Journal of the Science of Food and Agriculture,2019, 99(3): 1145-1152.
[8] JONGBERG S, SKOV S H, TORNGREN M A, SKIBSTED L H, LUND M N. Effect of white grape extract and modified atmosphere packaging on lipid and protein oxidation in chill stored beef patties. Food Chemistry,2011, 128(2): 276-283.
[9] 李艷青. 蛋白質氧化對鯉魚蛋白結構和功能性的影響及其控制技術哈爾濱: 東北農業大學, 2013.
LI Y Q. Protein oxidation-induced structure and function changes of common carp () protein and its control technologyHarbin: Northeast Agricultural University, 2013. (in Chinese)
[10] CAO Y G, TRUE A D, CHEN J, XIONG Y L. Dual role (anti-and pro-oxidant) of Gallic acid in mediating myofibrillar protein gelation and geldigestion. Journal of Agricultural and Food Chemistry, 2016, 64(15): 3054-3061.
[11] 曹云剛. 植物多酚對肉蛋白氧化穩定性和功能特性的影響機理及應用[D]無錫: 江南大學, 2016.
CAO Y G. Effect of plant-derived polyphenols on oxidative stability and functional properties of meat proteins: Mechanism and application [D]. Wuxi: Jiangnan University, 2016. (in Chinese)
[12] 李春強. 肌原纖維蛋白的氧化程度對谷氨酰胺轉移酶催化交聯作用的影響及其機理研究[D]無錫: 江南大學, 2013.
LI C Q. Mechaism of transglutaminase-catalyzed cross-linking of oxidatively stressed myofibrillar protein [D]. Wuxi: Jiangnan University, 2013. (in Chinese)
[13] SHEN Q W, SWARTZ D R. Influence of salt and pyrophosphate on bovine fast and slow myosin S1 dissociation from actin. Meat Science, 2010, 84(3): 364-370.
[14] YOKOYAMA K, NIO N, KIKUCHI Y. Properties and applications of microbial transglutaminase. Applied Microbiology and Biotechnology, 2004, 64(4): 447-454.
[15] PARK D, XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems. Food Chemistry,2007, 103(2): 607-616.
[16] XIA X F, KONG B H, XIONG Y L , REN Y M. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation. Meat Science,2010, 85(3): 481-486.
[17] 張興, 楊玉玲, 馬云, 王靜宇. pH對肌原纖維蛋白及其熱誘導凝膠非共價鍵作用力與結構的影響. 中國農業科學, 2017, 50(3): 564-573.
ZHANG X, YANG Y L, MA Y, WANG J Y. Effects of pH on the non-covalent forces and structure of myofibrillar protein and heat induced gel. Scientia Agricultura Sinica, 2017, 50(3): 564-573. (in Chinese)
[18] LIU G, XIONG Y L, BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolates. Journal of Food Science,2000, 65(5): 811-818.
[19] 曹云剛, 馬文慧, 艾娜絲, 閆林林, 趙倩倩, 閔紅衛, 白雪, 黃峻榕. 氧化強度對肌原纖維蛋白結構及凝膠性能的影響. 食品科學, 2019, 40(20): 21-27.
CAO Y G, MA W H, AI N S, YAN L L, ZHAO Q Q, MIN H W, BAI X, HUANG J R. Effects of different oxidation intensities on the structure and gel properties of myofibrillar protein. Food Science, 2019, 40(20): 21-27. (in Chinese)
[20] RAMIREZ-SUAREZ J C, XIONG Y L. Transglutaminase cross- linking of whey/myofibrillar proteins and the effect on protein gelation. Journal of Food Science,2002, 67(8): 2885-2891.
[21] 夏秀芳, 孔保華, 郭園園, 劉騫. 反復冷凍-解凍對豬肉品質特性和微觀結構的影響. 中國農業科學, 2009, 42(3): 982-988.
XIA X F, KONG B H, GUO Y Y, LIU Q. Effect of freeze-thawing cycles on the quality properties and microstructure of pork muscle. Scientia Agricultura Sinica, 2009, 42(3): 982-988. (in Chinese)
[22] CAO Y G, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein. Food Chemistry, 2015, 180: 235-243.
[23] 王策, 李俠, 鄧少穎, 王航, 張春暉. 羥基自由基氧化對牛血清白蛋白結構及水合特性的影響. 中國農業科學,2017, 50(15): 3013-3023.
WANG C, LI X, DENG S Y, WANG H, ZHANG C H. Effects of hydroxyl radicals oxidation on structure and hydration properties of bovine serum albumin. Scientia Agricultura Sinica, 2017, 50(15): 3013-3023. (in Chinese)
[24] 孫悅. 焦磷酸鹽引起的豬肉肌球蛋白結構變化對TGase交聯反應的影響[D]. 沈陽: 沈陽農業大學, 2019.
SUN Y. Effect of structural-changes induced by pyrophosphate on the cross-linking action of pork myosin by TGase [D]. Shenyang: Shenyang Agricultural University, 2019. (in Chinese)
[25] HERRERO A M, CAMBERO M I, ORDó?EZ J A, DE LA HOZ L, CARMONA P. Raman spectroscopy study of the structural effect of microbial transglutaminase on meat systems and its relationship with textural characteristics. Food Chemistry, 2008, 109(1): 25-32.
[26] CAO Y G, MA W H, WANG J K, ZHANG S H, WANG Z Y, ZHAO J, FAN X, ZHANG D Q. Influence of sodium pyrophosphate on the physicochemical and gelling properties of myofibrillar proteins under hydroxyl radical-induced oxidative stress. Food & Function, 2020, 11(3): 1996-2004.
[27] LI F F, WANG B, KONG B H, SHI S, XIA X F. Decreased gelling properties of protein in mirror carp () are due to protein aggregation and structure deterioration when subjected to freeze-thaw cycles. Food Hydrocolloids, 2019, 97: 105223.
[28] CAO Y G, MA W H, HUANG J R, XIONG Y L. Effects of sodium pyrophosphate coupled with catechin on the oxidative stability and gelling properties of myofibrillar protein. Food Hydrocolloids,2020, 104: 105722.
[29] BAO Y L, BOEREN S, ERTBJERG P. Myofibrillar protein oxidation affects filament charges, aggregation and water-holding. Meat Science, 2018, 135: 102-108.
[30] 胡忠良, 鄒玉峰, 林玉海, 普琦, 徐幸蓮. 氧化程度對肌原纖維蛋白熱凝膠及理化特性的影響. 食品科學, 2013, 34(17): 19-23.
HU Z L, ZOU Y F, LIN Y H, PU Q, XU X L. Effect of oxidation degree on heat-induced gel formation and physico-chemical properties of myofibrillar protein. Food Science, 2013, 34(17): 19-23. (in Chinese)
[31] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radical- generating system. Journal of Agricultural and Food Chemistry, 1997, 45(2): 310-320.
[32] LI C Q, XIONG Y L. Mild oxidation promotes myosin S2 cross-linking by microbial transglutaminase. Food Chemistry, 2019, 287: 390-397.
[33] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting. Food Chemistry,2007, 104(2): 746-753.
[34] 楊玉玲, 周磊, 游遠, 湯曉智, 魏蘇萌. 氧化對肌原纖維蛋白熱誘導凝膠質構特性及保水性的影響. 中國農業科學, 2018, 51(18): 3570-3581.
YANG Y L, ZHOU L, YOU Y, TANG X Z, WEI S M. The effects of oxidation on textural properties and water holding capacity of heat-induced myofibrillar protein gel. Scientia Agricultura Sinica, 2018, 51(18): 3570-3581. (in Chinese)
[35] ZHOU F B, ZHAO M M, SU G W, CUI C, SUN W Z. Gelation of salted myofibrillar protein under malondialdehyde-induced oxidative stress. Food Hydrocolloids,2014, 40: 153-162.
[36] 李銀, 孫紅梅, 張春暉, 白躍宇, 王振宇. 牛肉解凍過程中蛋白質氧化效應分析. 中國農業科學, 2013, 46(7): 1426-1433.
LI Y, SUN H M, ZHANG C H, BAI Y Y, WANG Z Y. Analysis of frozen beef protein oxidation effect during thawing. Scientia Agricultura Sinica, 2013, 46(7): 1426-1433. (in Chinese)
[37] JULAVITTAYANUKUL O, BENJAKUL S, VISESSANGUAN W. Effect of phosphate compounds on gel-forming ability of surimi from bigeye snapper (). Food Hydrocolloids,2006, 20(8): 1153-1163.
[38] SHAO J H, DENG Y M, JIA N, LI R R, CAO J X, LIU D Y, LI J R. Low-field NMR determination of water distribution in meat batters with NaCl and polyphosphate addition. Food Chemistry, 2016, 200: 308-314.
Synergistic Enhancement of Gelling Properties of Oxidatively Damaged Myofibrillar Protein by Sodium Pyrophosphate and Transglutaminase
LI BaoLing, LI Ying, FAN Xin, MA WenHui, CAO YunGang
School of Food and Biological Engineering, Shaanxi University of Science and Technology, Xi’an 710021
【】This study was designed to explore the effects of sodium pyrophosphate (PP), transglutaminase (TG), and their combination (PP+TG) on the gelling properties of oxidatively damaged pork myofibrillar protein (MP), which was expected to provide a theoretical basis for the enhancement of functional properties of oxidatively damaged proteins. 【】 MP was extracted from porcinemuscle, and oxidized using a lipoxygenase-linoleic acid oxidation system. Subsequently, PP (1 mmol?L-1), TG (E:S=1:500) and their combination (PP+TG) were added and incorporated into the oxidatively damaged MP systems, respectively. The effects of different additive treatments on the secondary and tertiary structures of oxidatively damaged MP solution were investigated by circular dichroism spectroscopy and endogenous tryptophan fluorescence, respectively. The changes of cross-linking and aggregation of MP with different treatments were investigated through measuring particle size, solubility and SDS-PAGE. The textural properties of MP gels were measured by physical property tester, and the water holding capacity (WHC) was determined by centrifugation method. The whiteness of the MP gels was measured by spectrophotometer, and the microstructure of the MP gels was observed by a scanning electron microscopy. 【】The results showed that PP treatment significantly changed the protein conformation, reduced the mean particle size and enhanced the solubility of oxidatively damaged MP, and obviously enhanced the gel strength and water holding capacity (<0.05). The microstructure of gel with PP treatment was more regular, uniform and delicate than that of oxidatively damaged MP gel. TG treatment significantly improved the gel strength, but had no positive effect on the water holding capacity. While the MP gel with TG treatment had a compact microstructure with small pores, there were still irregular shape and rough surface. On the whole, the combination of PP and TG had the best synergistic effect. The gel strength and water holding capacity of oxidatively damaged MP under PP+TG treatment were significantly enhanced, and the gel performance was obviously better than that of non-oxidized MP. 【】 The combination of PP and TG could effectively improve the gelling properties of oxidatively damaged MP.
myofibrillar protein; sodium pyrophosphate; transglutaminase; oxidation; gelling properties

10.3864/j.issn.0578-1752.2021.16.014
2020-11-05;
2021-01-07
國家自然科學基金青年基金(31801480)、陜西省科技廳自然科學基礎研究計劃項目(2019JQ-397)
李保玲,E-mail:1650608180@qq.com。通信作者曹云剛,E-mail:caoyungang@sust.edu.cn
(責任編輯 趙伶俐)

