一株從云南西部土壤中分離的蕈狀芽孢桿菌(Bacillus mycoides)的抗氧化活性研究
*范集壯 程依婷 高玉婷 佘容* 楊曉燕
(1.大理大學天然抗氧化劑與抗氧化炎癥研究院 云南 671003 2.中國三江并流區域生物多樣性協同創新中心 云南 671003 3.大理大學 三江并流區域生物多樣性保護與利用云南省創新團隊 云南 671003 4.大理大學 東喜瑪拉雅研究院 云南 671003)
前言
隨著我國老齡化問題的加劇,暴露出了許多醫療健康問題,如關節炎、心腦血管疾病、衰老、腫瘤等許多老年性疾病正逐漸成為威脅著人們生命健康的重要疾病[1]。當前研究表明,自由基是引起這一生命趨弱化的重要因素,尤其是大量證據表明,在病理狀態下、氧自由基的慢性或急性過度產生可誘發或加重心腦血管疾病,并且自由基對蛋白質和核酸的影響涉及面很廣[2]。而對其預防的手段之一是使用清除自由基的藥物,但目前市面上廣泛使用的此類藥物主要是人工合成的維生素C(Vit C)對人體健康有潛在威脅,因此不適宜長期服用。天然抗氧化劑是從天然物質中分離提取的,相比于合成維生素C,更適宜人長期服用,且其含有的其他天然活性成分更有利于人體吸收[3]。因此,對于天然抗氧化物的開發迫在眉睫。目前,關于天然抗氧化物的研究現主要集中在植物方面,利用微生物進行天然抗氧化開發的研究較少。
微生物是自然界的重要組成部分,微生物所產生的藥物與一般化學藥物相比,具有巨大的優越性,其主要表現為微生物生長周期短,易于選種培育,可在短時間內大規模發酵,容易實現工業化生產[4];其次關于微生物資源方面,學術界認為目前可培養微生物仍只是自然界的1%[5],其中未被開發利用的微生物資源非常豐富。但目前關于微生物抗氧化藥物方面的研究主要集中在乳酸菌[6-7]和雙歧桿菌[8],因此,如果能夠擴大研究范圍到其他微生物上,不僅能夠豐富抗氧化微生物資源,還能在微生物抗氧化產品開發上起到促進作用。
蕈狀芽孢桿菌(Bacillus mycoides)又稱為臘狀芽孢桿菌蕈狀變種,屬于芽孢桿菌屬蠟狀芽孢桿菌亞種[9],在自然界中廣泛存在。已有研究表明,蕈狀芽孢桿菌代謝產物具有提高免疫[10]、抑菌[11]、致病[12]等功能,但是關于其是否具有抗氧化活性的研究還未曾報道。基于此,本研究擬利用實驗室已經分離獲得的蕈狀芽孢桿菌為研究對象,探索其作為抗氧化劑開發的潛能。研究擬以蕈狀芽孢桿菌菌株的發酵產物提取物為對象,通過測定其對DPPH和ABTS的自由基清除率以及對FRAP的氧化還原能力評估樣品的抗氧化能力,為利用蕈狀芽孢桿菌進行天然抗氧化物的開發篩選提供參考信息。
1.材料與方法
(1)菌株與培養基
①菌株與培養基
供試菌株:蕈狀芽孢桿菌SH-4 (大理大學東喜瑪拉雅研究院保藏)。
②培養基
牛肉膏蛋白胨培養基:牛肉膏3g,蛋白胨10g,NaCl 5g,蒸餾水1000ml,調至pH7.4-7.6,121℃,30min滅菌備用。
(2)儀器與試劑
①儀器
冷凍干燥機(SCIENTZ-10N,寧波新芝生物科技股份有限公司),旋轉蒸發器(RE-2000A,上海亞榮生化儀器廠),高速離心機(LG10-2.4A,北京醫用離心機廠),可見分光光度計(722N,上海菁華科技儀器有限公公司),電子天平(PX224ZH,奧豪斯儀器有限公司),超聲波清洗機(寧波新芝生物科技股份有限公司)。
②試劑
1,1-二苯基-2-三硝基苯肼(DPPH,海化成工業發展有限公司),2,2'-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(ABTS,上海麥克林生化科技有限公司),2,4,6-三吡啶基三嗪(TPTZ,上海麥克林生化科技有限公司),抗壞血酸(Vit C,國藥集團化學試劑有限公司),乙酸乙酯(天津市風船化學試劑科技有限公司),牛肉浸膏(廣東環凱微生物科技有限公司),蛋白胨(北京奧博星生物科技有限責任公司),氯化鈉(國藥集團化學試劑有限公司),均為分析純。
(3)試驗方法
①菌株的純化
在超凈工作臺取于甘油保種管的原始蕈狀芽孢桿菌SH-4菌株在牛肉膏蛋白胨固體培養基上進行劃線培養活化,然后放入28℃培養箱倒置培養。
②蕈狀芽孢桿菌SH-4發酵液制備
將已經活化的蕈狀芽孢桿菌SH-4菌株接種到滅菌的牛肉膏蛋白胨液體培養基中,于溫度為28℃,140rpm/min搖床中培養3d。
③蕈狀芽孢桿菌代謝產物提取
蕈狀芽孢桿菌發酵好后用等體積的乙酸乙酯萃取,再應用超聲輔助提取,超聲條件:20℃、40Hz、60power、1h,超聲完成后靜置一晚,隔天取上清液進行旋蒸,旋蒸條件:30℃、40rpm/min。旋蒸完成后,將濃縮的提取物用少量蒸餾水超聲輔助溶解,轉移至已稱重、干燥、干凈的培養皿后置于-20℃冰箱,待提取物凝固后利用冷凍干燥機冷凍干燥數天,所獲固體為菌體代謝產物。
④DPPH清除能力測定
DPPH溶液的配制:準確稱取DPPH粉末1g,用無水乙醇溶解并定量轉入1L棕色容量瓶中,用無水乙醇定容至刻度,搖勻,得質量濃度為1g/L的DPPH儲備液,置于冰箱中冷藏備用。
DPPH標準曲線:吸取1mL DPPH儲存液和19mL無水乙醇混合搖勻,將儲備液稀釋20倍,配制成50mg/L的DPPH工作液。再將工作液用無水乙醇依次稀釋為5mg/L、2.5mg/L、2mg/L、1mg/L、0.5mg/L、0.05mg/L濃度做DPPH標準曲線使用。
DPPH自由基清除率的測定:準確稱取蕈狀芽孢桿菌乙酸乙酯提取物0.1g,用10ml無水乙醇溶解,得到10g/L提取物母液。再將提取物母液依次稀釋為10g/L,5g/L,2.5g/L,1g/L,0.5g/L,0.25g/L,0.1g/L,0.05g/L,0.025g/L待測溶液,以等質量濃度的Vit C為參照。精確吸取0.7ml待測樣品溶液和0.7ml DPPH工作溶液1:1混勻為實驗組,對照組用0.7mL無水乙醇代替DPPH溶液,以加入0.7mL DPPH和0.7mL無水乙醇為標準組,每個濃度設置三個復孔,37℃水浴30min后用1mL比色皿于517nm分光光度計處測吸光值,計算清除率及IC50,并以Vit C的IC50為對照計算樣本比活性[13-15]。
自由基清除率(%)=[1-(Ai-Aj)/A0]×100%
實驗組吸光度記為Ai;對照組吸光度作為Aj;標準組吸光度作為A0值。
IC50計算:運用SPSS建立三個變量,分別是濃度,清除率和總數。建立好后輸入數據,其中總數用1或者100表示,其他按實際輸入。輸好后使用回歸中的Probit分析,其中響應頻率為清除率,觀測值匯總為總數,協變量為濃度,轉換選擇對數底為10,模型選擇logit,隨后在彈出的輸出界面的置信限制中找到概率0.50的估計濃度即為IC50。
比活性的計算[16]:
“小時候,有個家伙欺負我,看到我的連環畫就想搶走,我打不過他不知怎么辦,就觀察別的小孩,發現當一個小孩被人欺負的時候,就說我有一個哥哥,或者我有一個誰誰很厲害。當時我正好看了鄭淵潔寫的皮皮魯的故事,于是我靈機一動對那個小孩說我有一個哥哥,名字叫皮皮魯,可厲害了,你知不知道?他瞪著眼睛想了半天不知道皮皮魯是誰,但被這個怪異的名字嚇住了,居然放過了我。”
AE=1/IC50(AE為自由基清除能力)
AE(樣品)=1/IC50(樣品)
AE(Vitc)=1/IC50(Vitc)
比活性=AE(樣品)/AE(Vitc)=IC50(Vitc)/IC50(樣品)
⑤ABTS清除能力測定
ABTS工作液的配制:避光稱取ABTS粉末30mg,加超純水8mL溶解配制得7mmol/L ABTS水溶液,精密稱取10mgK2S2O8加15mL超純水溶解得4.9mmol/L過硫酸鉀水溶液,將以上兩種水溶液按1:1等量混合,置于4℃冰箱避光情況儲存12-16h,得到ABTS母液備用。使用時,用無水乙醇在734nm稀釋至吸光度為0.70±0.02Abs范圍內工作液。
ABTS標準曲線:將Vit C用無水乙醇依次稀釋為10mg/L,7.5mg/L,5mg/L,2.5mg/L,1.25mg/L,0.25mg/L濃度。樣品和ABTS工作液體積比按1:3加入反應,做ABTS標準曲線使用。
ABTS自由基清除率(%)=[1-(Ai-Aj)/A0]×100%
實驗組吸光度記為Ai;對照組吸光度作為Aj;標準組吸光度作為A0值。
⑥總抗氧化能力(FRAP法)的測定
TPTZ工作液的配制:分別配置醋酸鹽緩沖液(pH3.6),10mmol/L TPTZ溶液,20mmol/L FeCl3溶液,并按照體積比10:1:1混合,制成TPTZ工作液。
FeSO4·7H2O標準曲線的繪制:配置成1.6mmol/L,0.8mmol/L,0.4mmol/L,0.2mmol/L,0.1mmol/L不同濃度FeSO4標準溶液,取不同濃度FeSO4標準溶液0.1mL,分別加入TPTZ工作液2.4mL,混勻后37℃避光反應10min,593nm測定吸光度,并根據FeSO4濃度與吸光度繪制標準曲線。
樣本總氧化還原能力測定:準確稱取蕈狀芽孢桿菌乙酸乙酯提取物0.1g,用10mL乙醇溶解,得到10g/L提取物母液。用無水乙醇將提取物母液梯度稀釋為5g/L,2.5g/L,1g/L,0.5g/L,0.25g/L,0.1g/L,0.05g/L,0.025g/L濃度的待測液。精確吸取待測樣液0.1mL,加入TPTZ工作液2.4mL,37℃條件下水浴10min,于593nm處測定吸光度為實驗組。同時,以無水乙醇代替TPTZ工作液分別與不同濃度FeSO4標準溶液反應,所得吸光度為對照組吸光度。根據FeSO4·7H2O標準曲線求得1.0mmol/L標準FeSO4和TPTZ工作液反應,所得吸光度為標準組吸光度[15]。
FRAP值計算:
FRAP=(Ai-Aj)/Ao
其中,Ai為實驗組吸光度;Aj為對照吸光度;Ao為標準吸光度。
2.結果與分析
(1)DPPH自由基清除率
①DPPH自由基標準曲線
DPPH自由基標準曲線結果顯示DPPH溶液在0.05mg/L-5mg/L濃度范圍內,濃度與清除率呈現良好的正相關關系,其回歸方程y=-5.5084x2+45.365x-4.8754,相關系數R2=0.9842,如圖1。
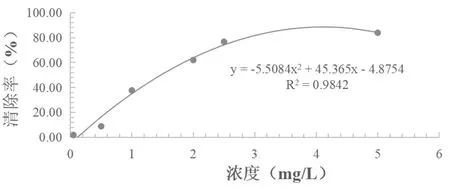
圖1
②DPPH自由基清除率測定結果
蕈狀芽孢桿菌乙酸乙酯粗提取物具有良好的清除DPPH自由基的能力,且隨著樣品濃度的升高,清除能力增加。提取物質量濃度0.025g/L到10g/L之間,DPPH自由基清除率從(2.23±0.01%)增加到(95.74±0.02%)。樣品的IC50為1.395g/L是Vit C的0.0717%(Vit C的IC50為0.001g/L),如圖2。
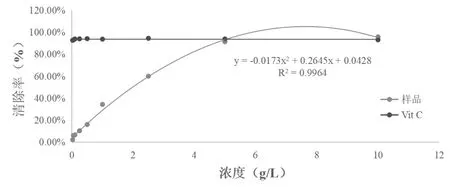
圖2 DPPH自由基清除率的測定結果
(2)ABTS法測定
①ABTS自由基標準曲線
ABTS自由基標準曲線結果顯示ABTS溶液在0.25mg/L-10mg/L濃度范圍內,濃度與清除率呈現良好的正相關關系,其回歸方程y=0.602x2+1.1322x,相關系數R2=0.9766,如圖3。
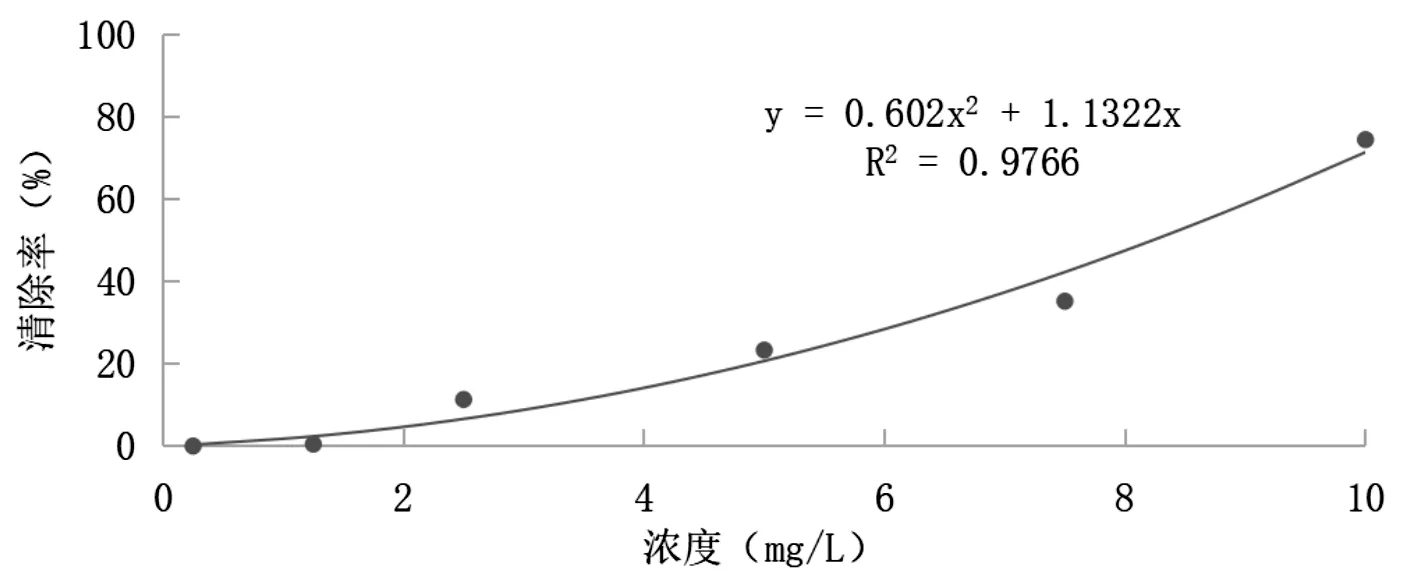
圖3 ABTS自由基標準曲線
②ABTS自由基清除率測定結果
蕈狀芽孢桿菌乙酸乙酯粗提取物對ABTS自由基的清除率隨濃度升高明顯的增加。在試驗濃度0.025g/L到0.5g/L濃度范圍內,當濃度為0.025g/L時,清除率可達(23.76±0.0055%),濃度為0.5g/L時,清除率高達(88.30±0.0018%)。樣品的IC50為0.0830g/L,為Vit C的9.639%(Vit C的IC50為0.008g/L),蕈狀芽孢桿菌粗提物具有較好的清除效果,如圖4。
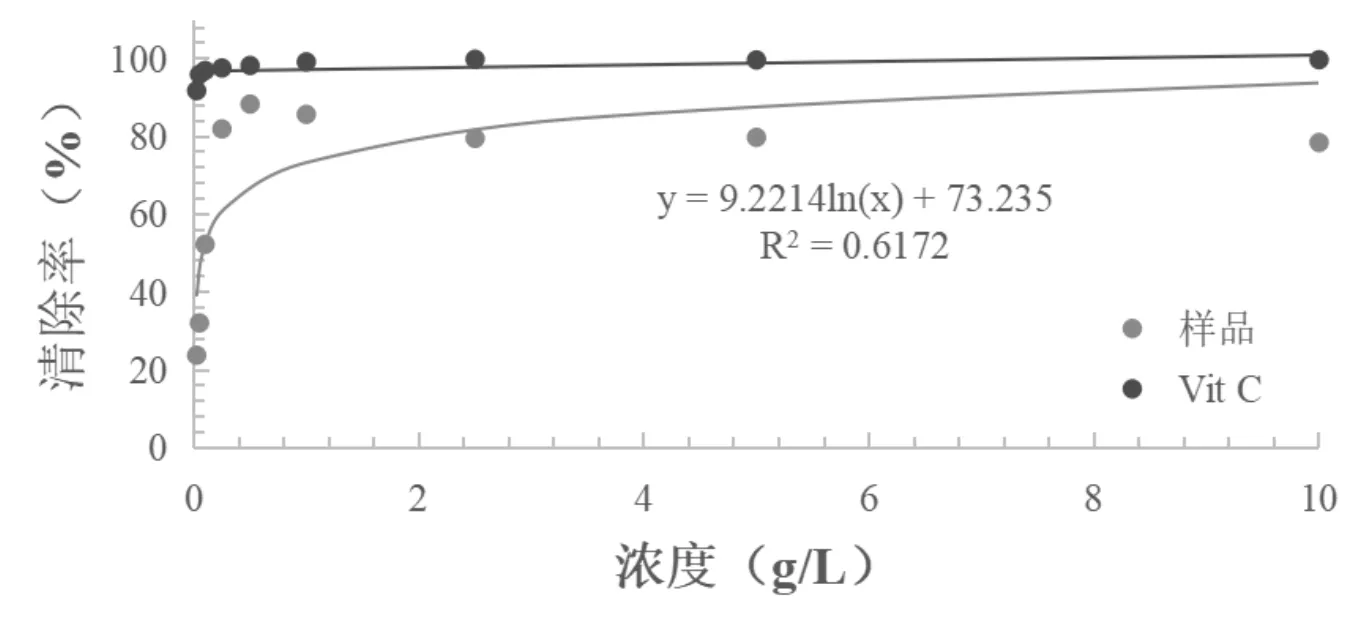
圖4 ABTS自由基清除率的測定結果
(3)總抗氧化能力(FRAP法)測定結果
①FeSO4·7H2O標準曲線
FeSO4溶液在0.1-1.6mmol/L范圍內,與TPTZ工作液反應,其濃度與吸光度呈現良好的正相關關系,標準曲線方程y=-0.0322x2+0.148x+0.0699,R2=0.9999,如圖5。
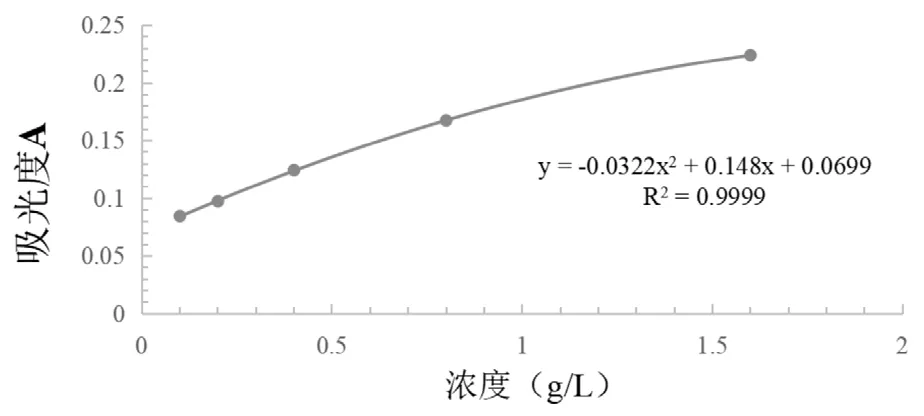
圖5 FeSO4標準曲線
②蕈狀芽孢桿菌總抗氧化能力
蕈狀芽孢桿菌乙酸乙酯粗提物在試驗濃度0.025g/L~10g/L下,總還原力隨著濃度的增加而升高,FRAP值從0.3267mmol/L增加到1.502mmol/L,如圖6。
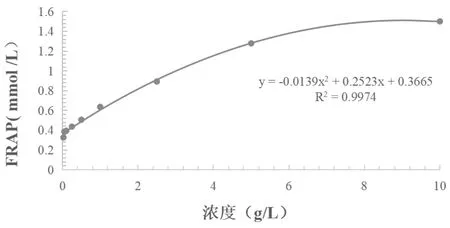
圖6 FRAP總抗氧化能力的測定結果
3.結論與討論
(1)粗提液濃度不同影響抗氧化效果
低濃度抗氧化劑起抗氧化效果,高濃度抗氧化劑起促氧化效果。本實驗結果也顯示,在低濃度下蕈狀芽孢桿菌粗提物對自由基的清除率隨濃度的升高而上升,但當清除率達到峰值后升高濃度,粗提物對自由基的清除率不升反降。2011年,《Cell》雜志就曾指出,低濃度自由基能刺激機體啟動保護機制,進而提高機體抗氧化能力[17]。說明對于抗氧化劑使用的劑量越多對于自由基的清除效果并非越好,甚至Sesso等就曾證實Vit C和Vit E不僅不能有效的預防心血管疾病,Vit E甚至還會增加血性中風的概率[18]。
(2)抗氧化微生物資源豐富
目前對于抗氧化微生物的篩選主要集中在高原、荒漠[19-20]、深海[21]等異質性較強的生境中,在這樣極端的環境中的微生物就更容易受到氧化損傷,這也就更可能刺激在極端環境中存活的微生物形成了獨特抗逆機制來保護自身的生存和傳代。那在極端環境中就更有利于我們篩選出具有抗氧化性的微生物。云南西部地區受綜合地理因素影響,自然氣候景觀多種多樣,是亞洲地區生物多樣性最高的區域,所蘊含微生物資源非常豐富。本研究自云南西部土壤中分離所得蕈狀芽孢桿菌的發酵液粗提物表現出很好的抗氧化能力,可進一步探究其有效抗氧化分子及抗氧化機制,為開發新型、優質天然抗氧化及提供參考。

