脫氧雪腐鐮刀菌烯醇及其衍生物檢測 方法的研究進展
劉 慧,吳 穎,黃 華
(1.北京市產品質量監督檢驗院,北京 101300;2.中國農業大學食品科學與營養工程學院,北京 100083)
真菌毒素是真菌在適宜條件下產生的小分子次級代謝產物,絕大部分具有毒性。目前已知的真菌毒素超過300余種[1],據聯合國糧食及農業組織統計,全球每年約有25%~50%的農作物會遭受真菌毒素的污染[2]。近年來, 由于氣候變化和現代農業生產方式的改變,赤霉病已成為影響小麥等農作物生產的最為嚴重的真菌病害之一。研究表明,赤霉病的發生與單端孢霉烯族毒素含量高度相關[3]。該毒素主要由鐮刀菌(Fusarium)產生, 基本結構為四環倍半萜,典型特征是C9與C10處具有化學雙鍵,C12與C13處具有環氧化物[4]。根據其化學結構中取代基的不同,可分為A、B、C、D 4 種類型,其中B型單端孢霉烯族毒素是污染最為普遍的一種鐮刀菌毒素[5]。
脫氧雪腐鐮刀菌烯醇(deoxynivalenol,DON)屬于B型單端孢霉烯族毒素,其化學名稱為3α,7α,15α-三羥基-12,12-環氧單端孢霉-9-烯-8-酮,C8位置上有羰基[6],最早由日本學者Morooka等[7]于20世紀70年代在受鐮刀菌感染的小麥等農作物中被發現并鑒定。DON理化性質穩定,在谷物磨粉、食品生產及日常食物烹調加工過程中均難以被破壞,還可在食物鏈中長期富集,因此DON會對人和動物產生廣泛且明顯的毒性效應[8]。研究表明,攝食被DON毒素污染的食物或飼料會引起生物體胃腸道和免疫系統功能損傷,誘發內分泌系統和神經系統的病變,對人類和動物健康造成極大的威脅。急性DON中毒癥狀主要表現為腹部不適,如惡心、嘔吐、腹瀉等,嚴重時甚至可能損害造血系統以致死亡;而長期低劑量接觸可引起厭食癥、生長遲緩、免疫失調、生殖和發育障礙等[9-10]。另外,DON及其衍生物還可以和其他真菌毒素如玉米赤烯酮等產生協同效應,加劇動物肝、腎臟細胞膜損傷和氧化損傷[11]。
DON可通過乙酰化、氧化、脫環氧化或糖基化反應降解成各種衍生物,這些衍生物又稱掩蔽型DON,包括3-乙酰基-DON(3-acetyldeoxynivalenol,3-AcDON)、15-乙烯基-DON(15-acetyldeoxynivalenol,15-AcDON)、脫環氧DON(deepoxy-deoxynivalenol,DOM-1)、DON-3-葡萄糖苷(DON-3-glucoside,DON-3-Glc)和DON-3-O-葡萄糖醛酸(DON-3-glucuronide,DON-3-GlcA)等[12-16],其基本信息見圖1。有研究表明,DON的各種衍生化產物對禾谷類農作物同樣具有極強的污染性,15-AcDON是引起全球赤霉菌病的主要化學型[17]。盡管這些衍生物的毒性比DON本身低[18],但在目前的研究中也已將3-AcDON、15-AcDON、DOM-1和DON-3-Glc等衍生物共同視為DON檢測項目中的靶標化合物[19-20]。 因此,尋找快速、靈敏和準確的檢測技術以分析食品、飼料、人和動物體中DON及其衍生物的含量,對于暴露風險評估以及人們的飲食健康都具有十分重要的意義。本文綜述了DON及其衍生物檢測的常見技術,總結和比較了不同方法的原理及優缺點,并介紹了具有良好應用潛力的新興方法,此外還討論了與樣品制備有關的實驗細節,包括目標物的提取和凈化,以期為DON及其衍生物檢測方法的科學選擇提供參考。

圖1 DON及其衍生物的化學結構Fig.1 Chemical structures of DON and its derivatives
1 DON及其衍生物的提取與凈化
1.1 提取
DON及其衍生物屬極性化合物,通常選用極性溶劑如甲醇、乙醇、乙腈、水或極性溶劑的混合體系進行提取。溶劑體系中各溶劑的比例由DON的理化特性及所選的檢測系統決定,DON提取常用的溶劑為乙腈-水的混合體系[17,21-22]。有研究報道,對于谷物樣品,含0.1%甲酸-水/乙腈(43∶57,V/V)的萃取體系可以更好地回收DON[23];而對于血漿等樣品,以一定比例的甲醇-水作為提取溶劑,回收效果更佳,回收率高達80%[24]。提取溶劑的用量一般按照樣品質量的4 倍進行添加。樣品加入提取溶劑后要通過機械振蕩或漩渦充分混勻;而對于其他生物樣品,尤其是尿液,由于樣品中的葡萄糖醛酸化程度高,提取液中還需添加β-葡萄糖苷酶,然后再進行混勻。對于提取次數的確定,有研究比較了一次提取和多次提取的回收率,發現二次提取DON的回收率顯著高于一次提取[25]。
1.2 凈化
經溶劑提取后,DON及其衍生物還需要進一步的凈化后再進行定性定量分析,目的是減少雜質對目標物的干擾。傳統的液液萃取(liquid-liquid extraction,LLE)技術利用液體混合物中各組分在兩相中溶解度的差異實現提取凈化。根據相似相溶原理,乙腈/正己烷或甲醇/正己烷體系是常見的DON及其衍生物的萃取溶劑,可去除脂肪和蛋白質等雜質。LLE技術具有操作簡單、易于實現等特點,但存在有機溶劑用量大、耗時、非特異性、目標物易流失、不能滿足高通量檢測需求等問題。隨著凈化技術的發展,固相萃取(solid-phase extraction,SPE)、多功能柱(multifunctional column,MFC)、免疫親和柱(immunoaffinity colums,IAC)等被廣泛應用于DON等真菌毒素的凈化[26]。SPE技術基于液相色譜(liquid chromatography,LC)-固相色譜分離原理,目標物首先被吸附到合適的固體吸附劑上,然后通過淋洗使目標物與干擾組分分離,最后以合適的洗脫劑將目標物從固體吸附劑上解離下來,從而達到凈化與富集目標物的目的。SPE技術具有操作簡單、有機溶劑用量少、適用于多殘留分析等優點,目前用于DON及其衍生物凈化的SPE柱主要有硅膠柱、florisil柱、C8或C18反相SPE柱、離子交換柱等[17,27-31]。MFC是一種特殊的SPE柱,它以極性、非極性及離子交換樹脂等作為復合吸附填料,基于多重吸附機制,快速且有選擇性地吸附樣品中的色素、脂類和蛋白質等雜質,而不吸附待測目標物,從而使樣品得以凈化。研究表明,MFC凈化過程操作簡單 快速,凈化效果較好,尤其適用于谷物中DON及其衍生物的同步分析[32-33]。Berthiller等[34]檢測了自然感染和人工接種感染赤霉病小麥中DON及DON-3-Glc的含量,樣品提取溶液采用MFC柱凈化,定容后再經0.45 μm濾膜過濾,該方法在DON-3-Glc加標0.15~1.20 mg/L時,回收率范圍為57.9%~64.1%,平均回收率為(60±8)%。DON及其衍生物采用MFC法凈化時,還可選用兩種商品化柱,分別是Multisep?和Mycosep?,這兩種柱子的凈化原理都是基于填料吸附干擾組分而使目標物通過固相柱。IAC技術即利用免疫反應的高度特異性,以抗原或抗體一方作為親和配基吸附另一方,從而使樣品得到凈化的分離體系[35]。Kostelanska等[36]采用專效凈化DON的IAC柱(DONPREPTM)對啤酒樣品進行凈化處理,結果顯示該IAC柱能夠同時分離DON、DON-3-Glc和3-AcDON,且回收率較高。但是,DON及其衍生物的相對分子質量較小,屬弱免疫物質,容易出現交叉反應,因此目前可供選擇的商品化IAC種類十分有限[21,37],且IAC柱的價格也相對偏高,使其在實際應用中會受到一定的限制。
此外,有研究報道分子印跡聚合物(molecularly imprinted polymers,MIP)和免疫超濾(immune ultrafiltration,IUF)凈化技術在DON檢測中也顯示出巨大的潛力。MIP通過引入目標物模板分子進行聚合,再對模板分子進行洗脫,這樣會在聚合物中留下模板分子空穴結構和大小的“印跡”,這種“印跡”結構能夠特異性識別目標物及其結構類似物[38]。因此,MIP具有較好的構效預定性和選擇性,并且耐高溫、酸堿和有機溶劑。與IAC技術相比,MIP方法更便宜、高效。在IUF方法中,超濾膜裝置中膜的孔徑足夠小,可以保留抗體。具體操作過程是萃取混合液通過超濾膜,目標組分即與抗體相結合,然后淋洗去除未被結合的干擾組分,再通過添加有機修飾劑將抗原抗體復合物解離開,最后經離心將目標物質洗脫下來[39]。相較于IAC技術,IUF不需要固體支撐材料,使用起來更方便,同時它的高選擇性可與IAC相媲美。
2 DON及其衍生物的檢測方法
目前,對DON及其衍生物的檢測技術主要包括免疫法、光譜法、色譜法和質譜法等,這些技術又可進一步分為快速檢測和確證檢測兩類。快速檢測主要用于現場快速篩查和半定量分析,而確證檢測則用于定性定量分析和實驗室仲裁檢測。兩類檢測方法互為補充,為防范DON毒素安全風險提供一定技術支撐。
2.1 快速篩查方法
2.1.1 薄層色譜法薄層色譜法(thin layer chromatography,TLC)是較早 應用于真菌毒素檢測分析的常規方法之一,主要原理是通過觀察毒素在紫外光線照射下產生藍紫色熒光的強弱和斑點大小來判定毒素的種類和含量[40]。Makun等[41]采用TLC法分離鑒定大米中DON,方法檢出限為 100 μg/kg,且分離效果良好。TLC方法簡單,但存在試劑用量大、前處理繁瑣、重現性差、檢出限高等缺點,很難滿足現代食品檢測高準確度、高靈敏度、高自動化的要求,在DON檢測研究中也已很少單獨使用TLC方法。但隨著科學技術的不斷發展,TLC與其他分離技術手段如高效液相色譜(high performance liquid chromatography, HPLC)法的聯合使用使得TCL法在DON檢測方面仍有一定的應用前景[42]。
2.1.2 免疫分析法
2.1.2.1 酶聯免疫吸附測定法
酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)法是目前檢測DON等真菌毒素最常用的免疫學分析策略。在實際應用中,根據標本性狀和試劑來源以及檢測條件,可設計出不同類型的檢測方法,主要包括雙抗體夾心法、競爭法和間接法。DON等真菌毒素屬于小分子物質,一次只能結合一個抗體,故一般采取競爭檢測模式。目前有多種專門針對食品及飼料中DON檢測的商品化ELISA試劑盒,這些ELISA試劑盒的靶標物質還包括3-AcDON、15-AcDON、脫環氧DON (DOM-1)和DON-3-葡萄糖苷等衍生物[43-44]。韓麗等[45]研制了一種自主組裝的間接競爭ELISA試劑盒,用于飼料中DON的檢測,該試劑盒對DON的最低檢測質量濃度為1.147 ng/mL,檢測范圍為1.50~130.31 ng/mL,測定結果與HPLC法結果一致。ELISA方法快速、靈敏、方便,在日常檢測中被廣泛使用,但它存在易發生交叉反應、結果假陽性率高、基質效應嚴重等缺點,通常需要配合使用其他分析方法以驗證結果。
2.1.2.2 時間分辨熒光免疫分析法
時間分辨熒光免疫分析法(time-resolved fluoroimmunoassay,TRFIA)是在熒光免疫分析基礎上發展起來的一種非放射性標記免疫分析技術,與傳統的熒光素標記不同,它以釤(Sm)、鈮(Nd)等三價稀土離子鑭系元素為標記物代替熒光物質、化學發光物、酶、同位素,標記抗原、抗體、核酸探針等。這些離子可產生熒光,其熒光不僅強度高,且熒光衰變時間長,通過延長測量時間,待樣品中壽命短的自然熒光衰變后再用TRFIA技術檢測,可消除自然熒光的干擾。TRFIA技術在食品安全領域的應用研究也已逐漸展開,在DON等真菌毒素等分析中相繼建立起來,與傳統的ELISA相比,它具有良好的線性范圍和較低的基質效應。Zhang Jue等[46]采用TRFIA法測定谷物中的DON,結果表明使用Sm3+標記的抗體比其他熒光染料標記的抗體更穩定,發射光譜更窄,DON的檢出限為0.194 μg/kg。TRFIA的熒光信號強、靈敏度高、穩定性好、選擇性強,同時它還不具有放射性,安全系數高,是一種很有應用前景的技術。
2.1.2.3 側向免疫分析法
側向免疫分析(lateral flow immunoassay,LFI)法是在免疫滲透技術基礎上建立的固相標記分析技術,其結合了免疫技術和色譜層析技術的優點。LFI的物化形式是免疫層析試紙條,其核心部分由樣品墊、結合墊、反應墊、支撐墊和吸水墊5 個部分組成(圖2)。LFI法以條狀纖維素膜為固相載體,借助毛細管的吸附作用使樣品在層析材料上移動,當流經檢測帶和控制帶時,抗原、抗體和指示探針會發生一系列反應,通過肉眼觀察和儀器測定進行定性和定量分析[47]。目前應用于真菌毒素等小分子目標物檢測的LFI主要基于競爭免疫反應模式,基本原理是固定化抗原/抗體與待檢樣品溶液中的目標分析物之間存在競爭關系,共同競爭抗體/抗原與標記物形成的指示探針。樣品滴加到樣品墊時,樣品溶液通過毛細管作用流經層析條帶,如果樣品中含有目標分析物,則其會與指示探針結合后形成分析物-指示探針復合物,此時檢測帶上所能捕獲的探針量就少,檢測帶不可見,結果呈陽性;如果樣品溶液中不存在目標分析物或其含量低于檢測范圍,所有的指示探針都會與檢測帶相結合,而多余的指示探針會繼續流過膜與控制帶相結合,檢測帶與控制帶均可見,此時的結果呈陰性。Yu Songcheng等[48]通過制備抗體-納米-Au顆粒及DON-牛血清白蛋白復合物以建立基于競爭免疫原理的LFI法,用于檢測谷物中的DON,該方法重復性和穩定性良好,視覺檢出限低至10 ng/kg。LFI法具有直觀、成本低廉、顯色迅速、適用于現場大規模初步篩選等優點,但檢測靈敏度較低、結果易誤判、難以定量、易受環境影響等缺點一定程度上限制了LFI的推廣應用。

圖2 側向層析試紙反應模板[47]Fig.2 Reaction template for lateral flow test strip[47]
2.1.2.4 其他新興免疫分析法
免疫芯片是基于蛋白質微陣列和免疫反應原理開發的一種特殊蛋白芯片,芯片上的探針點陣通過特異性免疫反應捕獲樣品中的靶標蛋白,然后用專用激光掃描系統和軟件對其進行圖像掃描、分析及結果解釋。Wang Ying等[49]采用免疫芯片法同時檢測了包括DON在內的12 種不同的真菌毒素,其中DON的檢出限為15.45 ng/mL。免疫芯片技術具有高通量、自動化、靈敏度高和能夠多元分析等 優點,特別適合用于多種DON毒素的同時分析。多重分析(multi-analyte profiling,ΧMAP)是一種基于流式細胞儀、ELISA和微陣列原理開發的一種新型檢測技術,具有低敏感性和可重復性等優點。ΧMAP技術將一種用特殊顏色編碼的微球懸浮液陣列與專用流式細胞儀結合在一起,實現在一個孔中使用很小的樣品量即可完成不同目標物的同時測定。Peters等[50]利用抑制免疫原理,將DON-牛血清白蛋白偶聯到羧化順磁微球上以對DON進行ΧMAP分析,方法的檢出限低于500 μg/kg,該結果得到液相色譜-串聯質譜(LC-tandem mass spectra,LC-MS/MS) 的驗證,同時在測定過程中未觀察到交叉反應。平面波導(planar waveguide,PWG)是一種基于間接競爭免疫測定原理的篩選方法,通過光在波導中的傳播,測定與生物芯片表面結合的抗原抗體復合物中的標記抗體的熒光。近年來PWG也被用作同時分析多種真菌毒素,如在Tittlemier等[51]的研究中,采用PWG系統檢測到的DON檢出限約為400 μg/kg。然而,對于DON含量范圍在1 250~2 000 μg/kg的小麥樣品,該PWG系統檢測的結果僅為GC-MS測定值的71%。PWG與其他分析技術相比,靈敏度較低。
2.1.3 生物傳感器法
2.1.3.1 表面等離子體共振法
表面等離子體共振(surface plasmon resonance,SPR)是一種光學物理現象,一束P偏振光在一定的角度范圍內(入射角大于臨界角)入射到棱鏡端面,在棱鏡與金屬膜表面上發生全反射現象,所形成消逝波進入光疏介質中,并引發金屬薄膜中的自由電子形成表面等離子體。表面等離子的集體振蕩能夠產生一種沿著界面傳播的橫向電磁波,即表面等離子波。當消逝波的波矢量與表面等離子波的波矢量相等時,引起金屬膜內自由電子產生共振,即SPR。當發生SPR時,檢測到的反射光強會大幅度減弱。此時,光子轉移到表面等離子,入射光的大部分能量被表面等離子吸收,使反射光的能量急劇減少,其中反射光完全消失的角就是SPR角。SPR角隨著金屬薄膜表面折射率的改變而改變,任何附著在金屬薄膜表面物質的量、構型發生改變時均可被檢測出來[52],其原理圖見圖3。SPR作為一種敏感的表面分析技術,通常被認為是不使用任何人工標記試劑的生物傳感器。SPR生物傳感器將探針或配體固定于金屬薄膜(傳感芯片)表面,含目標分析物的測試樣品流經金屬薄膜表面,分子間會發生特異性結合反應從而改變膜表面的折射率,并通過放大反射光微小角度的變化響應以得到分析結果[52]。Hossain等[53]基于競爭免疫原理建立了納米金增強多重成像SPR方法,用于檢測小麥中DON,該方法檢出限為15 μg/kg。Wei Tao等[54]使用自組裝單層膜傳感器芯片建立了SPR方法,用于檢測小麥和玉米中的 DON,該方法不易發生交叉反應,線性范圍良好,特異性較強,最低檢出限為3.26 ng/mL。SPR方法快速、靈敏,但測定結果易受溫度波動和基質效應的影響,穩定性較差。

圖3 SPR傳感器原理圖[52]Fig.3 Schematic diagram of surface plasmon resonance sensor[52]
2.1.3.2 生物膜層干涉法
生物膜層干涉法(biolayer interometry,BLI)是基于光干涉原理的非標記技術,具有操作簡單、無損檢測、樣品消耗量少、實時結果輸出等優點。與SPR的原理類似,BLI需要將目標分析物結合在生物傳感器末端形成一層生物膜,區別在于BLI通過實時監測光的干涉信號變化來實現目標物的相互作用分析或檢測[55]。關于小麥粉中DON的BLI分析結果表明,檢測過程在7 min即可完成,測定的DON的檢出限為100 μg/kg[56]。Maragos等[57]采用抗體-膠體金偶聯物建立的BLI方法可將DON的檢出限降低至90 μg/kg,測定時間縮短至6 min,結果得到HPLC法的驗證。與SPR方法類似,BLI同樣存在對溫度波動敏感的問題,容易出現假陽性或陰性結果。
2.1.4 光譜分析方法
2.1.4.1 高光譜成像技術
高光譜成像技術(hyperspectral imaging,HSI)是基于非常多窄波段的影像數據技術,具有豐富的吸收譜帶,在識別樣品外部特征信息的同時,可獲得反映樣品內部物理結構和化學成分的光譜信息,并將圖譜合二為一。HSI最大的特點是能夠對幾十個乃至幾百個窄波段進行連續的光譜覆蓋,同時光譜分辨率高、操作方便。典型的HSI系統由硬件和軟件組成(圖4),硬件主要包括提供照明的光源、檢測器(可同時獲得光譜和空間信息)、高光譜儀(用于分散反射、透射或散射光的波長,并將信號傳送到檢測器的感光表面)、物鏡(調整光的采集范圍)、載物臺以及計算機。成像原理為激發光源模塊產生線光源,照射到待測樣品后產生漫反射光,利用高信噪比的高光譜儀將產生的光轉換成光譜,并將其形成圖像,由攝像機統一接受并傳輸到計算機中,獲得可以指示食品樣品中物理性質和化學成分的高光譜圖像。HSI具有非破壞性、操作簡便、快速且重復性好等特點,能實現實時在線檢測,目前主要應用于農產品內外部品質的檢測,近年來也有應用于DON等真菌毒素檢測的報道。如Liang Kun等[58]通過可 見-近紅外(visible near-infrared,Vis-NIR)和短波近紅外(short-wave infrared,SWIR)兩個高光譜成像系統分別采集96 個小麥籽粒和小麥粉的圖像,經多元散射校正(mutiplicative scatter correction,MSC)和標準正態變量變換(standard normal variate,SNV)兩種方法對光譜數據進行預處理后,再分別運用基于支持向量機和稀疏自動編碼(sparse auto-encoder,SAE)網絡的算法建立模型用于預測樣品中DON的含量水平,結果表明,對于小麥籽粒樣品,Vis-NIR-MSC-SAE模型預測性能更高;對于小麥粉樣品,SWIR-SNV-SAE模型的預測性能更高。
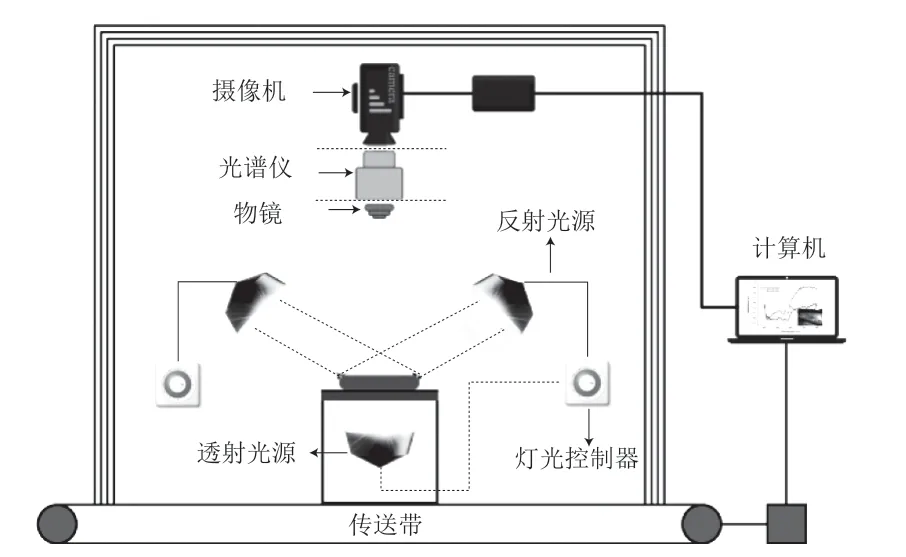
圖4 高光譜成像系統的結構[59]Fig.4 Configuration of a hyperspectral imaging[59]
2.1.4.2 表面增強拉曼光譜技術
拉曼光譜是一種能夠表征分子振動能級的光譜,其拉曼效應來源于分子振動與轉動,能夠對物質的組成和結構進行無創分析,具有極高的分子特異性。但是,傳統拉曼光譜散射強度較弱,易受熒光干擾,檢測靈敏度低,限制了其應用范圍。而表面增強拉曼光譜(surfaceenhanced Raman spectroscopy,SERS)是利用光與金、銀等納米結構材料相互作用產生很強的表面等離子基元共振效應,可顯著增強吸附在納米結構表面上分子的拉曼信號,以超靈敏地獲取樣品自身或拉曼探針分子的指紋圖譜。通常情況下,SERS增強因子的平均值約為106,在等離子體間隙和尖銳突起的位置,局域增強因子可高達1014,彌補了傳統拉曼光譜檢測靈敏度低的不足,是一種極具潛力的快速檢測技術,具有無損、快速、高靈敏度和高選擇性等優勢。目前,SERS技術在其檢測中的應用,主要是以抗原-抗體間的免疫反應為基礎,因此其基底制備是影響SERS信號增強效果的一個重要因素。基于貴金屬銀(Ag)、金(Au)的納米顆粒或納米陣列是常用的SERS基底,具有高增強、高均一性等優點。Tegegne等[60]制備了涂有聚多巴胺(polydopamine,PDA)的納米銀基底,用于檢測飼料中DON含量,研究結果表明具有超薄PDA外殼的Ag NCs@PDA基底通過氫鍵和π-π堆積相互作用增強了DON的吸收,并提高了基底的穩定性,SERS增強因子可達1.82×107,方法檢出限為0.243 pg/L。
2.2 基于色譜或質譜的定性定量分析方法
2.2.1 高效液相色譜法
HPLC法適用于高沸點、不易揮發、受熱不穩定易分解、不同極性的有機化合物的分析。鑒于DON分子的理化特性,HPLC法同樣適用于谷物、血漿、組織液等樣品基質中的DON及其衍生物的檢測分析[61-63]。HPLC通常與紫外-可見檢測器(ultraviolet-visible detector,UV)、二極管陣列檢測器(diode array detector,DAD)、熒光檢測器(fluorescence detector,FD)、火焰離子化檢測器或電子捕獲檢測器(electron capture detector,ECD)等相結合,以檢測和分析目標物。HPLC-UV法是檢測DON等真菌毒素最常用的液相分析方法[64]。Klinglmayr等[65]采用HPLC-UV法在220 nm波長處檢測小麥制品和飼料樣品中的DON,該方法檢出限和定量限分別為200 μg/kg和380 μg/kg。Rahmani等[66]基于空氣輔助分散液-液微萃取前處理技術建立了檢測大米中DON的HPLC-DAD法,該方法線性范圍為50~500 μg/kg,檢出限為23.6 μg/kg。Ok等[67]采用IAC對大米及米糠中的DON和雪腐鐮刀菌烯醇(nivalenol,NIV)進行凈化處理,并利用HPLC-UV法對其含量進行測定,該方法線性關系良好,DON和NIV的定量限均小于11.09 μg/kg。Zhang Yingyue等[68]建立并優化了同時基于DAD和FD檢測的multi-IAC-HPLC法,并對全麥粉和精致小麥粉中DON及其衍生物等9 種真菌毒素進行分析測定,該方法的回收率為75.78%~118.24%,檢出限和定量限分別為1.5~20 μg/kg和5.0~60 μg/kg。HPLC技術具有靈敏度高、選擇性好、重復性可靠、操作自動化、能同時對多種真菌毒素進行定性定量分析等優點,但儀器價格昴貴,待測樣品通常需要經凈化處理后再進系統分析。
2.2.2 氣相色譜或氣相色譜-質譜聯用法
DON的沸點為543.88 ℃,不易汽化,因此不能直接采用GC或GC-MS法檢測,而需要先經過衍生化處理使其沸點降低、熱穩定性提高。DON化學結構為四環倍半萜烯,其環有3 個羥基,易形成穩定的氫鍵,不易揮發,一般選用衍生劑或酰化劑對這3 個羥基進行甲基硅烷化或氟酰化處理。硅烷化試劑包括N,O-雙(三甲基硅基)乙酰胺、三甲基氯硅烷、N-三甲基硅咪唑、三甲基 硅基[27,69];酰化試劑包含三氟乙酸酐、五氟丙酸酐、七氟丁基咪唑[70-72]。在利用GC分析DON等毒素含量時,常見的檢測器為ECD及質譜檢測器。張正煒等[73]建立了一種GC-ECD法,用于分析小麥粉中DON毒素殘留,該方法 線性范圍為0.01~1.00 mg/L,最低檢測劑量為0.01 mg/kg。 王婭琴等[74]建立了SPE-GC-MS檢測醬油中DON的分析方法,DON的線性范圍為0.025~8.000 μg/mL,檢出限和定量限分別為5 ng/mL和16.67 ng/mL。Cunha等[31]采用 GC-MS/13C同位素標記法對人體尿液中的DON、DOM-1、3-AcDON和15-AcDON進行了分析測定,以上目標分析物的檢出限分別為0.25、0.50、1.00 ng/mL和0.2 ng/mL。Jeleń等[75]建立了全二維氣相色譜飛行時間質譜法對小麥中的DON及其衍生物進行分析,DON和3-AcDON的檢出限分別為25 μg/kg和50 μg/kg。GC-MS或GC-MS/MS技術具有分析速度快、靈敏度高等優點,但由于樣品需要凈化和衍生化的處理,使得該方法操作起來比較復雜。
2.2.3 液相色譜-質譜或液相色譜-串聯質譜聯用法
LC-MS以LC作為分離系統,質譜為檢測系統,樣品在檢測系統和流動相分離,被離子化后,經檢測系統的質量分析器將離子碎片按照質量數分開,最終檢測器得到質譜圖。LC-MS或LC-MS/MS的靈敏度高、選擇性強,分析確證高度可靠,可同時檢測樣品中的包括DON及其衍生物在內的多種真菌毒素。與GC-MS不同,待測樣品用LC-MS分析時不需要衍生化。電噴霧電離(electrospray ionization,ESI)和大氣壓化學電離均可作為檢測DON及其衍生物分析的電離源。大多數關于DON定量分析的LC-MS方法通常選擇ESI作為電離源,但其容易受樣品基質效應干擾而產生離子抑制或增強現象[31]。基質效應是電離過程中樣品基質里其他分子對目標分析物的干擾,它會影響目標分析物的檢測靈敏度和定量準確性。利用LC-MS/MS法測定DON毒素時,通過添加內標物質(例如同位素標記的分析物)、使用基質匹配校準曲線、樣品凈化處理等手段可有效消除或降低基質效應。在確定流動相方面,研究發現DON在甲醇溶液中具有更高的響應值,因此通常選擇含5~10 mmol/L乙酸銨的甲醇作為有機相[30,76-77];對于水相,通常使用含有與有機相相同揮發性鹽的超純水。Broekaert等[78]采用LC-MS/MS法檢測分析了雞和豬血漿中DON、DOM-1、3-AcDON及15-AcDON的殘留情況,4 種毒素的檢出限為0.01~0.70 ng/mL,定量限為0.1~2.0 ng/mL。吳琴燕等[79]建立的超高效液相色譜-串聯質譜方法可同時檢測麥粒中的DON、3-AcDON、15-AcDON及NIV,4 種毒素檢出限為2.06~13.36 μg/L。Zhao Zhiyong等[80]建立 HPLC-MS/MS法測定飼料中DON、NIV、DOM-1、3-AcDON、15-AcDON及鐮刀菌烯酮Χ含量,并采用改進的分散SPE法凈化樣品,以上6 種毒素的定量限范圍為5.0~13.6 μg/kg。 Stastny等[81]建立超高效液相色譜質譜聯用方法檢測分析豬的初乳和血清中DON及DOM-1的殘留情況,并采用親水親油平衡小柱凈化樣品,初乳中DON和DOM-1的檢出限分別為0.48 μg/L和0.54 μg/L,定量限分別為0.80 μg/L 和0.89 μg/L;血清中DON和DOM-1的檢出限分別為0.24 μg/L和0.36 μg/L,定量限分別為0.39 μg/L和0.60 μg/L。 LC-MS法通常要求樣品凈化后再上樣,以避免色譜柱的堵塞,但也有文獻報道了無需樣品凈化的LC-MS/MS法,這在同時檢測多種DON毒素時表現出很強的實用性。如Warth等[82]采用HPLC-四極桿/線性離子阱質譜法檢測人尿中的DON和DON-3-O-GlcA,并確定DON-3-O-GlcA 的定量限高于30 ng/mL,該方法不需要凈化處理。盡管LC-MS儀和LC-MS/MS儀價格昴貴,容易受基質效應的影響,但鑒于其具有出色的靈敏度和良好可重復性,目前已成為檢測DON及其衍生物的最佳選擇之一。
3 結 語
DON及其衍生物的危害性和廣泛分布的特點會對人類健康、食品安全和國際貿易產生嚴重的影響。因此,在加強監管的前提下,開發針對DON及其衍生物的定性定量分析方法顯得至關重要。本文綜述了當前應用于DON及其衍生物檢測的主要分析技術,并對其優缺點進行了分析,所提供的信息有助于研究人員在實際應用中根據分析目的、樣品性質及環境條件選擇適宜的方法。此外,隨著學科的交叉融合和各種檢測手段的發展以及檢測要求的不斷提高,DON及其衍生物的檢測技術發展趨勢應具有如下特點:1)快速檢測技術依然是現場實地監控DON及其衍生物的有效技術手段。基于免疫分析法的快速檢測技術離不開高靈敏、高特異性的抗體,因此通過研發更高水平的特異性抗體能顯著提高免疫分析法的檢測速度并擴大其應用范圍;而針對其他快速檢測技術存在的成本較高、便攜性較差、無法精確定量等問題,也需要對其方法進行積極改進,開發各種新型的、適合現場篩查的便攜式小型設備,以期滿足DON毒素的快速檢測需求。2)從檢測某種DON毒素向同時檢測多種DON毒素發展。隨著對DON衍生物研究的深入,人們發現樣品基質中DON衍生物往往與原型同時存在,有些甚至比原型毒素的毒性作用更大,如何方便、快速、準確、高通量地檢測出該多種毒素的種類及含量依舊是當下和未來的研究重點。3)開發精準高效的DON及其衍生物的實時在線監測技術。光譜檢測技術是基于DON及其衍生物污染樣品的光譜特征,對樣品中DON毒素進行準確定量,實現樣品的實時無損在線監測,是DON毒素檢測技術的發展趨勢。

