水質分析中檢測數據的合理性探究
魯海平
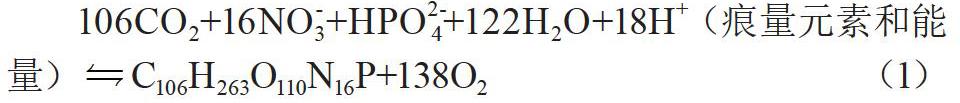

摘 要:在水質分析數據的基礎上,剖析天然水中的主要離子成分、離子含量、數據間的聯系與制約關系等。由于地質、生態環境、化學平衡等因素反映了水化學成因及內在關系,探究水質分析數據內在的規律,有利于在水質分析中控制質量,發現和糾正水質分析中數據的不合理之處。
關鍵詞:水質分析;化學特征;質量控制
水體中的各種離子處于相互聯系、相互制約的平衡狀態,任何一種平衡因素的變化,必使原有的平衡發生改變,形成一種新的平衡。結合水質分析的實踐數據,剖析天然水中的主要離子成分、離子含量、數據間的關系,探究地質、生態環境、化學平衡等因素反映水化學特征的內在規律性,發現和糾正水質分析中數據的不合理性,彌補質量控制的不足。
1?天然水化學特征
1.1? 水中的主要離子成分
天然水中的主要離子成分為Cl-、SO2-4、HCO-3、NO-3、Na+、K+、Ca2+、Mg2+,占天然水中離子總量的95%~99%。
Cl-在低礦化水中的質量濃度為數毫克/升到數十毫克/升,但在高礦化水中可達數克/升甚至超過100 g/L。SO2-4在低礦化水中的質量濃度僅為數毫克/升到數百毫克/升,在高礦化水中的質量濃度可達數克/升,一般為中等礦化水的主要陰離子。HCO-3一般為低礦化水的主要陰離子,質量濃度一般為數百毫克/升。Na+在低礦化水中的質量濃度一般很低,僅為數毫克/升到數十毫克/升,但在高礦化水中是主要離子,質量濃度高達數十克/升。
K+與Na+在地殼中的豐度相近,化學性質相似。但在天然水中,K+的質量濃度一般遠低于Na+。在Na+的質量濃度低于10 mg/L的淡水中,K+和Na+的質量比在0.1~0.5,隨著水中含鹽量的增加,K+和Na+的質量比降至0.04~0.10,如海水中K+和Na+的質量比為0.036[1]。因此,水中K+的質量濃度遠低于Na+,一方面是因為K+容易被土壤膠體吸附,另一方面是因為K+會被植物吸收與固定。
Ca2+是低礦化水中的主要陽離子,質量濃度一般為數百毫克/升,主要來源于碳酸巖以及含石膏巖石的溶解。由于CaCl2的溶解度大,高礦化水中的鈣也可成為主要離子。
淡水中的Ca2+明顯多于Mg2+,這與地殼中鈣的豐度大于鎂有關,而在咸水中Mg2+的質量濃度一般大于Ca2+,因為鎂對碳酸鹽和硫酸鹽的溶解度比鈣高很多,鈣比鎂容易沉積。在大多數淡水中,Mg2+的質量濃度在1~40 mg/L。在礦化度低于1 000 mg/L的水中,Ca2+和Mg2+物質的量之比為6∶1~3∶1;當礦化度高于1 000 mg/L時,Ca2+和Mg2+物質的量之比降至3∶1~1∶1;當礦化度進一步提高時,Mg2+一般遠超于Ca2+,如海水中Ca2+和Mg2+的物質的量比值為0.2。
1.2? 水體中氮、磷的比例
水生生物在吸收利用氮和磷時,一般N和P物質的量之比為16∶1,藻類在水體中的光合作用和呼吸作用就是藻類生成和分解的過程[2]:
106CO2+16NO-3+HPO2-4+122H2O+18H+(痕量元素和能量)C106H263O110N16P+138O2(1)
在淡水分析中,N和P物質的量比值一般大于16,N/P比值可表征湖泊富營養化狀況,一般水體磷為富營養化限制性要素。水域中磷和氮的濃度常受季節性變化影響,冬季濃度較高,夏季濃度較低。
1.3? 海水的化學特征
海水中主要離子質量濃度的大小關系為:Cl->Na+> SO2-4>Mg2+>Ca2+>K+>HCO-3>Br-,海水中的有機碳質量濃度一般為0.1~2.7 mg/L。河水中主要離子質量濃度的大小順序與海水相反:Ca2+>Mg2+>Na+,HCO-3>SO2-4>Cl-,河水中有機碳的質量濃度一般在10~30 mg/L。根據水質組分因子可判斷水質成分,如利用Mg/Ca因子判斷海水入侵的范圍和程度,因海水中鎂的質量濃度比鈣高得多,一般淡水達不到此高值;或利用Cl/Br海水特征因子,氯和溴在海水中同時存在,但在淡水中溴的質量濃度甚微。
海水中主要成分的質量濃度幾乎是恒定的,只是鹽分質量濃度總值不同,被稱為“Marcet原理”。但在河口區,由于淡水與海水的混合,海水組分比值不恒定,這與河水成分及兩者比例關系有關。
2?水質分析數據的合理性
2.1? 水中離子受溶度積平衡的限制
水中SO2-4的質量濃度取決于各類硫酸鹽的溶解度,尤其受Ca2+質量濃度的限制。當SO2-4的質量濃度較高時,將與Ca2+生成難溶鹽CaSO4;當水中Ca2+與SO2-4的物質的量相等并處于溶解平衡狀態時,SO2-4的質量濃度為480 mg/L,如果水中Ca2+的質量濃度較低,SO2-4的質量濃度就較高;反之則較低。海水中SO2-4的質量分數可達2.6 g/kg,但通常海水中并無硫酸鹽沉淀生成,主要是因為與某些金屬陽離子生成了絡合物和離子對,因此SO2-4在海水中的質量分數有所提高。
2.2? 水質中的電中性原理
大多數淡水中的主要離子有Ca2+、Mg2+、Na+、K+和? ? ? HCO-3、CO2-3、SO2-4、Cl-,可能還有較多的NO-3、NH+4或Fe3+等離子。從電中性原理考慮,以單位電荷的物質的量濃度表示,水中陰離子總量與陽離子總量相等,對于一般淡水有平衡式[見式(2)],但不適用于鹵水、嚴重污染水。
c(Na+)+c(K+)+c(Ca2+)+c(Mg2+)=c(HCO-3)+ c(CO2-3)+c(SO2-4)+c(Cl-)(2)
2.3? 電導率、TDS與離子總量的關系
天然水主要陽離子的摩爾電導大小關系為:K+>Ca2+>Mg2+>Na+,陰離子的摩爾電導大小關系為:SO2-4>? ? ?Cl->CO2-3>HCO-3。因此,對于同一類型淡水,當pH為5~9時,電導率同離子總量大致成比例關系,1 μS/cm電導率相當于0.55~0.90 mg/L離子總量[3]。
總溶解固體(TDS)計算公式為主要離子質量體積濃度之和,即:
K++Na++Ca2++Mg2++Fe3++Mn2++Cl-+SO2-4+NO-3+(60/122)HCO-3(3)
式中,Ca2+和HCO-3在蒸干過程中發生反應,部分HCO-3以CO2和H2O形式損失,計算式中HCO-3的量取60/122。
2.4? 硬度與鈣、鎂的關系
與水中硬度有關的金屬離子主要是Ca2+、Mg2+,其次是Fe3+、Mn2+、Al3+、Sr2+等,硬度(按CaCO3)一般按“(Ca2+/20.0+Mg2+/12.0+Fe3+/18.6+Mn2+/27.5)×50 mg/L”計算。
2.5? 碳酸平衡理論
天然水中的無機碳化合物和氣相中的CO2、固相的碳酸鹽存在一系列物理化學平衡體系,根據碳酸平衡理論,天然水中存在H2CO3-HCO-3-CO2-3平衡,天然水中的CaCO3懸浮物或沉積物對氫離子有消耗作用,Ca2+、Mg2+對CO2-3、OH-有沉淀限制作用,因此,天然水的pH常為6.5~8.5,碳酸平衡體系常以HCO-3為主。
3 水中氮、氯離子對環境的影響
若水中存在氮、氯元素化合物且含量較高,在一定程度上說明水體遭到了污染。
水中不同的含氮化合物在一定程度上反映了水體污染的不同階段,如水中氨氮含量高,說明水體被污染的時間不長;如水中硝酸鹽含量高,而亞硝酸鹽和氨氮含量極少,說明水體曾被污染過。但是,含氮化合物不完全來自有機物,有的來自無機物,如農藥氮肥等[4]。
Cl-是水體中最保守的成分,天然水中的Cl-含量也與TDS密切相關。水中Cl-含量之間的關系可反映水體的流動變化情況,Cl-含量高低也可反映水體的污染程度,一般水中的Cl-來自生活污水、工業廢水等人為污染,但在鹽堿地或沿海地區,Cl-含量升高也不能斷定水體遭到污染。
4?水質分析數據剖析
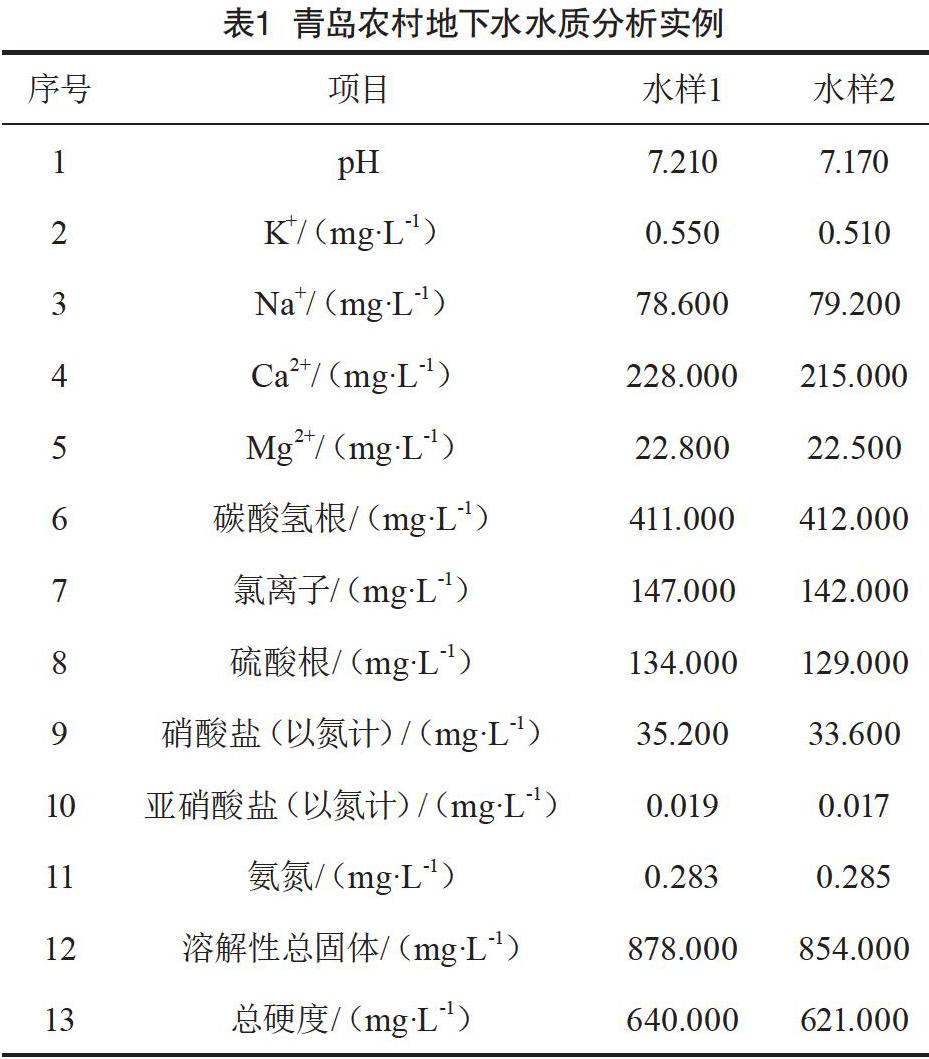
青島農村地下水水質分析結果如表1所示。
在該地下水中Ca2+明顯多于Mg2+,Ca2+與Mg2+的物質的量之比分別為6.0∶1.0和5.7∶1.0,Na+質量濃度明顯高于K+。根據水質分析質量控制誤差計算公式[5],兩個水樣的總硬度計算值和測定值的誤差分別為3.9%和1.7%,誤差小于10.0%;溶解性總固體計算值與測定值誤差分別為3.5%和3.6%,誤差小于10.0%;根據電中性原理,陰陽離子平衡誤差分別為2.0%和0.7%,誤差小于10.0%。兩個水樣CaSO4離子積分別為8.0×10-6和7.2×10-6,小于溶度積2.4×10-5,CaSO4呈未飽和溶解狀態。因此,利用水化學平衡理論等檢驗了實際水樣分析中數據的合理性。
5?結語
水中的各種離子處于相互聯系、相互制約的動態平衡,利用其內在規律性發現水質分析中的明顯誤差,控制和核對數據的準確性。研究水質數據內在規律性,具有廣闊的前景,有利于提高水質分析能力以及對水環境化學的認知水平,值得進一步探究。
[參考文獻]
[1]雷衍之.養殖水環境化學[M].北京:中國農業出版社,2003.
[2]戴樹桂.環境化學[M].北京:高等教育出版社,1995.
[3]陳佳榮.水化學[M].北京:中國農業出版社,1996.
[4]濮文虹,劉光虹,龔建宇.水質分析化學[M].武漢:華中科技大學出版社,2018.
[5]中華人民共和國衛生部,中國國家標準化管理委員會.生活飲用水標準檢驗方法 水質分析質量控制:GB/T 5750.3—2006[S].北京:中國標準出版社,2006.

