熒光PCR熔解曲線技術在結核病耐藥診斷中的應用價值
王 悅 孟湃喆 于艷紅▲
1.沈陽市第十人民醫院結核病實驗室,遼寧沈陽 110044;2.沈陽市醫學院醫學檢驗技術專業,遼寧沈陽 110034
結核病(tuberculosis,TB)位居全球單一致死性傳染病的首位,每年約有50 萬利福平耐藥病例,其中78%為耐多藥結核病(multidrug-resistant tuberculosis,MDR-TB)[1]。我國是全球耐藥結核病負擔最大的三個國家之一[2-3]。由于傳統的藥敏試驗方法費時、繁瑣,無法滿足快速臨床診斷的要求[4-5],許多快捷高效的分子技術已更多應用于TB 檢測,包括熒光PCR熔解曲線法、線性探針耐藥檢測法或DNA 微陣列等。熒光PCR熔解曲線技術特點是在擴增完成后增加了熔解曲線的分析過程,比較樣本與陽性對照間熔點差異(△Tm值)。該技術對rpoB基因與利福平耐藥相關81bp 進行突變檢測;對與異煙肼耐藥相關的ahpC啟動子、inhA94 密碼子、inhA啟動子以及katG315 密碼子的相關位點進行特異檢測。
1 材料與方法
1.1 材料
1.1.1 研究對象 回顧性分析2019年7月—2020年7月沈陽市第十人民醫院收取的254 例痰樣本檢驗結果,三項檢測為同一患者的同一樣本,排除標準為治療超過2 周的患者。以MGIT 960 藥敏試驗為參考標準,探討熔解曲線技術在結核病耐藥診斷中的應用價值,并采用線性探針耐藥檢測技術對不一致結果進行復檢。本研究經過沈陽市第十人民醫院醫學倫理委員會審核批準。
1.1.2 主要儀器及試劑 Bio-Rad CFX96 實時熒光PCR 擴增儀(Bio-Rad Laboratories);Lab-Aid 824 核酸提取儀、結核分枝桿菌利福平/異煙肼耐藥突變檢測試劑盒(廈門致善生物科技股份有限公司);MGIT 960 全自動結核分枝桿菌快速培養法儀及配套試劑(Becton,Dickinson and Company);全自動核酸印記微生物檢測系統(GTGBlot 48)及配套試劑(法國生物梅里埃股份有限公司)。
1.2 方法
收集254 例痰樣本檢驗結果,熔解曲線法與MGIT 960 藥敏試驗不一致的結果應用世衛組織推薦的線性探針耐藥檢測法進行復檢,三種方法如下。
MGIT960 藥敏試驗:痰標本前處理按照《結核病診斷實驗室檢驗規程》[6]規定進行,完成接種后,進行培養,儀器報陽后對培養物進行抗酸染色鏡檢確認,陽性者進入藥敏試驗。
熔解曲線法前處理:取培養法前處理液化完成的痰液1.5 mL,高速離心后棄上清并加入TB DNA 提取液重懸沉淀,滅活后進行核酸提取、配液、擴增等工作流程。檢驗結果是通過四個通道的樣品與陽性對照之間熔解曲線熔點(Tm)的差異判斷樣品是否發生突變,熔點均一致(誤差不超過1℃)時判定為野生型(敏感);四個通道中任意通道中樣品的熔點低于陽性對照2℃判定為突變型(耐藥)。
線性探針耐藥檢測法:標本處理按照法國生物梅里埃的試劑盒說明書進行,包括DNA 提取、擴增、雜交、制備流程。判讀標準為野生條帶均顯色且突變條帶無顯色時為敏感,野生條帶有缺失或突變條帶顯色為耐藥。
1.3 統計學方法
所有檢測結果、患者基本信息采用SPSS 19.0 統計軟件進行統計分析。以MGIT 960 藥敏試驗結果為參考標準,計算熔解曲線法檢測的敏感性、特異性、一致性、陽性預測值(positive predictive value,PPV)、陰性預測值(negative predictive value,NPV)和Kappa值以及對MDR-TB 結果的判定能力。敏感度=真陽性例數/(真陽性+假陰性)例數×100%;特異度=真陰性例數/(真陰性+假陽性)例數×100%;PPV=真陽性例數/(真陽性+假陽性)例數×100%;NPV=真陰性例數/(真陰性+假陰性)例數×100%;一致性=(真陽性+真陰性)/(真陽性+假陽性+真陰性+假陰性)例數×100%;Kappa值≥0.75 表示兩者一致性較好;0.4≤Kappa<0.75 表示兩者一致性一般;Kappa<0.4 表示兩者一致性較差。
2 結果
2.1 基本情況
收集的254 例患者信息顯示,初治患者166 人(65.4%);年齡18~88 歲,平均(52±14.6)歲;41~60年齡段人數為123 人(48.4%),男性199 人(78.3%)。
2.2 藥敏結果
在利福平藥敏試驗結果中,熔解曲線法的敏感性、特異性分別為89.6%、95.6%,Kappa值≥0.75,與參考標準一致性較好;兩種檢測技術共有14 例不一致。在異煙肼藥敏試驗結果中,熔解曲線法的敏感性、特異性分別為81.5%、98.9%,Kappa值≥0.75,與參考標準一致性較好;兩種檢測技術共有14 例不一致(表1)。

表1 熔解曲線法檢測利福平和異煙肼耐藥與MGIT 960 藥敏試驗結果的比較(例數)
2.3 應用線性探針耐藥檢測技術對不一致結果進行復檢
254 例藥敏結果中,熔解曲線共有28 例結果與參考標準不同。其中有17 例是熔解曲線法顯示敏感,而MGIT 960 藥敏試驗為耐藥,線性探針耐藥檢測復檢為12 例耐藥,5 例敏感;有11 例是熔解曲線法顯示耐藥,而MGIT 960 藥敏試驗為敏感,線性探針耐藥檢測復檢為3 例敏感,8 例耐藥。
2.4 熔解曲線法檢測MDR-TB 的效能
檢測所有病例MDR-TB 的能力與參考標準比較,熔解曲線法的敏感性、特異性分別為80.5%、95.8%,Kappa值為0.76,二者一致性較好。初治患者的敏感性和特異性均高于復治患者,其Kappa值為0.93,優于復治患者的0.60(表2)。
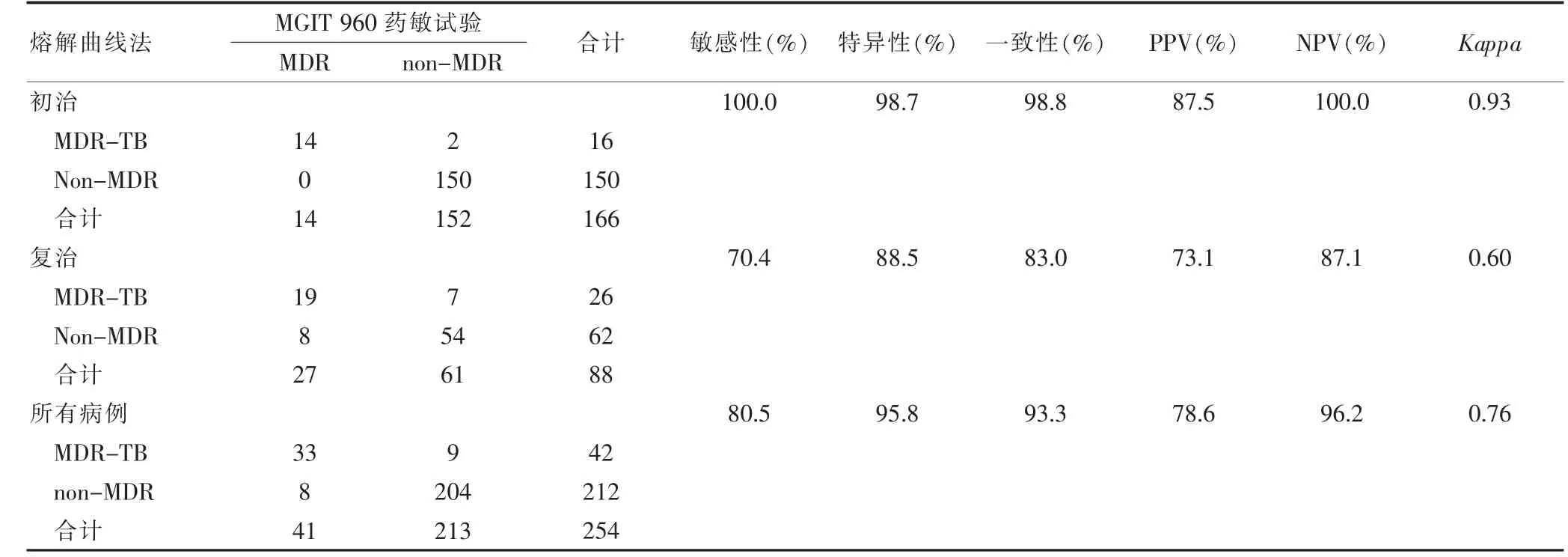
表2 熔解曲線法對不同治療史樣本患者MDR-TB 結果的判定(例數)
3 討論
與MGIT960 藥敏法比較,熒光PCR熔解曲線法對兩種藥物的耐藥檢測指標較好,但是異煙肼耐藥檢測的敏感性略低于利福平,可能是由于利福平耐藥突變的檢測限略高的原因。關于不一致結果的產生原因較復雜,MGIT 960 藥敏法耐藥而熔解曲線法敏感的可能原因:①分子法是針對特定突變位點的密碼子的檢測,不能覆蓋所有的突變位點;②耐藥機制除了位點突變還存在外排泵[7-8]等;③可能存在異質性耐藥[9],一般分子法的檢測限在20%左右,而培養法的檢測限可達到1%[10]。MGIT 960 藥敏法敏感而熔解曲線法檢測耐藥的可能原因:①體外培養可能導致耐藥菌亞群比例下降、低于培養法檢測靈敏度[11];②異質性耐藥或DNA 純度不夠,導致熔解曲線出現各種雜合峰或復雜曲線,受到儀器性能和人工判讀的影響較大[12];③可能與MGIT 960 藥敏法的利福平終濃度設置過高有關(培養管中的藥物終濃度為利福平1.0 μg/mL,異煙肼0.1 μg/mL);④分子藥敏檢測出rpoB基因511位點和inhA突變時,表型藥敏往往檢測結果為陰性[13]。參考《結核分枝桿菌耐藥性監測專家共識》[14]的建議,當分子藥敏試驗和表型藥敏試驗結果不一致時,需參考對不同抗結核藥品分子藥敏試驗檢測敏感度和特異度[15]。
應用線性探針耐藥技術對不一致結果的復檢顯示,在利福平耐藥檢測方面,線性探針更傾向于與參考標準一致,由于是對不一致結果進行復檢,不能以與參考標準結果符合度高更多而斷定線性探針方法優于熔解曲線法。我國對異煙肼耐藥的菌株中約有3%攜帶axyR-ahpC基因突變[16],與線性探針比較,是熔解曲線法的檢測優勢,所以復檢指標中線性探針與參考指標比較的符合度低于利福平。進一步研究發現,不一致結果中抗酸染色鏡檢3+以上即菌量較多標本,兩種分子法一致且都與參考標準不同,這很可能與異質性耐藥和檢測限有關。
對于MDR-TB 的判定,熔解曲線法更適用于初治人群,這可能是由于:①復治患者治療過程中藥物選擇作用下產生的突變并不引起氨基酸改變;②復治患者在治療中出現的耐藥突變更為復雜,超出了分子法檢測突變的范圍[17]。本實驗的不足在于沒有對不一致結果進行測序,可以在未來的研究中進一步驗證。
綜上所述,熒光PCR熔解曲線法實現了模塊封閉性自動化檢測,雖然無法取代表型藥敏技術,但是其快速、準確的特點,仍適用于結核病耐藥初篩,MDR-TB 患者可以通過盡快原則適當地進行二線藥物快速治療,取得更好的療效。

