子宮內膜病變組織血流參數測定在良惡性病變鑒別中的價值
馮金鳳,武艷嬌,陳寶霞,高敏
子宮內膜病變是婦產科臨床中常見的病變類型,且發病率呈現逐年上升趨勢[1]。在常見的子宮內膜病變中,子宮內膜增生(endometrial hyperplasia,EH)與早期子宮內膜癌(endometrial carcinoma,EC)是臨床診斷中最易混淆的類型,2種病變患者早期臨床癥狀相似,超聲檢查多表現為子宮內膜均勻或非均勻性增厚,回聲均勻或不均勻,內膜與肌層間的界限多比較清晰,且彩色多普勒血流成像(color Doppler flow imaging,CDFI)及fine-Flow初期檢查沒有特異性差異,超聲檢查結果難以鑒別[2-5]。EC是婦科臨床常見疾病,在圍絕經期高發,絕經后或育齡期亦可發病,是子宮內膜上皮惡性腫瘤,嚴重威脅患者生命健康[6]。據統計[7],EC發病率僅次于宮頸癌,位列女性生殖系統惡性腫瘤的第二位,早期確診并治療的患者,存活率相對較高。因此,尋找可靠且高效的子宮內膜病變超聲鑒別方法,對提高EC的早期確診極為重要。本研究通過分析子宮內膜病變組織超聲血流參數與子宮內膜微血管密度(MVD)的相關性,旨在為提高超聲對子宮內膜病變性質的鑒別提供依據,現將結果報道如下。
1 資料與方法
1.1 臨床資料 選取2017年1月—2019年6月河北北方學院附屬第二醫院因陰道不規則出血、陰道排液就診,經組織病理學確診為子宮內膜癌患者(惡性組)61例和子宮內膜增生患者(良性組)19例。惡性組患者年齡33~69(56.4±4.3)歲;國際婦產科協會(FIGO)分期:Ⅰ期33例,Ⅱ期19例,Ⅲ期9例。良性組患者年齡30~69(55.4±4.4)歲。2組患者年齡構成比較差異無統計學意義(P>0.05),具有可比性。入選標準:(1)患者可進行陰道超聲檢查(TVS)及病灶處CDFI、fine-Flow檢查;(2)病變經診斷性刮宮或組織病理活檢確診;(3)就診前未接受抗腫瘤治療及對子宮內膜可產生創傷的檢查、操作;(4)病歷資料完整。排除標準:(1)無法完成研究相關檢查者;(2)合并其他系統惡性腫瘤者;(3)溝通障礙、存在神經系統疾病及不能配合研究者。本研究經醫院倫理委員會批準,患者及家屬知情同意并簽署知情同意書。
1.2 檢測指標與方法
1.2.1 經陰道超聲檢查血流阻力指數(RI)、搏動指數(PI):檢查所用儀器為Voluson E10(美國GE公司生產),探頭頻率5.0~9.0 MHz。先使用二維超聲對子宮、雙側附件區及盆腔進行常規掃查,并于正中矢狀切面垂直長軸測量子宮內膜厚度,分別于子宮長軸縱切面及短軸橫切面觀察內膜增厚的形態、范圍、內部回聲及其與肌層的界限;使用fine-Flow先探查子宮內膜病灶處的微小血管,然后再使用CDFI檢查內膜病灶處血流情況,用脈沖多普勒顯示血流頻譜,測定血流處PI及RI并記錄,見圖1A、1B和圖2A、2B。
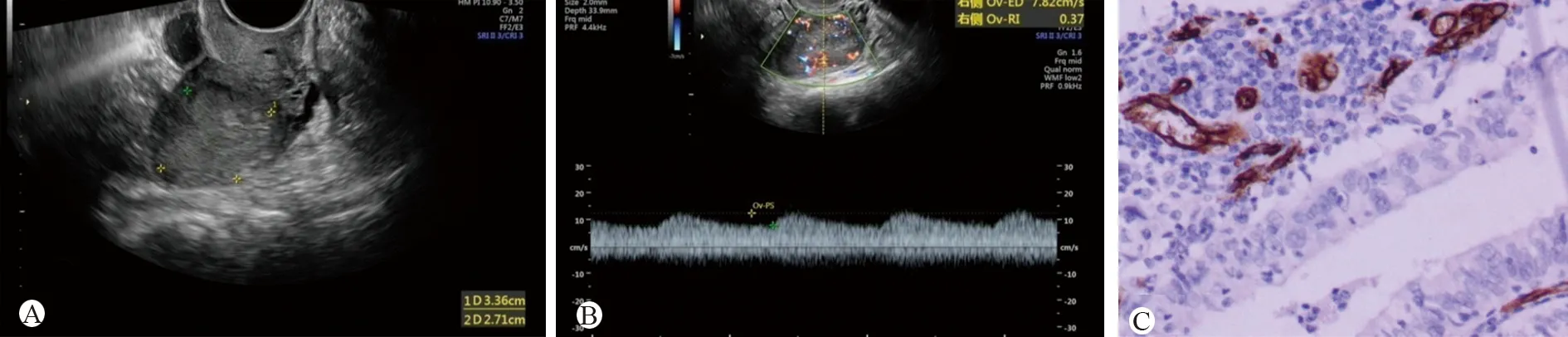
注:A.患者術前二維超聲聲像圖示宮腔內可見等回聲團塊,大小3.4 cm×2.7 cm×2.5 cm,內回聲不均,其與子宮宮底及后壁分界不清;B.頻譜多普勒呈低速低阻頻譜RI=0.37,PI=0.41,術前超聲提示惡性病變可能性大;C.術后病理診斷:低分化子宮內膜樣腺癌,血管內皮CD34呈陽性表達(免疫組織化學染色,×200),微血管計數27個圖1 子宮內膜癌患者術前超聲圖像及術后病理圖
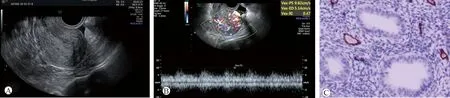
注:A.患者術前二維超聲聲像圖示子宮內膜厚1.5 cm,內回聲不均,其與子宮肌層分界尚清;B.頻譜多普勒RI=0.47,PI=0.78,術前超聲提示良性病變可能性大;C.術后病理診斷:子宮內膜增生病變,血管內皮CD34呈陽性表達(免疫組織化學染色,×200),微血管計數7個圖2 子宮內膜增生患者術前超聲圖像及術后病理圖
1.2.2 組織病理學檢查:取入選患者子宮內膜病灶組織,常規制備4 μm厚切片,采用SP免疫組化法染色,×40鏡下選取3個血管熱點區后,在×200鏡下計數微血管數量,并計算MVD,見圖1C、2C。
2 結 果
2.1 2組患者PI、RI與MVD值比較 惡性組患者病變子宮內膜組織PI、RI明顯低于良性組,而MVD則明顯高于良性組,2組間比較差異具有統計學意義(P<0.01),見表1。
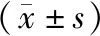
表1 2組子宮內膜病變患者PI、RI與MVD值比較
2.2 惡性組不同FIGO分期患者PI、RI與MVD值比較 EC患者子宮內膜病變組織PI、RI隨FIGO分期增高而呈下降趨勢(Ⅰ期>Ⅱ期>Ⅲ期),而MVD則隨FIGO分期增高而呈上升趨勢(Ⅰ期<Ⅱ期<Ⅲ期),見表2。
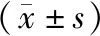
表2 惡性組不同FIGO分期子宮內膜癌患者PI、RI與MVD值比較
2.3 EC患者子宮內膜病變組織PI、RI與MVD的相關性分析 Pearson相關性分析顯示,EC患者子宮內膜病變區域PI值與MVD水平呈負相關(r=-0.683,P<0.05);同時RI值與MVD水平亦呈現負相關(r=-0.677,P<0.05)。
2.4 血流參數PI、RI對鑒別子宮內膜病變性質的診斷價值 ROC曲線分析顯示,RI、PI鑒別診斷的曲線下面積分別為0.898、0.894,其診斷子宮內膜癌的敏感度為93%和71%,特異度為63%和65%,見圖3。

注:PI.搏動指數;RI.血流阻力指數;ROC.受試者工作特征曲線圖3 血流參數PI、RI鑒別子宮內膜病變的ROC曲線
3 討 論
EC是嚴重危害女性健康的常見惡性婦科疾病,發病原因未明,發病機制與多種因素相關[8]。臨床普遍認為雌激素長期刺激是EC的主要誘導因素,據此將EC分為雌激素依賴型與非依賴型,2種類型的EC患者病理特征也不盡相同[9-10]。在臨床上常見的幾種子宮內膜病變中,EH發病亦與雌激素水平關系密切,其發展變化同時受激素水平影響,且與EC的發生、發展關系緊密[11]。據統計[12],EH約有25%的幾率可進展為EC,且兩者早期臨床表現也相同,較難鑒別。因此,尋找更為可靠的鑒別方法,對提高EC檢出率、改善患者預后及降低EC患者病死率意義重大。
隨著近年來超聲檢查設備及技術的不斷進步,特別是TVS檢查技術的廣泛應用,使子宮內膜病變診斷準確率得到顯著的提高[13]。TVS檢查能對子宮體積、形態,內膜厚度,血流信號,肌層有無浸潤及深度提供準確的數據,可為臨床診斷提供參考[14]。另外,TVS在顯示子宮內膜病變部位形態學特征的同時,還能對病灶內部及周邊血流狀態進行觀察,有利于對病變的性質進行輔助判定[15]。國外學者在1945年首次提出“腫瘤血管生成”概念,認為惡性腫瘤生長和轉移依賴于新血管的形成,而微血管形成被認為是為腫瘤提供營養的主要途徑[16]。因此認為血管生成是預測EC生長、轉移的重要因素。因腫瘤新生血管壁較薄,使腫瘤細胞易通過管壁進入血液,導致發生遠處轉移;且新生血管壁平滑肌減少表現為低阻力和高舒張血流[17]。因上述腫瘤新生血管的病理特征表現,導致腫瘤新生血管血流頻譜顯示低阻型,這是超聲血流參數評價EC新生微血管的病理學基礎[18]。
RI是指收縮期峰值流速與舒張末期流速之差和收縮期峰值流速的比值,RI值取決于舒張末期血液流速。EC病灶內新生血管結構特征決定其呈低阻力,導致血流舒張末期流速升高,流速差值減小,RI值低[7]。PI是指收縮期峰值流速與舒張末期流速之差與平均流速的比值。PI值降低受平均血流速度和舒張末期流速的影響,而平均流速更是在一定程度上體現微循環整體流速,既是血管阻力高低也是血流灌注情況的指標[19]。EC患者因腫瘤微血管生成和新生微血管的特點,病灶組織微循環狀態的改變,血流量增加,導致PI下降[9]。在子宮內膜癌患者中,腫瘤組織的新生血管壁較薄,當血液從正常壓力血管進入新血管阻力較低時,導致一定程度的壓力差,進一步導致RI、PI水平顯著降低[20-23]。因此,測量子宮內膜血流參數對區分良性和惡性子宮內膜疾病有實用的價值,可為臨床上子宮內膜病變提供有力的鑒別診斷依據。本研究中,惡性組患者病變子宮內膜組織PI、RI明顯低于良性組,而MVD則明顯高于良性組(P<0.01),且 FIGO分期Ⅰ期、Ⅱ期、Ⅲ期的子宮內膜癌患者血流參數(RI、PI)均呈逐漸降低趨勢,而MVD則隨FIGO分期增高而呈現上升趨勢,表明PI、RI不斷降低,而MVD不斷上升,可反映EC患者病情逐漸惡化,可為臨床治療方案的制定提供參考。近年來MVD計數已成為評價腫瘤血管生成的“金標準”[24]。本研究發現,EC患者RI、PI值與MVD水平呈負相關,表明PI、RI值可以間接反映微血管的豐富程度,TVS可為EC發生和發展進行無創評估,并為其病變類型判定提供依據。
綜上所述,EC患者子宮內膜病變組織血流參數中RI、PI與MVD值呈負相關,TVS檢測子宮內膜病變組織血流參數中RI值、PI值可為子宮內膜良惡性病變的判定提供依據。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
馮金鳳:提出研究思路,設計研究方法,負責文章撰寫;武艷嬌、陳寶霞:負責收集病例,綜合數據;高敏:負責數據分析、匯總、計算

