腹部推拿對慢傳輸型便秘大鼠神經遞質及5-HT 受體表達的調節作用?
王棟良,馬鑫文
新疆維吾爾自治區中醫醫院推拿科,新疆,烏魯木齊830000
慢傳輸型便秘(slow transit constipation,STC)是由于大腸功能紊亂,傳導失常而導致的排便周期延長和排便困難,屬慢性、原發性、功能性、結腸性和傳輸緩慢性便秘。其發病機制可能與腸神經系統及Cajal 間質細胞、中樞神經及自主神經系統調節功能障礙、激素水平異常等有關[1-3]。此外,長期不良的生活習慣,如起居無規律、飲食過于精細、減肥、節食及缺少運動等,均可使腸道受刺激不足,排便動作缺乏,糞便在腸腔內滯留時間過久而形成STC[4-6]。近年研究[7-10]發現,5-羥色胺(5-hydroxyptrytamine,5-HT)受體表達異常與STC 等多種胃腸道疾病的發生及發展密切相關,因此調節5-HT相關受體表達水平可能是治療STC 的潛在有效途徑。
腹部推拿是中醫特色療法之一。有研究表明,腹部推拿能改善STC 患者的臨床癥狀,緩解患者疾病狀態[11-15],但其作用機制及對神經遞質及5-HT受體表達的作用目前尚沒有明確報道。本研究通過探討腹部推拿對STC 大鼠體內神經遞質及5-HT受體表達的影響,為腹部推拿在STC 治療中的臨床應用提供依據。
1 材料與方法
1.1 動物與藥物健康雄性SD 大鼠39 只,SPF級,6 周齡,體質量(180±20)g,購自新疆醫科大學動物實驗中心,實驗動物合格證號:SCXK(新)2018-0002),自由進食、飲水飼養于實驗動物房。涉及動物實驗的操作遵照新疆醫科大學實驗動物管理和使用委員會相關規定(批號:IACVC 20180516-57)。5-HT3R、5-HT4R 和GAPDH 抗體均購自Proteintech公司;RIPA 蛋白裂解液、SP、NOS 及VIP 檢測ELISA試劑盒購自上海碧云天公司;ECL 顯色液購自Thermo 公司;酶標儀購自北京島津公司;雙垂直電泳儀、轉印電泳儀、凝膠成像儀均購自伯樂生命醫學產品有限公司。
1.2 STC 大鼠模型建立及分組將39 只大鼠隨機分為對照組、模型組及推拿組,每組13 只。模型組及推拿組大鼠采用腸神經節消融術造模:將動物麻醉后仰臥于手術臺上,無菌條件下取腹部正中切口,長約4 cm,充分暴露結腸,取寬度約1 cm雙層紗布,使用生理鹽水完全浸濕,包繞全部結腸,紗布長度與腸管相當,保持紗布濕潤,每5 min沿紗布長軸間隔約1 cm 各滴3 滴0.25%苯扎氯銨溶液,其余器官用濕紗布覆蓋、隔離,共30 min,術后逐層關腹,對照組不做處理,相同條件下繼續喂養。術后12 h 恢復大鼠正常飼養,自由進食、飲水,給予青霉素鈉抗炎1 周,觀察大鼠排便及精神和營養狀況。為確保實驗結果可靠性和減少誤差,所有模型制備均由指定動物實驗員完成,且以糞粒干燥、粒形縮短、排便費力、日排便量低于對照組大鼠作為造模成功的標準。
1.3 按摩方法造模成功后,根據文獻方法[16],選用腹部推拿中核心手法中“按法”“摩法”作為主要干預手法。為保證手法的一致性,實驗前應用YF-3 手法測定儀事先采集操作手法信息,對手法的用力大小、頻率等進行標定,建立手法操作模型。實驗過程中手法由專人操作,手法操作者除掌握手法要點外,還需應用YF-3 手法測定儀進行評測,待其手法的力度大小、頻率形成的波形軌跡與手法模型基本一致后,方可于實驗大鼠身上操作。取穴參考《實驗推拿學》[17]選取大鼠的關元穴、中脘穴。腹部按法:手法操作者以右手食指、中指二指疊按置于關元穴上,余指并攏。以右手腕關節為支點,食、中二指掌指部主動施力,向恥骨聯合脊柱方向徐徐按下,力量自輕至重,待指面可感覺到大鼠腹部動脈輕微搏動,按而留之,完成此過程大約30 s,后維持此時的壓力及其所達到的深度,靜待1 min后手法操作者掌指部徐徐上提,直至完全離開受壓部位,此過程大約持續30 s。如此反復操作2 次,共4 min。腹部摩法:手法操作者肘關節自然屈曲,腕部放松,指掌自然伸直,食指、中指并攏。以食指、中指指面著于施術部位,以腕關節為中心,連同掌、指作環形摩動,并以中脘穴為圓心,做順時針方向節律性環旋運動,頻率宜緩,每分鐘20~30 次,如此反復操作6 min,每天治療1 次,連續治療14 天。對照組及模型組只擺相同體位,不進行腹部推拿。實驗期間大鼠正常飲食,每日收集各組大鼠糞便,稱重后記為濕重,然后置于90℃恒溫干燥箱內干燥3 h 至恒重后再次稱重,記為干重,并按照以下公式計算各組大鼠糞便含水率,且在最后一次推拿24 h 后進行后續實驗。糞便含水率(%)=(濕重-干重)/濕重×100%。
1.4 大鼠血漿中SP、NOS 及VIP 水平測定大鼠眼眶后靜脈叢取血至肝素潤洗過的離心管中,室溫靜置5 min,然后置于離心機中,4℃,離心半徑13.5 cm,3500 r/min 離心10 min,取上清液,按ELISA試劑盒說明書檢測SP、NOS及VIP含量。
1.5 首粒黑便排出時間測定每組取6 只大鼠,禁食不禁水24 h 后,每只大鼠灌胃2 mL 濃度為100 g/L的活性炭懸液,記錄各組大鼠首粒黑便排出時間。由于大鼠禁食后糞便呈黑色,排出黑便不易看出,可每過半小時換1 次底盆,并將糞便倒入水池中放水,用棍子擠壓糞便,如果有黑色活性炭粉末漂出則記錄時間。結束后各組大鼠用于后續結腸組織蛋白水平的測定。
1.6 大鼠腸推動率每組取6 只大鼠,禁食不禁水24 h后,每只大鼠灌胃1 mL濃度為100 g/L的活性炭混懸液,灌胃1 h 后用烏拉坦腹腔注射麻醉,立即解剖,取出從幽門到直腸末端的全部腸道,測量腸道全長以及幽門至黑色物質前端的距離,計算腸推動率。
腸推動率(%)=幽門至黑色物質前端的距離/腸道全長×100%
1.7 大鼠結腸組織樣本采集及組織蛋白提取每組取6 只大鼠,頸椎脫臼處死后迅速分離結腸組織,用生理鹽水小心清洗干凈腸道內容物,用濾紙吸干表面水分后將一部分結腸組織放入10%中性甲醛中固定,其余放入玻璃勻漿器中,加入RIPA 蛋白裂解液,用玻璃勻漿器勻漿,直至充分裂解,置于4℃離心機以離心半徑13.5 cm,12 000 r/min離心10 min,用移液槍將上清液移至另一干凈離心管中,并加入SDS 上樣緩沖液,混勻后放入100℃水浴5 min,然后放入-20℃儲存備用。
1.8 蘇木精-伊紅(Hematoxylin-eosin staining,HE)染色將在10%中性甲醛中固定24 h 后的結腸組織轉移至75%的酒精中,經自動組織脫水機脫水、透明處理,在石蠟包埋機中浸蠟、包埋,進行5μm 切片,水浴展開、撈片、瀝干,放溫箱中烘干,置于烘箱中60℃烤2 h,常規HE 染色,在顯微鏡下進行組織病理學觀察。HE 染色步驟:1)脫蠟:將石蠟切片依次置于二甲苯(I)5 min→二甲苯(Ⅱ)5 min;2)復水:依次置于100%乙醇2 min→95%的乙醇1 min→80%乙醇1 min→75%乙醇1 min→蒸餾水洗2 min,各2次,然后吸干水份;3)蘇木精染色:置于蘇木精溶液中2 min,自來水流水沖洗2 min,把水吸干;4)分化:1%鹽酸乙醇分化30 s,自來水浸泡15 min,吸干水份;5)伊紅染色:置于伊紅溶液中2 min;6)脫水:依次置于95%乙醇(I)5 min→95%乙醇(Ⅱ)5 min→100%乙醇(I)5 min→100%乙醇(Ⅱ)2 min;7)封片:置于通風櫥,待乙醇徹底干后依次置于二甲苯(I)5 min→二甲苯(Ⅱ)5 min,待載玻片上殘留二甲苯揮干后用中性樹膠封片。
1.9 蛋白濃度測定將凍存的結腸組織蛋白液于室溫下融化,采用BCA 法測定蛋白濃度,處理好待測樣品后,取50 μg 蛋白進行SDS-PAGE 電泳分離,轉膜,將分離的蛋白電轉移至PVDF 膜上。封閉液室溫封閉1 h,經5-HT3R、5-HT4R 及GAPDH 抗體(1∶1000)孵育后,4℃過夜。PBST 充分洗膜后,加入二抗(1∶2000)室溫孵育1 h,PBST清洗后顯色液顯影,利用凝膠成像儀成像后進行灰度值檢測。
1.10 統計學方法應用SPSS 19.0統計軟件分析數據,應用Graphpad prism 5 作圖,應用Image J軟件進行免疫印跡灰度值檢測,計量資料以±s表示,組間比較采用單因素方差分析,P<0.05表示差異有統計學意義。
2 結果
2.1 各組大鼠糞便含水率模型組大鼠糞便含水率為(60.11±1.14)%,低于對照組的(65.29±1.01)%(P<0.05),推拿組大鼠糞便含水率為(64.97±0.98)%,高于模型組(P<0.05),提示腹部推拿能夠改善STC大鼠糞便含水率,緩解STC大鼠的疾病狀態。
2.2 各組大鼠血漿SP、NOS 及VIP 水平與對照組相比,模型組大鼠血漿SP 水平下降(P<0.05),VIP及NOS水平升高(P<0.05),提示STC 大鼠發病機制可能與體內神經遞質水平改變有關;與模型組相比,推拿組大鼠體內SP 水平升高(P<0.05),VIP及NOS水平降低(P<0.05),提示對STC 大鼠連續腹部推拿14 天能夠調節其體內相關神經遞質水平,改善STC大鼠疾病進展與轉歸。見表1。
表1 各組大鼠血漿SP、VIP及NOS水平(±s)
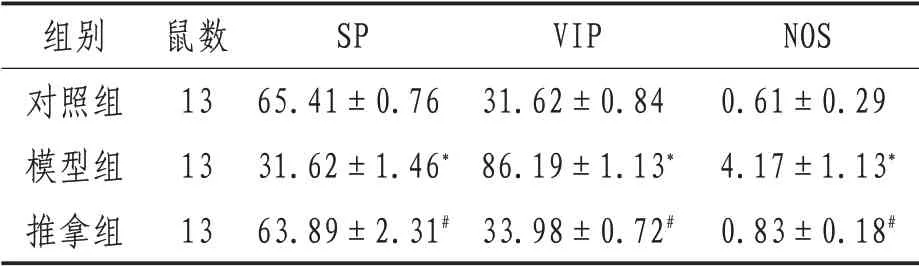
表1 各組大鼠血漿SP、VIP及NOS水平(±s)
注:*表示與對照組比較,P<0.05;#表示與模型組比較,P<0.05
組別對照組模型組推拿組鼠數13 13 13 SP 65.41±0.76 31.62±1.46*63.89±2.31#VIP 31.62±0.84 86.19±1.13*33.98±0.72#NOS 0.61±0.29 4.17±1.13*0.83±0.18#
2.3 各組大鼠首粒黑便排出時間模型組STC大鼠首粒黑便排出時間為(10.68±2.11)h,長于對照組的(5.13±1.51)h(P<0.05),提示造模成功;推拿組大鼠首粒黑便排出時間為(6.12±1.39)h,短于模型組,推拿組與對照組比較差異無統計學意義(P<0.05);提示腹部推拿可以改善STC大鼠的首粒黑便排出時間,改善STC大鼠的病理狀態,改變疾病狀態。
2.4 各組大鼠腸推動率與對照組相比,模型組大鼠腸推動率降低(P<0.05),提示STC 大鼠發病機制與腸推動率改變有關;與模型組相比,推拿組大鼠腸推動率升高(P<0.05),提示腹部推拿可改善大鼠腸推動率。見表2。
表2 各組大鼠腸推動率(±s)
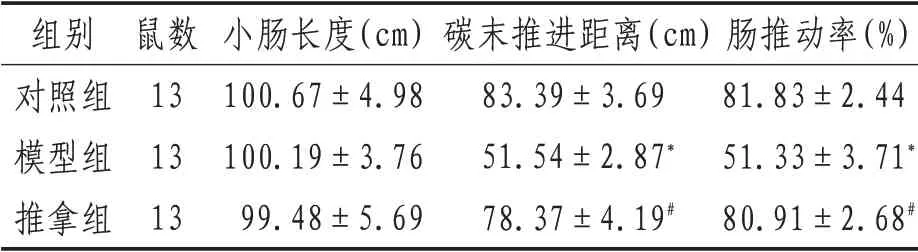
表2 各組大鼠腸推動率(±s)
注:*表示與對照組比較,P<0.05;#表示與模型組比較,P<0.05
組別對照組模型組推拿組鼠數13 13 13小腸長度(cm)100.67±4.98 100.19±3.76 99.48±5.69碳末推進距離(cm)83.39±3.69 51.54±2.87*78.37±4.19#腸推動率(%)81.83±2.44 51.33±3.71*80.91±2.68#
2.5 各組大鼠結腸組織病理學與對照組相比,模型組大鼠結腸組織黏膜層及肌層染色淺,厚度增加,結腸絨毛上皮細胞可見脫落,提示造模成功;與模型組相比,推拿組STC 大鼠結腸組織黏膜層及肌層染色深,偶見結腸絨毛上皮細胞脫落,細胞排列整齊,細胞形態圓潤,細胞間隙縮小;提示對STC 大鼠進行連續14 天的腹部推拿,有利于STC大鼠結腸組織細胞的恢復,改善STC大鼠結腸組織的病理學轉歸。見圖1。
2.6 各組大鼠結腸組織5-HT3R、5-HT4R 水平與對照組相比,模型組大鼠結腸組織5-HT3R、5-HT4R水平降低(P<0.05);提示STC 大鼠發病機制可能與5-HT 受體表達有關;與模型組相比,推拿組大鼠5-HT3R、5-HT4R水平升高(P<0.05),提示腹部推拿可能通過調節STC大鼠體內神經遞質水平,進而調節大鼠結腸組織5-HT3R、5-HT4R水平。見圖2。

圖2 各組大鼠結腸組織5-HT3R、5-HT4R水平
3 討論
5-HT是參與調節胃腸道分泌和運動功能的重要神經遞質和旁分泌信號分子。其中5-HT3、5-HT3R、5-HT4R與胃腸道動力緊密聯系,其分泌、轉運異常都能引起胃腸道疾病[5-8]。現代研究顯示腸神經遞質失調是導致功能性便秘的主要病理變化。5-HT、NO、SP、VIP 是調節腸道功能的重要神經遞質,通過興奮或抑制作用調節腸道運動[9-10]。
本研究首次采用大鼠腸神經節消融術建立STC大鼠模型,探討腹部推拿對STC大鼠體內神經遞質水平及5-HT 受體表達的影響,結果表明,與模型組相比,推拿組大鼠糞便含水率升高,提示腹部推拿可能通過改變STC 大鼠腸道細胞通透性增加糞便含水率;推拿組大鼠體內SP 水平升高,VIP及NOS 水平降低,首粒黑便排出時間縮短,腸推動率升高,提示腹部推拿可能通過刺激STC 大鼠胃腸道調節體內相關神經遞質水平,進而改善大鼠胃腸道蠕動功能;推拿組大鼠結腸組織黏膜層及肌層染色深,偶見結腸絨毛上皮細胞脫落,細胞排列整齊,形態圓潤,細胞間隙縮小,提示腹部推拿有利于STC大鼠結腸組織細胞的恢復,改善STC大鼠結腸組織的病理學轉歸;推拿組大鼠5-HT3R、5-HT4R 水平升高,提示腹部推拿可能通過調節STC大鼠體內神經遞質水平,進而調節STC 大鼠結腸組織5-HT3R、5-HT4R 水平,從而改善STC 大鼠疾病狀態及疾病轉歸。
綜上所述,腹部推拿能夠改善STC 大鼠疾病狀態,同時調節其體內神經遞質及5-HT受體表達。

