軟骨終板干細胞及骨髓間充質干細胞對軟骨終板細胞增殖分化的影響
高健明,汪 靖,劉 晨,肖 良,彭 江,汪愛媛,徐宏光
1皖南醫學院 脊柱研究中心,皖南醫學院第一附屬醫院弋磯山醫院 脊柱外科,安徽蕪湖 241001;2 解放軍總醫院 全軍骨科戰創傷重點實驗室,骨科再生醫學北京市重點實驗室,北京 100853
下腰痛是臨床常見疾病,目前認為椎間盤退變是導致下腰痛的主要原因[1]。椎間盤中,軟骨終板由透明軟骨組成,是供應成熟椎間盤營養物質的主要通道[2]。軟骨終板細胞(cartilage endplate cell,CEP)功能異常和數量減少會導致軟骨終板鈣化或硬化進而減少椎間盤營養物質的供應,最終導致椎間盤退變的發生。有研究表明軟骨終板存在原位干細胞即軟骨終板干細胞(cartilage endplate stem cell,CESC),具有較強的克隆形成能力和多向分化潛能[3-5]。骨髓間充質干細胞(bone marrow mesenchymal stem cell,BMSC)是一種骨髓來源的干細胞,在一定條件下能夠分化成為成骨細胞、成軟骨細胞、成肌細胞、脂肪細胞、神經細胞等,可用于多種組織缺損的修復[6]。隨著組織工程學的發展,BMSC 作為一種具有多種分化潛能的種子細胞越來越受到人們的關注。本實驗獲取了大鼠腰椎軟骨終板組織,分離出CEP 和CESC,將CEP 分別與CESC、BMSC 進行體外非接觸式共培養,通過檢測各共培養組的增殖與凋亡,及軟骨表型基因ACAN、COLⅡ及Sox9 的表達,對比探討CESC、BMSC 對CEP 的影響,進而探討CESC 作為組織工程種子細胞的潛在可能。
材料和方法
1實驗動物 SD 清潔級大鼠20 只,體質量200~300 g,雌雄不限,由北京市科宇動物養殖中心提供。
2主要試劑 0.25% EDTA-胰酶(Gibco);0.2%Ⅱ型膠原酶(Sigma);DMEM/F12 (Gibco);干細胞培養用血清(上海雙洳生物科技有限公司);干細胞成骨分化誘導培養基(賽業生物科技有限公司);干細胞成軟骨分化誘導培養基(賽業生物科技有限公司);干細胞成脂分化誘導培養基(賽業生物科技有限公司);甲苯胺藍染色劑(索萊寶生物科技有限公司);茜素紅染色液(索萊寶生物科技有限公司);油紅O 染色劑(索萊寶生物科技有限公司);番紅染色液(索萊寶生物科技有限公司)。
3大鼠腰椎CEP 及CESC 的分離和培養 取5 只清潔級SD 大鼠,麻醉后分離出軟骨終板,剪碎,將軟骨終板置于DMEM/F12 配制0.02%的Ⅱ型膠原酶中,37℃下消化4 h,離心重懸后種植于培養瓶中,在37℃、5% 的CO2培養箱中培養,每3 d 換液1 次,獲得CEP,按時用倒置顯微鏡觀察、拍照。待細胞融合至90%時,進行甲苯胺藍染色。同時將上述獲得的部分原代細胞按照100/cm2的密度接種到底面積25 mm3培養瓶中[3,7],37℃、5%的CO2培養箱中培養,每3 d 換液1 次,培養10 d,獲得CESC。
4大鼠BMSC 的分離和培養 取5 只清潔級SD大鼠,以3% 戊巴比妥鈉40 mg/kg 腹腔注射麻醉,無菌操作下取其四肢的長骨,用注射器抽取長骨內骨髓,加含10%胎牛血清的培養液吹打制成單細胞懸液,分裝于底面積為25 mm2培養瓶中。在37℃、5%的CO2培養箱中培養,每3 d 換液1 次,待細胞融合至90%時,用體積分數0.25%胰蛋白酶消化、傳代。
5大鼠CESC 及BMSC 的三系誘導分化 分別取P3 代大鼠CESC 及BMSC,接種于6 孔板,待細胞融合至80%時分別加入成脂細胞誘導液、成軟骨誘導液及成骨誘導液。培養21 d 后,分別用油紅染液、番紅染液及茜素紅染液染色,倒置顯微鏡下觀察拍照。
6Transwell 細胞共培養 分別將P3 代大鼠CEP、CESC 和BMSC 用體積分數0.25% 胰蛋白酶消化3 min,加入DMEM/F12 培養基終止消化,細胞懸液收集至離心管,1 500 r/min 離心5 min。收集細胞,棄上清后,細胞用含15%胎牛血清的培養液重懸,進行細胞計數。根據Transwell 小室上下室加入的不同細胞,分為CEP 組(上室為CEP,下室為CEP)、CESC 組(上室為CESC,下室為CEP)、BMSC 組(上室為BMSC,下室為CEP),即分別將CESC、BMSC 及CEP 懸液接種于Transwell 小室的上室,孔中細胞數約5 × 104個,加入培養基2 mL。而后分別將CEP 的懸液接種于Transwell小室的下室,孔中細胞數約5 × 104個,加入培養基2 mL,共培養1 d、3 d、5 d 和7 d,培養期間每2.5 d 換液1 次(圖1)。

圖1 實驗分組 Transwell 共培養示意圖Fig.1 Transwell co-cultivation diagram of experimental groups
7CCK-8 實驗檢測大鼠CEP 增殖能力 利用Transwell 小室將大鼠CEP 分別與CESC 和BMSC進行非接觸式共培養1 d、3 d、5 d 及7 d 后,分別更換培養基,加入CCK-8 液后繼續培養2 h,吸取上清液于96 孔板,每個孔設定3 個復孔,無細胞處理的CCK-8 試劑作為空白對照,用酶標儀測定吸光度值,每天同一時間進行檢測,計算數據后,繪制共培養前后CEP 的生長曲線。
8流式細胞術檢測CEP 凋亡率 待CEP 組、CESC 組及BMSC 組軟骨終板細胞融合至80%左右時,用體積分數0.25%胰蛋白酶消化3 min,加入含10% 胎牛血清的DMEM/F12 培養基終止消化,細胞懸液收集至離心管,2 000 r/min 離心5 min,PBS 洗滌2 次,收集3 × 105個細胞,加入500 μL 的Binding Buffer 懸浮細胞,再依次加入5 μL Annexin V-FITC、5 μL Propidium Iodide 混勻,室溫避光條件下反應10 min,在流式細胞儀下檢測細胞凋亡情況。
9RT-qPCR 檢測三組Transwell 小室CEP 軟骨表型基因ACAN、COLⅡ、Sox9 的表達情況 分別在共培養1 d、3 d、5 d 和7 d 提取CEP RNA,反轉錄為cDNA。COL2A1 上游引物5’ CCTGAAA CTCTGCCACCCAG 3’,下游引物5’ GTTCTT CCGAGGCACAGTCG 3’,ACAN 上游引物5’ACACCCCTACCCTTGCTTCT 3’,下游引物5’AAAGTGT CCAAGGCATCCAC 3’,Sox9 上游引物5’ CGTCAACGGCTCCAGCA 3’,下游引物5’ TGCGCCCACACCATGA 3’。擴增反應條件:95℃預變性30 s,95℃變性10 s,58℃退火30 s,72℃延伸45 s,重復40 個循環。結果用-△△Ct表示。
10統計學方法 采用SPSS 18.0 軟件分析實驗數據,實驗數據以表示,各組間差異用單因素方差分析,P<0.05 為差異有統計學意義。
結果
1大鼠CESC、BMSC、CEP 分離及培養結果 大鼠CEP 接種到培養瓶,在單克隆3 d 后,可見培養皿中有細胞集簇形成,5 d 后集簇明顯,形態呈梭形,細胞排列有序(圖2);CEP 培養10 d 后細胞接近融合,在 DMEM/F12 培養基中呈多角形或梭形,貼壁生長,細胞遮光性良好。通過穿刺抽吸法獲得BMSC,細胞以分散集落方式增長,多呈紡錘形或短梭形,部分細胞呈多邊形(圖3)。
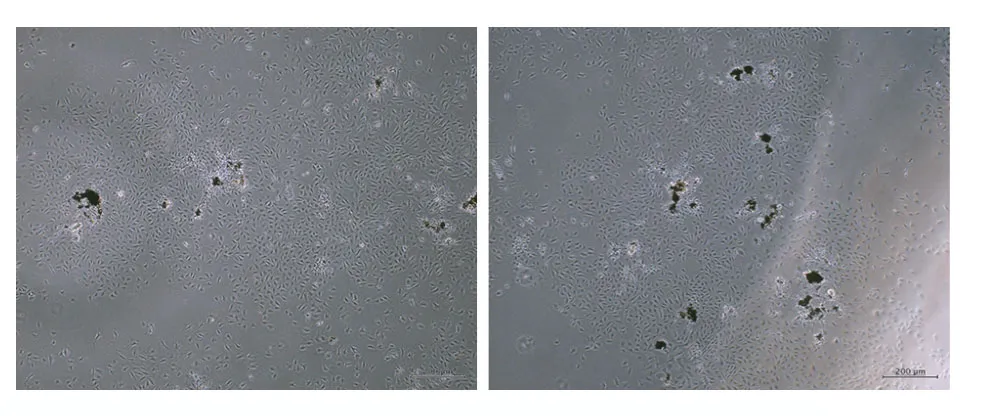
圖2 單克隆法培養后獲得大鼠CESC,細胞集簇生長Fig.2 CESC of rats was obtained after culturing by monoclonal method,and the cells grew in clusters

圖3 大鼠BMSC 提取及培養,細胞呈現集落生長Fig.3 BMSC of rats was extracted and cultured,and the cells showed colony formation activity
2CEP 的細胞外基質分泌 CEP 通過甲苯胺藍染色可見CEP 能夠分泌細胞外基質酸性黏多糖及膠原如GAG,具有特征性多角形形態、呈鋪路石樣分布(圖4)。
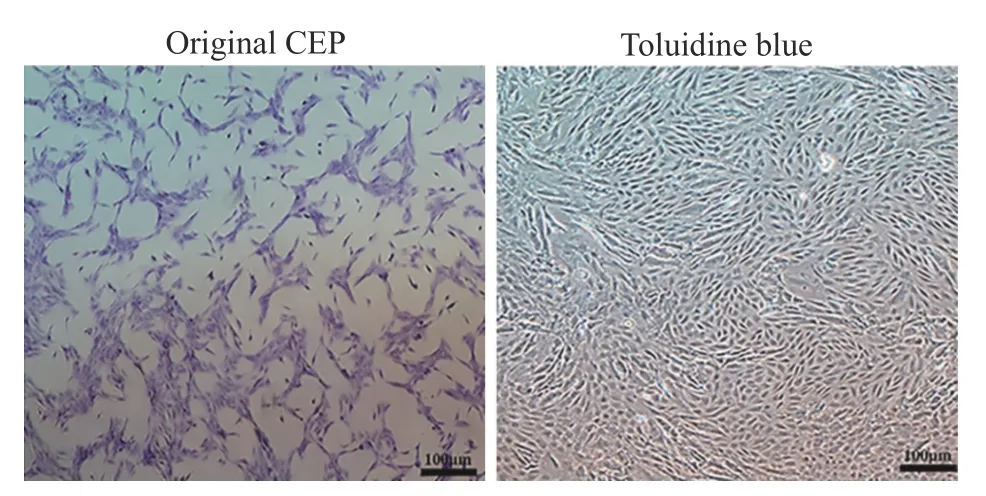
圖4 大鼠CEP 培養與甲苯胺藍染色,CEP 呈多角形或梭形,貼壁生長,細胞遮光性良好Fig.4 CEP of rats was cultured and stained with toluidine blue.The CEP was polygonal or fusiform,it grew adherently,and the cells had good shading properties
3CESC、BMSC 三系誘導分化鑒定 經過擴增后的CESC 進行成脂誘導20 d、21 d 后分別進行油紅O 染色,顯微鏡下均可以觀察到大量的紅染脂滴空泡形成。CESC 經過28 d 成軟骨誘導,番紅染色顯示CESC 染色為紅色;經過擴增以后的CESC 進行成骨誘導28 d,經過茜素紅染色,顯微鏡下均可以觀察到有大量鈣結節形成。BMSC 成脂誘導3 周后脂滴數量增加并相互融合,細胞由長梭形變為圓形或多邊形,油紅O 染色顯示細胞含有豐富的脂肪顆粒;BMSC 成軟骨誘導4 周,番紅染色顯示BMSC 染色為紅色;BMSC 經成骨誘導28 d 后,局部細胞呈重疊生長,間充質逐漸堆積、間充質中礦鹽沉積,形成多個結節,并逐漸融合,茜素紅染色可見紅色鈣結節(圖5)。
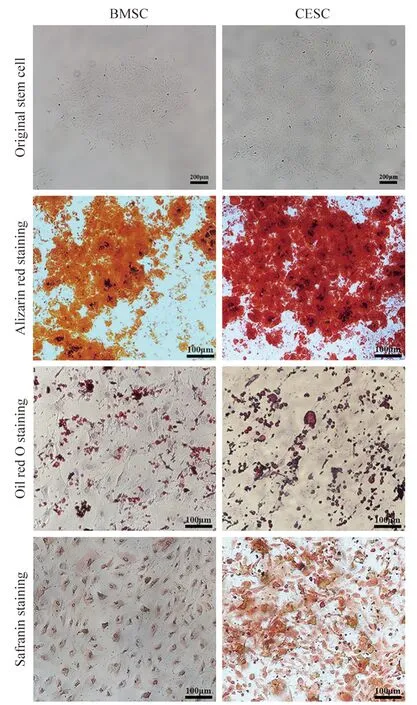
圖5 CESC、BMSC 的三系誘導分化,CESC 成脂誘導后,油紅O 染色可以觀察到大量的紅染脂滴空泡形成,成軟骨誘導番紅染色呈紅色,成骨誘導茜素紅染色觀察到有大量鈣結節形成;BMSC 成脂誘導后脂滴數量增加并相互融合,細胞由長梭形變為圓形或多邊形,油紅O 染色顯示細胞含有豐富的脂肪顆粒,成軟骨誘導番紅染色顯示BMSC 染色為紅色,成骨誘導茜素紅染色可見紅色鈣結節Fig.5 The three lines of CESC and BMSC induced differentiation.After CESC was induced into adipogenesis,a large number of red-stained lipid droplets formation could be observed by oil red O staining,the cartilage-induced safranin staining was red,and osteogenic-induced alizarin red staining showed the formation of a large number of calcium nodules.The number of lipid droplets increased and merged with each other after BMSC adipogenesis.The cells changed from a long spindle shape to a round or polygonal shape.Oil red O staining showed that the cells were rich in fat particles.Cartilage induced safranin staining showed that BMSC was stained red,and osteogenic alizarin red staining showed red calcium nodules
4三組細胞的增殖能力 CCK-8 實驗結果顯示,在3 d 時,CESC 組、BMSC 組及CEP 組組間有統計學差異(P<0.05),提示與CESC、BMSC、CEP共培養后促進了CEP 的增殖能力,且CESC 組增殖能力強于BMSC 組(圖6)。

圖6 CCK-8 檢測共培養結果,在3 d 時,CESC 組和BMSC 組增殖能力均強于CEP 組,且CESC 組增殖能力強于BMSC(aP<0.05,vs CEP;bP<0.05, vs BMSC)Fig.6 CCK-8 test co-culture results showed that on the 3rd day,the proliferation ability of the CESC group and the BMSC group was stronger than that of the CEP group,and the proliferation ability of the CESC group was stronger than that of the BMSC group (aP<0.05,vs CEP;bP<0.05, vs BMSC)
5共培養對CEP 凋亡率的影響 流式結果提示,共培養7 d 后,三組細胞的凋亡率無統計學差異(圖7)。
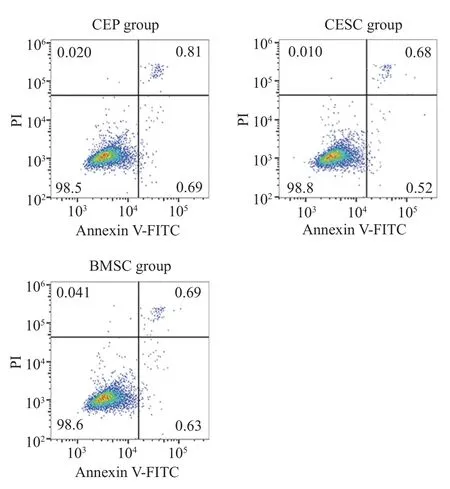
圖7 流式細胞術檢測,CESC 及BMSC 共培養對CEP 凋亡無影響Fig.7 Flow cytometry showed that the co-culture of CEP and BMSC had no effect on CEP apoptosis
6共培養后各組CEP 相關特異性基因的表達RT-qPCR 結果表明三組CEP 共培養1~7 d,ACAN、COLⅡ和Sox9 三種基因的表達均呈波峰狀改變,3 d 表達水平最高。1 d、7 d 三組軟骨表型基因ACAN、COLⅡ和Sox9 表達差異無統計學意義(P>0.05),3 d、5 d時CESC組ACAN、COLⅡ和Sox9 表達高于BMSC 組和CEP 組,差異有統計學意義(P<0.05)(圖8)。
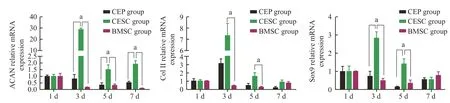
圖8 共培養后各組CEP 相關特異性基因的表達情況,三組間差異有統計學意義(aP<0.05);1~ 7 d CESC 組三種基因ACAN、ColⅡ和Sox9 表達均呈波峰狀改變,3 d CESC 組三種基因ACAN、ColⅡ和Sox9 表達水平最高,差異有統計學意義(P<0.05)Fig.8 After co-cultivation,the expression of CEP-related specific genes in each group was detected,and the difference between the three groups was statistically significant (aP<0.05);the expressions of the three genes ACAN,ColⅡ and Sox9 in the CESC group from 1 d to 7 d all showed peak-like changes.The expression levels of the three genes ACAN,ColⅡ and Sox9 were the highest in the CESC group at the 3 d,and the difference was statistically significant (P<0.05)
討論
目前,以組織工程等為代表的治療方法逐漸被人們所認知,其利用干細胞組織工程等技術手段從根本上延緩軟骨終板退變[8]。既往的組織工程技術,大部分利用種子細胞的擴增和分化效應,或以細胞本身作為元件以求修復缺損組織。早在2004 年,Mizuno 等[9]采用髓核源性細胞作為種子細胞進行組織工程,再附加支架材料,實現了由修復單元新生組織與原生椎間盤組織結構類似的實驗結果。在既往的椎間盤組織工程研究中,關于種子細胞的選擇一直沒有定論,包括髓核細胞、纖維環細胞和不同組織來源干細胞都是研究者們的研究目標[10-13]。
椎間盤終板軟骨干細胞的獲取,又提供了一種干細胞來源,且方法簡單,能夠快速大量得到種子細胞。在現階段,對于軟骨終板干細胞的研究還處于初級階段,常獻等[14]同樣分離了人CESC,通過Transwell 的方式與退變的髓核細胞進行非接觸式體外共培養,證實了CESC 向髓核細胞分化的功能,從一定程度上證明了CESC 作為種子細胞的潛質。早期,Liu 等[15]通過對比CESC 與BMSC 的增殖能力,證實了兩者具備相同的增殖潛力。而最新的研究報道了CESC 對于髓核細胞存在調控作用,從一定程度上證明了CESC 作為種子細胞可對其他椎間盤組織部分產生積極作用[16-17]。但在目前的椎間盤組織工程技術領域中,應用較為廣泛的仍是BMSC[18-20]。雖然BMSC 的獲得方法也較為簡單,但不同來源的干細胞分化趨向不同。早期的研究報道了CESC 具備與BMSC、髓核源性干細胞、纖維環源性干細胞相似的增殖能力和分化能力[21-22]。但并沒有報道將CESC 作為種子細胞作用于CEP 的實驗。因為CESC 具備較強的成骨分化能力而不是成軟骨分化能力[23]。所以研究者們在對CESC 成軟骨分化調控方面做出大量的研究[24]。我們認為在探究CESC 作為種子細胞潛質的同時,需同時考慮CESC 對CEP 的影響。為了更好地研究CESC 對CEP 的表型影響,同時對比BMSC 對CEP 的影響效果,本實驗分離鑒定了CESC 和BMSC。
提取CESC 的方法包括差速貼壁法[21]、Fibronectin 差別篩選法[17]、瓊脂糖凝膠法和單克隆法[25-26]。本實驗通過單克隆法的低密度培養,從軟骨終板中分離出CESC,同時按照公認的軟骨細胞提取方法提取出CEP[27-29]。在獲取CESC 過程中,我們發現細胞接種密度達100/cm2時,獲取效率最高。骨細胞分泌的含鈣基質能夠被茜素紅染成紅色,脂肪細胞內部形成的脂肪滴能夠特異性地與油紅O 染色液結合而被染成鮮紅色,軟骨細胞所分泌的軟骨基質能夠被番紅染成紅色。利用以上的染色原理,我們對CESC 及BMSC 的多向分化能力進行了初步鑒定與比較,發現CESC 的成骨及成軟骨方向分化能力要強于BMSC,而BMSC 的成脂肪分化能力要強于CESC,這也證明了CESC 良好的分化能力和應用在椎間盤組織工程中的潛力。在進行多向分化誘導后,未檢測成骨、成脂肪及成軟骨方向的基因變化情況,是本實驗的不足之處,也是我們未來的研究方向之一。
目前的共培養體系主要包括非接觸共培養及接觸共培養兩種。非接觸式共培養的優點在于能更好地了解細胞共培養時的效應,以及能夠排除其他因素的干擾。本實驗采用Tanswell 小室,將不同的干細胞種在上室內,由于聚碳酸酯膜有通透性,上層培養液中的成分可以影響到下室內的細胞,從而可以研究上層培養液中的成分對細胞生長、運動等的影響[30]。這種在培養時使目標細胞間不直接接觸的培養模式,可以更加清晰地分辨兩種細胞之間的互相作用,也有利于探究其機制。但兩種不同干細胞分別與軟骨終板細胞非接觸式共培養后,未進一步檢測具體相關分子機制和信號通路,是本實驗的不足之處,之后將對此進一步深化研究。
本實驗發現,將CESC、BMSC 與CEP 進行非接觸共培養后,CESC 可以促進CEP 軟骨表型基因ACAN、COLⅡ、Sox9 表達,并且強于BMSC對CEP 的影響。這表明經過共培養的CESC 可增強CEP 特異性相關分子的表達,有延緩甚至逆轉軟骨終板退變的潛質。細胞增殖及凋亡實驗發現,與CESC 及BMSC 共培養的CEP 增殖能力均增強,且CESC 對CEP 的增殖能力強于BMSC,CESC 和BMSC 對CEP 的凋亡沒有影響。CESC作為椎間盤內源性干細胞,對椎間盤內環境具有天然的適應力,且CESC 在椎間盤術中容易獲取,但目前無法滿足自體應用的條件。因此,CESC 無法作為組織工程傳統意義上的種子細胞應用于臨床進行組織的退變、缺損修復,而需要與原生組織的CEP 進行共同作用[31]。
綜上所述,我們發現CESC 對軟骨終板原生的軟骨細胞有促增殖和分化作用,在后續的研究和實驗中,可以采取體內募集CESC 或誘導增強CESC 功能的方式進行椎間盤組織工程的修復,來實現我們再生修復軟骨終板的最終目的,且相關的支架材料也是我們未來的重要研究方向[32-33]。鑒于此,我們認為CESC 滿足作為種子細胞的必備條件,在組織工程技術修復椎間盤退變方面具有相當的潛力。

